2.1 钠及其化合物 课件(共33张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1 钠及其化合物 课件(共33张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 15:49:27 | ||
图片预览






文档简介
(共33张PPT)
第二章 海水中的重要元素
——钠和氯
第一节 钠及其化合物
1
一、钠的存在
钠元素在自然界中都以______ 的形式存在,如:
NaCl、Na2CO3、Na2SO4等。
化合物
二、物理性质
(如颜色、状态、气味、熔点、沸点、硬度、密度等等)
【演示实验2-1】
钠为银白色固体,密度为0.971g/cm3,比水的密度小;
熔沸点较低,分别为97.8和883 ℃,硬度小,用小刀可以切割。
三、钠的原子结构与化学性质
结构决定性质
请同学画出钠的原子结构示意图并预测钠可能有哪些化学性质?
钠具有很强的还原性!可以和很多氧化性物质反应,如氧气、水、高价态化合物等等。
请同学试着说下钠的物理性质?
CO2?
问:钠应保存在哪里?
石蜡油或煤油
4Na + 3CO2 =2Na2CO3 + C
一、活泼的金属单质----钠
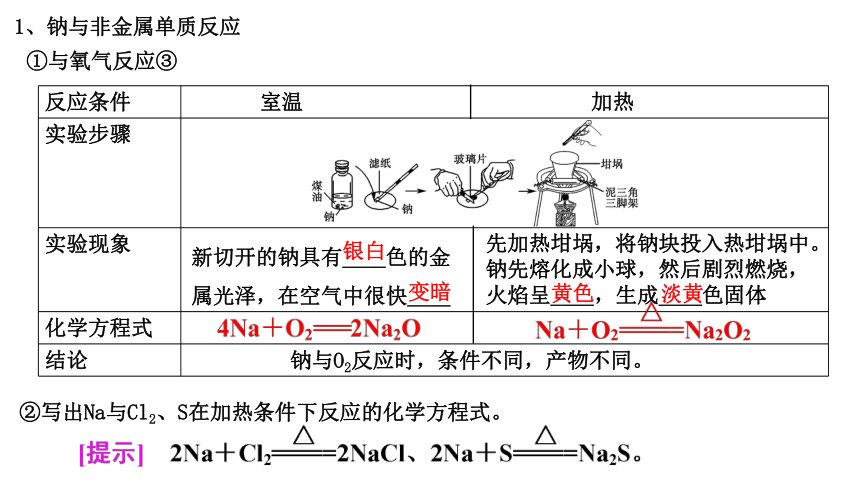
1、钠与非金属单质反应
①与氧气反应③
反应条件 室温 加热
实验步骤
实验现象
化学方程式
结论
先加热坩埚,将钠块投入热坩埚中。钠先熔化成小球,然后剧烈燃烧,火焰呈____,生成____色固体
钠与O2反应时,条件不同,产物不同。
新切开的钠具有____色的金属光泽,在空气中很快____
银白
变暗
黄色
淡黄
②写出Na与Cl2、S在加热条件下反应的化学方程式。
浮
熔
游
响
红
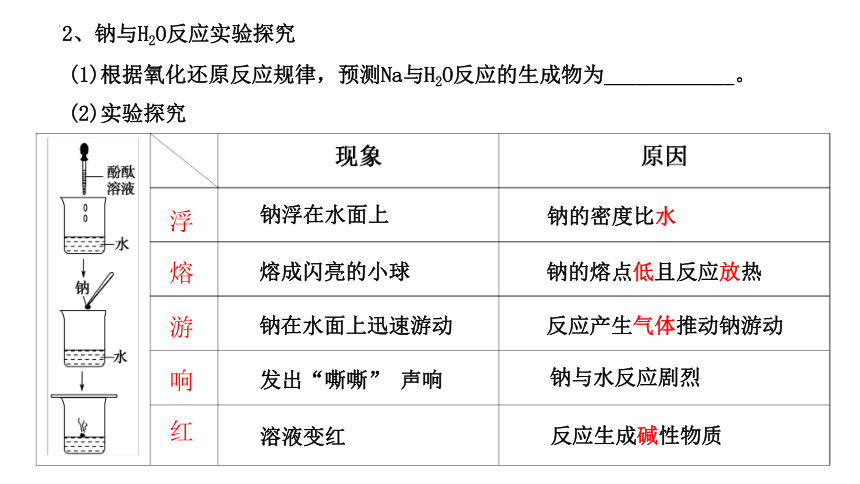
2、钠与H2O反应实验探究
(1)根据氧化还原反应规律,预测Na与H2O反应的生成物为____________。
钠浮在水面上
钠的密度比水
熔成闪亮的小球
钠的熔点低且反应放热
钠在水面上迅速游动
反应产生气体推动钠游动
发出“嘶嘶” 声响
钠与水反应剧烈
溶液变红
反应生成碱性物质
(2)实验探究
(3)实验结论:
钠与水反应剧烈,生成__ _______,化学方程式是__ _____________________。
离子方程式为_______________________________,氧化剂为________。
NaOH和H2
2Na+2H2O===2NaOH+H2↑
2Na+2H2O===2Na++2OH-+H2↑
H2O
1、钠等活泼金属着火时如何灭火?为什么不用H2O灭火?
[提示] 需用干燥的沙土灭火。钠与H2O反应生成可燃性气体H2,易燃烧和爆炸。
2、钠与H2O反应比钠与盐酸反应更剧烈?
3、将一小块钠投入盛有饱和澄清石灰水的试管里,可看到什么现象?
4、将一块钠投入CuSO4溶液中,可看到什么现象?
写出Na与盐酸反应的离子方程式。
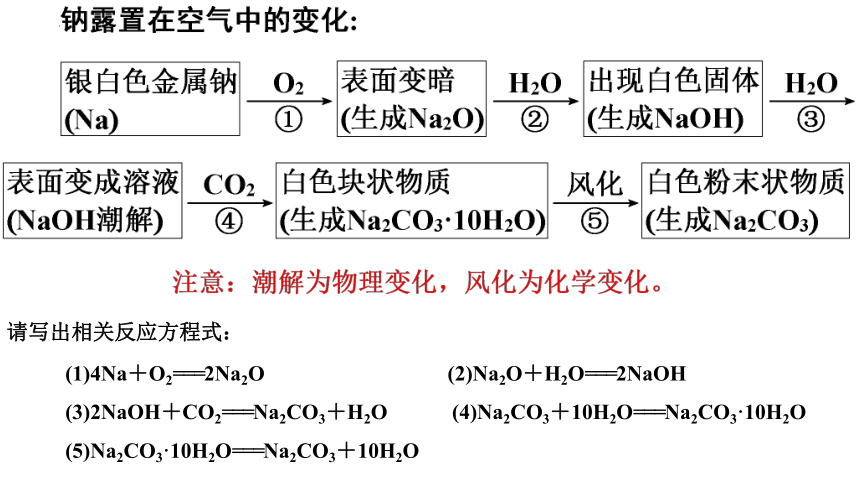
5、钠露置在空气中会发生怎样的变化?
(1)4Na+O2===2Na2O (2)Na2O+H2O===2NaOH
(3)2NaOH+CO2===Na2CO3+H2O (4)Na2CO3+10H2O===Na2CO3·10H2O
(5)Na2CO3·10H2O===Na2CO3+10H2O
请写出相关反应方程式:
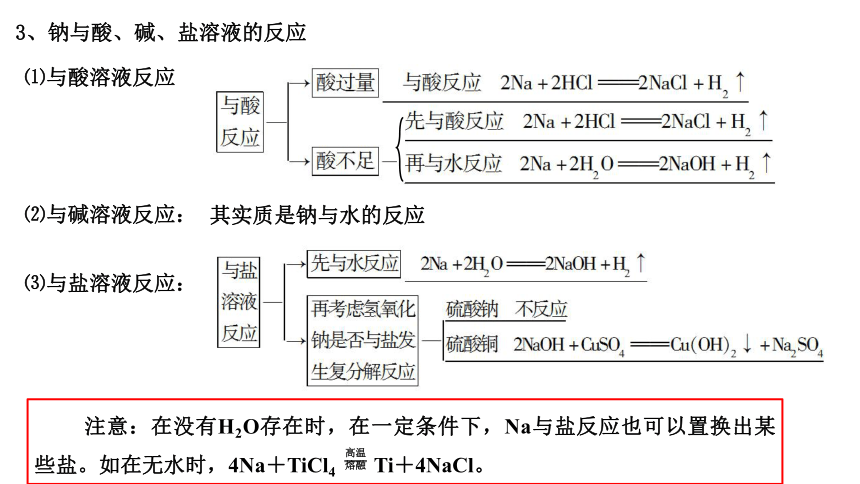
3、钠与酸、碱、盐溶液的反应
⑴与酸溶液反应
⑵与碱溶液反应:
其实质是钠与水的反应
⑶与盐溶液反应:
注意:在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐。如在无水时,4Na+TiCl4 Ti+4NaCl。
高温熔融
D
如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定在水的中央),将10 g金属钠分多次投入水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。在投入钠的过程中小球上升。
问题探究:(1)10 g Na分多次投入的主要原因是什么?
(2)10 g Na全部投入完毕所进行的次数可能是________(已知ρNa<ρH2O)。为什么?
A.5次 B.10次 C.大于10次
(3)小球上升的主要原因是什么?
(4)实验涉及的离子方程式为______________________。
(5)若将100 mL蒸馏水换成100 mL Fe2(SO4)3溶液,则小球是上升还是下降?为什么?写出反应的有关离子方程式。
二、钠的几种化合物
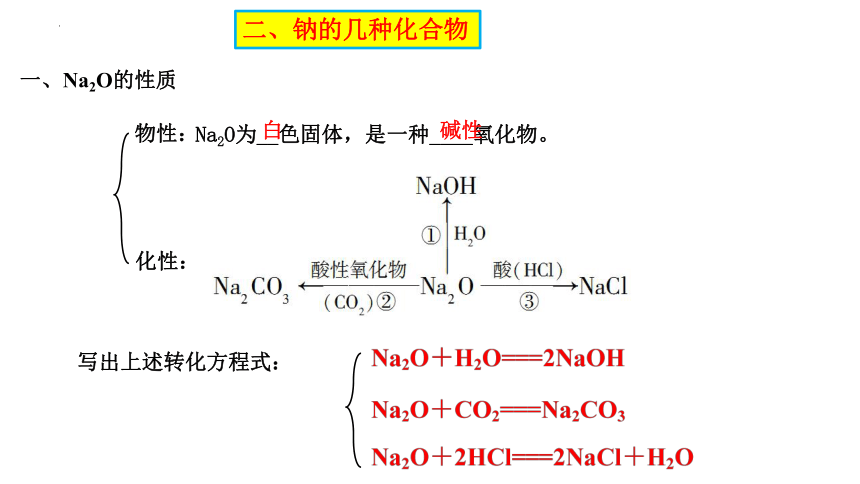
一、Na2O的性质
Na2O为__色固体,是一种____氧化物。
白
碱性
物性:
化性:
写出上述转化方程式:
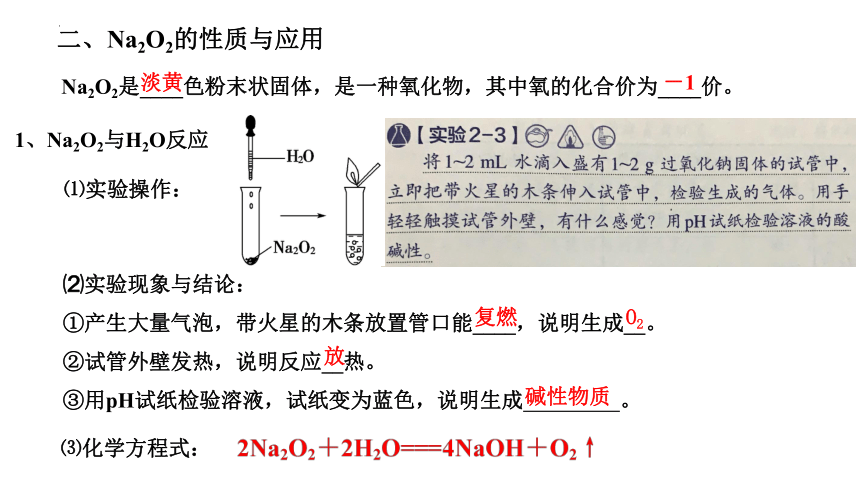
二、Na2O2的性质与应用
Na2O2是____色粉末状固体,是一种氧化物,其中氧的化合价为____价。
淡黄
-1
1、Na2O2与H2O反应
⑴实验操作:
⑵实验现象与结论:
①产生大量气泡,带火星的木条放置管口能____,说明生成__。
②试管外壁发热,说明反应__热。
③用pH试纸检验溶液,试纸变为蓝色,说明生成 。
复燃
O2
放
碱性物质
⑶化学方程式:
向盛有少量Na2O2的试管中加水,现象是 ,向反应后溶液中加2滴酚酞试液现象是 。
有气泡生成
先变红又褪色
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
由①×2+②得:
故Na2O2与水反应的溶液中加入酚酞溶液时,溶液先变红后褪色。
Na2O2与CO2反应的化学方程式为__________________________________,
2、Na2O2与CO2反应
2Na2O2+2CO2=2Na2CO3+O2
故Na2O2可在呼吸面具或潜水艇中作供氧剂。
⑵有的同学认为Na2O与Na2O2都是碱性氧化物,你同意这种观点吗?
⑶实验室中应该如何保存Na2O2?
应该密封保存。
⑷氧化钠能与氧气反应吗?
2Na2O+O2 == 2Na2O2
所以过氧化钠的热稳定性比氧化钠好。
⑴比较的异同点?
试一试
B
B
C
素材1 某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
问题探究:(1)该实验的反应原理是什么?写出化学方程式。
(2)脱脂棉剧烈燃烧的原因是什么?
(3)若向用脱脂棉包住一些Na2O2粉末中用导管吹气,脱脂棉也燃烧,涉及的反应原理是什么?写出化学方程式。
[答案] (1)2Na2O2+2H2O===4NaOH+O2↑
(2)反应放热和生成O2,使脱脂棉在O2中达到着火点而燃烧
(3)2Na2O2+2CO2===2Na2CO3+O2
素材2 球形干燥管A中为块状CaCO3,B中为淡黄色粉末,C中为固体CaCl2,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
问题探究:(1)写出A中反应的离子方程式。
(2)打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮的原因是什么?
(3)打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛熄灭的原因是什么?
⑷关闭活塞(Ⅰ)时,A中反应为什么会自行停止?
[答案] (1)CaCO3+2H+===Ca2++CO2↑+H2O
(2)A中产生的CO2与Na2O2反应生成了O2
(3)干燥CO2使蜡烛火焰熄灭
小苏打:NaHCO3
苏打:Na2CO3
怎么区别它们俩?
实验步骤 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数_____ 加水后_____溶解,温度计示数_____
③加5 mL水
④加1~2滴酚酞
白色粉末
结块变成晶体
升高
部分
降低
溶液变红,溶液碱性较强
溶液变浅红,溶液碱性较弱
细小的白色晶体
振荡一段时间后可溶解
固体量减少
1.Na2CO3和NaHCO3的溶解性、碱性
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g
思考:
1.厨房用纯碱去油污利用了纯碱的什么性质?
2.厨房用纯碱去油污而不用小苏打,为什么?
3.如果向碳酸钠饱和溶液中通入CO2,可能有什么现象?
Na2CO3 + CO2 + H2O = 2NaHCO3↓
实验操作 实验现象 实验结论
澄清石灰水 _________ _______________________________
澄清石灰水 _______ ______________________________;
化学方程式:___________________
_____________________
不变浑浊
Na2CO3很稳定,受热不易发生分解
变浑浊
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
2.Na2CO3和NaHCO3的热稳定性
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验
装置并分析实验原理,判断下列说法错
误的是
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末
的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
√
3.Na2CO3和NaHCO3与酸、碱的反应
Na2CO3 + HCl = NaHCO3 + NaCl
CO32- + H+ = HCO3-
NaHCO3 + HCl = NaCl + CO2↑+ H2O
HCO3- + H+ = CO2↑+ H2O
CO32- + 2H+ = CO2↑+ H2O
反应更剧烈
思考:
1.不使用其他试剂如何鉴别三瓶无色溶液分别是稀盐酸、碳酸钠溶液、碳酸氢钠溶液?
2. 小苏打可以治疗胃酸过多,但如果胃溃疡一般不使用小苏打,为什么?
NaHCO3+NaOH=Na2CO3+H2O
HCO3- + OH- = CO32- + H2O
试写出NaHCO3与Ba(OH)2反应的离子方程式
NaHCO3
Na2CO3
正盐
酸式盐
H+/CO2+H2O
OH-/△
碳酸钠与碳酸氢钠性质比较
归纳总结
碳酸钠 碳酸氢钠
俗名 苏打或纯碱 小苏打
颜色状态 白色粉末 细小的白色晶体
溶解性 更易溶于水 易溶于水
水溶液酸碱性 都呈碱性(Na2CO3溶液碱性更强)
与盐酸 放出二氧化碳气体 放出二氧化碳气体(剧烈)
与烧碱溶液 不反应 生成碳酸钠和水
与澄清石灰水 产生白色沉淀 产生白色沉淀
与氯化钙溶液 生成白色沉淀 不反应
热稳定性 稳定、受热不易分解 受热易分解
1.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排出气体,残留的物质应是
A.Na2O和Na2O2 B.Na2O2和Na2CO3
C.Na2CO3 D.Na2O
√
2.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为
A.2∶1 B.1∶1 C.1∶2 D.4∶1
√
3.把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。求原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
√
4.某化学课外小组欲制取纯净的Na2CO3溶液。三名同学设计的制备实验方案的反应流程分别如下:
请评价三个方案。
侯氏制碱法的原理:
(1)NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
(2)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
★在饱和食盐水中先通NH3,再通入足量CO2
4.焰色试验
很多金属或它们的化合物在灼烧时会使火焰呈现特殊的颜色,这在化学上叫焰色反应。
实验过程:
将铂丝(或光洁无锈的铁丝)用稀盐酸洗净
将洗净的铂丝在酒精灯(煤气灯)外焰上灼烧至与原火焰颜色相同。
用铂丝(或铁丝)蘸取待检验的溶液或粉末。
将沾有待测物的铂丝放在火焰上灼烧,并观察火焰的颜色。
再用稀盐酸洗净铂丝并在火焰上灼烧…
观察钾元素的焰色要透过蓝色的钴玻璃观察
黄绿色
黄 色
紫 色
砖红色
洋红色
绿 色
紫红色
金属的焰色反应
焰色反应是物理变化
(1)焰色试验的铂丝可用稀硫酸洗( )
(2)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(3)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+( )
(4)焰色试验是金属元素的化学性质( )
(5)灼烧时,所有金属或金属阳离子均有焰色( )
判断正误
×
√
×
×
×
第二章 海水中的重要元素
——钠和氯
第一节 钠及其化合物
1
一、钠的存在
钠元素在自然界中都以______ 的形式存在,如:
NaCl、Na2CO3、Na2SO4等。
化合物
二、物理性质
(如颜色、状态、气味、熔点、沸点、硬度、密度等等)
【演示实验2-1】
钠为银白色固体,密度为0.971g/cm3,比水的密度小;
熔沸点较低,分别为97.8和883 ℃,硬度小,用小刀可以切割。
三、钠的原子结构与化学性质
结构决定性质
请同学画出钠的原子结构示意图并预测钠可能有哪些化学性质?
钠具有很强的还原性!可以和很多氧化性物质反应,如氧气、水、高价态化合物等等。
请同学试着说下钠的物理性质?
CO2?
问:钠应保存在哪里?
石蜡油或煤油
4Na + 3CO2 =2Na2CO3 + C
一、活泼的金属单质----钠
1、钠与非金属单质反应
①与氧气反应③
反应条件 室温 加热
实验步骤
实验现象
化学方程式
结论
先加热坩埚,将钠块投入热坩埚中。钠先熔化成小球,然后剧烈燃烧,火焰呈____,生成____色固体
钠与O2反应时,条件不同,产物不同。
新切开的钠具有____色的金属光泽,在空气中很快____
银白
变暗
黄色
淡黄
②写出Na与Cl2、S在加热条件下反应的化学方程式。
浮
熔
游
响
红
2、钠与H2O反应实验探究
(1)根据氧化还原反应规律,预测Na与H2O反应的生成物为____________。
钠浮在水面上
钠的密度比水
熔成闪亮的小球
钠的熔点低且反应放热
钠在水面上迅速游动
反应产生气体推动钠游动
发出“嘶嘶” 声响
钠与水反应剧烈
溶液变红
反应生成碱性物质
(2)实验探究
(3)实验结论:
钠与水反应剧烈,生成__ _______,化学方程式是__ _____________________。
离子方程式为_______________________________,氧化剂为________。
NaOH和H2
2Na+2H2O===2NaOH+H2↑
2Na+2H2O===2Na++2OH-+H2↑
H2O
1、钠等活泼金属着火时如何灭火?为什么不用H2O灭火?
[提示] 需用干燥的沙土灭火。钠与H2O反应生成可燃性气体H2,易燃烧和爆炸。
2、钠与H2O反应比钠与盐酸反应更剧烈?
3、将一小块钠投入盛有饱和澄清石灰水的试管里,可看到什么现象?
4、将一块钠投入CuSO4溶液中,可看到什么现象?
写出Na与盐酸反应的离子方程式。
5、钠露置在空气中会发生怎样的变化?
(1)4Na+O2===2Na2O (2)Na2O+H2O===2NaOH
(3)2NaOH+CO2===Na2CO3+H2O (4)Na2CO3+10H2O===Na2CO3·10H2O
(5)Na2CO3·10H2O===Na2CO3+10H2O
请写出相关反应方程式:
3、钠与酸、碱、盐溶液的反应
⑴与酸溶液反应
⑵与碱溶液反应:
其实质是钠与水的反应
⑶与盐溶液反应:
注意:在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐。如在无水时,4Na+TiCl4 Ti+4NaCl。
高温熔融
D
如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定在水的中央),将10 g金属钠分多次投入水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。在投入钠的过程中小球上升。
问题探究:(1)10 g Na分多次投入的主要原因是什么?
(2)10 g Na全部投入完毕所进行的次数可能是________(已知ρNa<ρH2O)。为什么?
A.5次 B.10次 C.大于10次
(3)小球上升的主要原因是什么?
(4)实验涉及的离子方程式为______________________。
(5)若将100 mL蒸馏水换成100 mL Fe2(SO4)3溶液,则小球是上升还是下降?为什么?写出反应的有关离子方程式。
二、钠的几种化合物
一、Na2O的性质
Na2O为__色固体,是一种____氧化物。
白
碱性
物性:
化性:
写出上述转化方程式:
二、Na2O2的性质与应用
Na2O2是____色粉末状固体,是一种氧化物,其中氧的化合价为____价。
淡黄
-1
1、Na2O2与H2O反应
⑴实验操作:
⑵实验现象与结论:
①产生大量气泡,带火星的木条放置管口能____,说明生成__。
②试管外壁发热,说明反应__热。
③用pH试纸检验溶液,试纸变为蓝色,说明生成 。
复燃
O2
放
碱性物质
⑶化学方程式:
向盛有少量Na2O2的试管中加水,现象是 ,向反应后溶液中加2滴酚酞试液现象是 。
有气泡生成
先变红又褪色
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
由①×2+②得:
故Na2O2与水反应的溶液中加入酚酞溶液时,溶液先变红后褪色。
Na2O2与CO2反应的化学方程式为__________________________________,
2、Na2O2与CO2反应
2Na2O2+2CO2=2Na2CO3+O2
故Na2O2可在呼吸面具或潜水艇中作供氧剂。
⑵有的同学认为Na2O与Na2O2都是碱性氧化物,你同意这种观点吗?
⑶实验室中应该如何保存Na2O2?
应该密封保存。
⑷氧化钠能与氧气反应吗?
2Na2O+O2 == 2Na2O2
所以过氧化钠的热稳定性比氧化钠好。
⑴比较的异同点?
试一试
B
B
C
素材1 某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
问题探究:(1)该实验的反应原理是什么?写出化学方程式。
(2)脱脂棉剧烈燃烧的原因是什么?
(3)若向用脱脂棉包住一些Na2O2粉末中用导管吹气,脱脂棉也燃烧,涉及的反应原理是什么?写出化学方程式。
[答案] (1)2Na2O2+2H2O===4NaOH+O2↑
(2)反应放热和生成O2,使脱脂棉在O2中达到着火点而燃烧
(3)2Na2O2+2CO2===2Na2CO3+O2
素材2 球形干燥管A中为块状CaCO3,B中为淡黄色粉末,C中为固体CaCl2,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
问题探究:(1)写出A中反应的离子方程式。
(2)打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮的原因是什么?
(3)打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛熄灭的原因是什么?
⑷关闭活塞(Ⅰ)时,A中反应为什么会自行停止?
[答案] (1)CaCO3+2H+===Ca2++CO2↑+H2O
(2)A中产生的CO2与Na2O2反应生成了O2
(3)干燥CO2使蜡烛火焰熄灭
小苏打:NaHCO3
苏打:Na2CO3
怎么区别它们俩?
实验步骤 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数_____ 加水后_____溶解,温度计示数_____
③加5 mL水
④加1~2滴酚酞
白色粉末
结块变成晶体
升高
部分
降低
溶液变红,溶液碱性较强
溶液变浅红,溶液碱性较弱
细小的白色晶体
振荡一段时间后可溶解
固体量减少
1.Na2CO3和NaHCO3的溶解性、碱性
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g
思考:
1.厨房用纯碱去油污利用了纯碱的什么性质?
2.厨房用纯碱去油污而不用小苏打,为什么?
3.如果向碳酸钠饱和溶液中通入CO2,可能有什么现象?
Na2CO3 + CO2 + H2O = 2NaHCO3↓
实验操作 实验现象 实验结论
澄清石灰水 _________ _______________________________
澄清石灰水 _______ ______________________________;
化学方程式:___________________
_____________________
不变浑浊
Na2CO3很稳定,受热不易发生分解
变浑浊
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
2.Na2CO3和NaHCO3的热稳定性
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验
装置并分析实验原理,判断下列说法错
误的是
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末
的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
√
3.Na2CO3和NaHCO3与酸、碱的反应
Na2CO3 + HCl = NaHCO3 + NaCl
CO32- + H+ = HCO3-
NaHCO3 + HCl = NaCl + CO2↑+ H2O
HCO3- + H+ = CO2↑+ H2O
CO32- + 2H+ = CO2↑+ H2O
反应更剧烈
思考:
1.不使用其他试剂如何鉴别三瓶无色溶液分别是稀盐酸、碳酸钠溶液、碳酸氢钠溶液?
2. 小苏打可以治疗胃酸过多,但如果胃溃疡一般不使用小苏打,为什么?
NaHCO3+NaOH=Na2CO3+H2O
HCO3- + OH- = CO32- + H2O
试写出NaHCO3与Ba(OH)2反应的离子方程式
NaHCO3
Na2CO3
正盐
酸式盐
H+/CO2+H2O
OH-/△
碳酸钠与碳酸氢钠性质比较
归纳总结
碳酸钠 碳酸氢钠
俗名 苏打或纯碱 小苏打
颜色状态 白色粉末 细小的白色晶体
溶解性 更易溶于水 易溶于水
水溶液酸碱性 都呈碱性(Na2CO3溶液碱性更强)
与盐酸 放出二氧化碳气体 放出二氧化碳气体(剧烈)
与烧碱溶液 不反应 生成碳酸钠和水
与澄清石灰水 产生白色沉淀 产生白色沉淀
与氯化钙溶液 生成白色沉淀 不反应
热稳定性 稳定、受热不易分解 受热易分解
1.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排出气体,残留的物质应是
A.Na2O和Na2O2 B.Na2O2和Na2CO3
C.Na2CO3 D.Na2O
√
2.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为
A.2∶1 B.1∶1 C.1∶2 D.4∶1
√
3.把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。求原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
√
4.某化学课外小组欲制取纯净的Na2CO3溶液。三名同学设计的制备实验方案的反应流程分别如下:
请评价三个方案。
侯氏制碱法的原理:
(1)NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
(2)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
★在饱和食盐水中先通NH3,再通入足量CO2
4.焰色试验
很多金属或它们的化合物在灼烧时会使火焰呈现特殊的颜色,这在化学上叫焰色反应。
实验过程:
将铂丝(或光洁无锈的铁丝)用稀盐酸洗净
将洗净的铂丝在酒精灯(煤气灯)外焰上灼烧至与原火焰颜色相同。
用铂丝(或铁丝)蘸取待检验的溶液或粉末。
将沾有待测物的铂丝放在火焰上灼烧,并观察火焰的颜色。
再用稀盐酸洗净铂丝并在火焰上灼烧…
观察钾元素的焰色要透过蓝色的钴玻璃观察
黄绿色
黄 色
紫 色
砖红色
洋红色
绿 色
紫红色
金属的焰色反应
焰色反应是物理变化
(1)焰色试验的铂丝可用稀硫酸洗( )
(2)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(3)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+( )
(4)焰色试验是金属元素的化学性质( )
(5)灼烧时,所有金属或金属阳离子均有焰色( )
判断正误
×
√
×
×
×
