4.3.1 离子键 共价键 课件(共23张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.1 离子键 共价键 课件(共23张PPT)2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 16:09:53 | ||
图片预览







文档简介
(共23张PPT)
第四章 物质结构 元素周期律
第三节 化学键
从元素周期表可以看出,到目前为止,已经发现元素有一百多种。然而,由这一百多种元素的原子构成的物质已经超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
化学键
使离子相结合或原子相结合的相互作用力。
定义:相邻的原子之间强烈的相互作用。
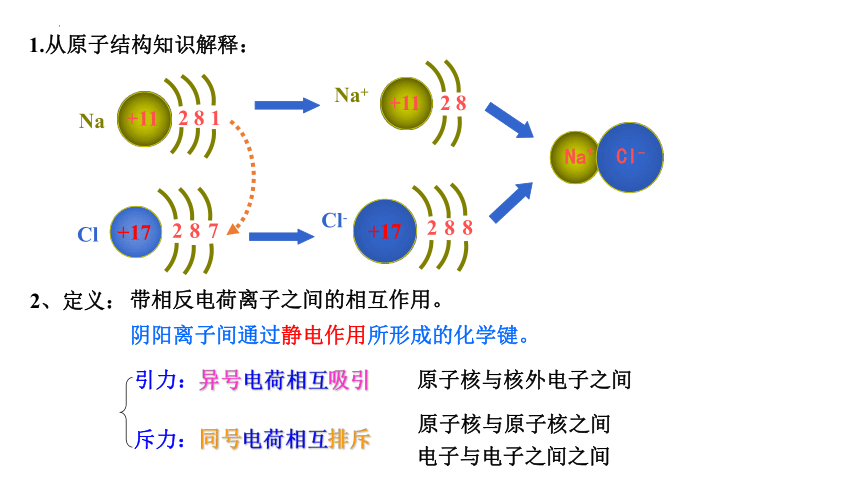
一、离子键
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
1.从原子结构知识解释:
2、定义:
带相反电荷离子之间的相互作用。
阴阳离子间通过静电作用所形成的化学键。
引力:异号电荷相互吸引
原子核与核外电子之间
斥力:同号电荷相互排斥
原子核与原子核之间
电子与电子之间之间
3、成键要素:
成键微粒:
成键本质:
成键元素:
阴阳离子
静电作用
一般是活泼金属元素和活泼非金属元素
( ⅠA,ⅡA )
( ⅥA,ⅦA )
常见阳离子 ⅠA
ⅡA
原子团
常见阴离子 ⅥA
ⅦA
原子团
Li+、Na+、K+、Rb+、Cs+
Be2+、Mg2+、Ca2+、Sr2+、Ba2+
NH4+
O2- 、S2-、Se2-
F-、Cl-、Br-、I-
OH-、NO3-、SO42-(酸根)
思考:如何判断物质中存在离子键呢?
①活泼的金属元素和活泼的非金属元素 之间的化合物。如:Na2O、NaH
活泼的金属元素和酸根离子形成的盐。如:NaNO3
铵根和酸根离子(或活泼非金属元素)形成的盐。 如:NH4Cl , (NH4)2SO4
活泼的金属阳离子与OH-。如 NaOH
②明显带离子的物质
看有没有离子?
看有没有活泼金属离子或铵根离子?
2、离子化合物常见物质类别:
强碱
大部分盐
活泼金属氧化物
3、离子化合物的特征:
①具有较高的熔点和沸点,难挥发,常温下都是固体;
②离子化合物硬而脆;
③离子化合物固体不导电,熔化或溶于水后能导电。
二、离子化合物
1、定义:
由离子键构成的化合物。
【练习】
判断下列物质属于离子化合物的有:
① MgCl2 ②Na2SO4 ③K2CO3 ④HCl ⑤NH4NO3 ⑥CO2 ⑦NH3 ⑧CCl4 ⑨ Ca(OH)2 ⑩ Na2O2
4、注意点:离子键的三个“一定”和一个“不一定”
①离子化合物中一定含有离子键。
②含有离子键的物质一定是离子化合物。
③离子化合物中一定含有阴离子和阳离子。
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
②含有金属元素的化合物也不一定是离子化合物,如AlCl3。
(2)二个“不一定”
(1)三个“一定”
1、下列化合物中有离子键的是 ( )
(1)KI (2)HBr (3)Na2SO4 (4)NH4Cl (5)H2CO3
(1)(3)(4)
2、具有下列最外层电子数的原子,最难形成离子的是( )
A、L层6个 B、L层4个 C、M层2个 D、M层7个
3、不能形成离子键的是( )
A、钠和氟 B、镁和溴 C、钙和氧 D、氯和氧
4、下列各组原子序数所表示的A、B两种元素,能形成AB2型
含离子的化合物的是( )
A、6和8 B、11和13 C、11和16 D、12和17
5、下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A、可溶于水 B、具有较高的熔点
C、水溶液能导电 D、熔融状态能导电
B
D
D
D
练习:
原子性质
决定
最外层电子数
三、电子式
定义:在元素符号周围用“ ” 或 “ x ”来表示原子最外层电子的式子。
原子:
H
O
Cl
Mg
Na
离子:
Mg
2
Cl
O
2-
Na
H
规则:一般先占据尽可能多的位置
用电子式表示离子化合物K2S、MgBr2的形成过程:
S
K
K
S
2-
K
K
Br
Mg
Br
Mg
2
Br
Br
练习:用电子式表示:
1.氧原子 2.碳原子
3.钙离子 4.硫离子
5.氢化钠 6.氧化镁
7.溴化钙 8.氮化镁
活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
H
Cl
均不容易失去e-
+17
+1
+1
+17
H2 + Cl2 ==== 2HCl
点燃或光照
形成共用电子对,双方都达到稳定结构——共赢
+1 -1
偏离
偏向
四、共价键
共用电子对
氢分子的形成:
H ·
氯化氢分子的形成:
··
··
· Cl
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
极性共价键
非极性共价键
1、定义:
原子间通过共用电子对所形成的相互作用。
2、成键要素:
成键微粒:
成键本质:
成键元素:
原子
共用电子对
一般非金属元素之间
3、分类:
极性共价键(极性键):
非极性共价键(非极性键):
共用电子对有偏移的共价键。
共用电子对没有偏移的共价键。
思考:哪些物质中存在共价键?
非金属单质的多原子分子、某些离子化合物以及共价化合物。
2、共价化合物常见物质类别:
3、注意点:
五、共价化合物
1、定义:
以共用电子对形成的化合物。
非金属氧化物
非金属氢化物
酸
绝大部分有机物
只含有共价键的化合物才属于共价化合物(即若存在离子键,一定为离子化合物)
特殊:AlCl3、BeCl2
问题:只有非金属间才能形成共价化合物吗?
含有共价键的化合物一定是共价化合物
全部由非金属元素组成的化合物一定是共价化合物
在气态单质分子里一定有共价键
金属和非金属组成的化合物一定是离子化合物
错,如 NH4Cl 等铵盐
错,如:NaOH Na2SO4
错,He、Ne等稀有气体
判断:
错,如AlCl3、BeCl2
如何用电子式表示共价分子
1 、H2、O2、N2 、HCl
2、H2O、CO2 、H2S 、CS2
3、NH3 、CH4、CCl4 、 N2H4
4、C2H6(乙烷) C2H4(乙烯) C2H2(乙炔)
5、H2O2 HClO BF3 PCl5
五、结构式
1、定义:
2、注意点:
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如氯化氢可表示为 ,二氧化碳可表示为 。
H—Cl
O=C=O
只适用于共价键形成的物质。
试写出硫化氢、氨气、双氧水分子的结构式?
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
共价键
共价键
离子键
离子化合物
离子化合物
H2O HClO
KOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
1. 关于化学键的下列叙述中,正确的是 ( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
2. 下列物质中,含有共价键的化合物是 ( )
A.碘化氢 B.烧碱
C.液溴 D.食盐
AD
AB
【课堂练习】
3、下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.Na2O2
AD
成键原因 成键粒子 键的本质 成键过程 成键元素
离子键
共价键
电子得失
共用电子对
离子
原子
离子间的静电作用
原子间的静电作用
阴、阳离子接近到一定距离时,吸引和排斥力达到平衡就形成了离子键。
原子间通过共用电子对的方法使双方最外电子层均达到稳定结构。
典型的金属元素和典型的非金属元素
同种或不同种非金属元素
离子键和共价键的比较
非极性键
极性键
思考:
离子化合物与共价化合物有何区别?(以NaCl和HCl为例。)
1、构成微粒不同。离子化合物为离子,共价化合物为分子。
2、形成过程不同。离子化合物是通过电子得失,共价化合物是形成共用电子对。
3、所含化学键类型不同。离子化合物必含离子键,可能含有共价键,共价化合物不含离子键,只含共价键。
4、电离与导电的情况不同。离子化合物在熔融状态或水溶液中都能电离导电,共价化合物中的电解质只有在水溶液中才能电离导电。
六、化学键与化学反应的实质
1、化学键
定义:
分类:
离子键
共价键
非极性键
极性键
2、化学反应的实质:
化学反应的实质是旧化学键的断裂和新化学键的形成。
相邻的原子之间强烈的相互作用。
静电作用
静电引力
静电斥力
3、注意:
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。
②物质中不一定都存在化学键,如He等稀有气体分子。
③非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
第四章 物质结构 元素周期律
第三节 化学键
从元素周期表可以看出,到目前为止,已经发现元素有一百多种。然而,由这一百多种元素的原子构成的物质已经超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
化学键
使离子相结合或原子相结合的相互作用力。
定义:相邻的原子之间强烈的相互作用。
一、离子键
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
1.从原子结构知识解释:
2、定义:
带相反电荷离子之间的相互作用。
阴阳离子间通过静电作用所形成的化学键。
引力:异号电荷相互吸引
原子核与核外电子之间
斥力:同号电荷相互排斥
原子核与原子核之间
电子与电子之间之间
3、成键要素:
成键微粒:
成键本质:
成键元素:
阴阳离子
静电作用
一般是活泼金属元素和活泼非金属元素
( ⅠA,ⅡA )
( ⅥA,ⅦA )
常见阳离子 ⅠA
ⅡA
原子团
常见阴离子 ⅥA
ⅦA
原子团
Li+、Na+、K+、Rb+、Cs+
Be2+、Mg2+、Ca2+、Sr2+、Ba2+
NH4+
O2- 、S2-、Se2-
F-、Cl-、Br-、I-
OH-、NO3-、SO42-(酸根)
思考:如何判断物质中存在离子键呢?
①活泼的金属元素和活泼的非金属元素 之间的化合物。如:Na2O、NaH
活泼的金属元素和酸根离子形成的盐。如:NaNO3
铵根和酸根离子(或活泼非金属元素)形成的盐。 如:NH4Cl , (NH4)2SO4
活泼的金属阳离子与OH-。如 NaOH
②明显带离子的物质
看有没有离子?
看有没有活泼金属离子或铵根离子?
2、离子化合物常见物质类别:
强碱
大部分盐
活泼金属氧化物
3、离子化合物的特征:
①具有较高的熔点和沸点,难挥发,常温下都是固体;
②离子化合物硬而脆;
③离子化合物固体不导电,熔化或溶于水后能导电。
二、离子化合物
1、定义:
由离子键构成的化合物。
【练习】
判断下列物质属于离子化合物的有:
① MgCl2 ②Na2SO4 ③K2CO3 ④HCl ⑤NH4NO3 ⑥CO2 ⑦NH3 ⑧CCl4 ⑨ Ca(OH)2 ⑩ Na2O2
4、注意点:离子键的三个“一定”和一个“不一定”
①离子化合物中一定含有离子键。
②含有离子键的物质一定是离子化合物。
③离子化合物中一定含有阴离子和阳离子。
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
②含有金属元素的化合物也不一定是离子化合物,如AlCl3。
(2)二个“不一定”
(1)三个“一定”
1、下列化合物中有离子键的是 ( )
(1)KI (2)HBr (3)Na2SO4 (4)NH4Cl (5)H2CO3
(1)(3)(4)
2、具有下列最外层电子数的原子,最难形成离子的是( )
A、L层6个 B、L层4个 C、M层2个 D、M层7个
3、不能形成离子键的是( )
A、钠和氟 B、镁和溴 C、钙和氧 D、氯和氧
4、下列各组原子序数所表示的A、B两种元素,能形成AB2型
含离子的化合物的是( )
A、6和8 B、11和13 C、11和16 D、12和17
5、下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A、可溶于水 B、具有较高的熔点
C、水溶液能导电 D、熔融状态能导电
B
D
D
D
练习:
原子性质
决定
最外层电子数
三、电子式
定义:在元素符号周围用“ ” 或 “ x ”来表示原子最外层电子的式子。
原子:
H
O
Cl
Mg
Na
离子:
Mg
2
Cl
O
2-
Na
H
规则:一般先占据尽可能多的位置
用电子式表示离子化合物K2S、MgBr2的形成过程:
S
K
K
S
2-
K
K
Br
Mg
Br
Mg
2
Br
Br
练习:用电子式表示:
1.氧原子 2.碳原子
3.钙离子 4.硫离子
5.氢化钠 6.氧化镁
7.溴化钙 8.氮化镁
活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
H
Cl
均不容易失去e-
+17
+1
+1
+17
H2 + Cl2 ==== 2HCl
点燃或光照
形成共用电子对,双方都达到稳定结构——共赢
+1 -1
偏离
偏向
四、共价键
共用电子对
氢分子的形成:
H ·
氯化氢分子的形成:
··
··
· Cl
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
极性共价键
非极性共价键
1、定义:
原子间通过共用电子对所形成的相互作用。
2、成键要素:
成键微粒:
成键本质:
成键元素:
原子
共用电子对
一般非金属元素之间
3、分类:
极性共价键(极性键):
非极性共价键(非极性键):
共用电子对有偏移的共价键。
共用电子对没有偏移的共价键。
思考:哪些物质中存在共价键?
非金属单质的多原子分子、某些离子化合物以及共价化合物。
2、共价化合物常见物质类别:
3、注意点:
五、共价化合物
1、定义:
以共用电子对形成的化合物。
非金属氧化物
非金属氢化物
酸
绝大部分有机物
只含有共价键的化合物才属于共价化合物(即若存在离子键,一定为离子化合物)
特殊:AlCl3、BeCl2
问题:只有非金属间才能形成共价化合物吗?
含有共价键的化合物一定是共价化合物
全部由非金属元素组成的化合物一定是共价化合物
在气态单质分子里一定有共价键
金属和非金属组成的化合物一定是离子化合物
错,如 NH4Cl 等铵盐
错,如:NaOH Na2SO4
错,He、Ne等稀有气体
判断:
错,如AlCl3、BeCl2
如何用电子式表示共价分子
1 、H2、O2、N2 、HCl
2、H2O、CO2 、H2S 、CS2
3、NH3 、CH4、CCl4 、 N2H4
4、C2H6(乙烷) C2H4(乙烯) C2H2(乙炔)
5、H2O2 HClO BF3 PCl5
五、结构式
1、定义:
2、注意点:
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如氯化氢可表示为 ,二氧化碳可表示为 。
H—Cl
O=C=O
只适用于共价键形成的物质。
试写出硫化氢、氨气、双氧水分子的结构式?
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
共价键
共价键
离子键
离子化合物
离子化合物
H2O HClO
KOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
1. 关于化学键的下列叙述中,正确的是 ( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
2. 下列物质中,含有共价键的化合物是 ( )
A.碘化氢 B.烧碱
C.液溴 D.食盐
AD
AB
【课堂练习】
3、下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.Na2O2
AD
成键原因 成键粒子 键的本质 成键过程 成键元素
离子键
共价键
电子得失
共用电子对
离子
原子
离子间的静电作用
原子间的静电作用
阴、阳离子接近到一定距离时,吸引和排斥力达到平衡就形成了离子键。
原子间通过共用电子对的方法使双方最外电子层均达到稳定结构。
典型的金属元素和典型的非金属元素
同种或不同种非金属元素
离子键和共价键的比较
非极性键
极性键
思考:
离子化合物与共价化合物有何区别?(以NaCl和HCl为例。)
1、构成微粒不同。离子化合物为离子,共价化合物为分子。
2、形成过程不同。离子化合物是通过电子得失,共价化合物是形成共用电子对。
3、所含化学键类型不同。离子化合物必含离子键,可能含有共价键,共价化合物不含离子键,只含共价键。
4、电离与导电的情况不同。离子化合物在熔融状态或水溶液中都能电离导电,共价化合物中的电解质只有在水溶液中才能电离导电。
六、化学键与化学反应的实质
1、化学键
定义:
分类:
离子键
共价键
非极性键
极性键
2、化学反应的实质:
化学反应的实质是旧化学键的断裂和新化学键的形成。
相邻的原子之间强烈的相互作用。
静电作用
静电引力
静电斥力
3、注意:
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。
②物质中不一定都存在化学键,如He等稀有气体分子。
③非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
