广东省汕头市育能实高2022-2023学年高一下学期期中考试化学试题(含手写答案)
文档属性
| 名称 | 广东省汕头市育能实高2022-2023学年高一下学期期中考试化学试题(含手写答案) | 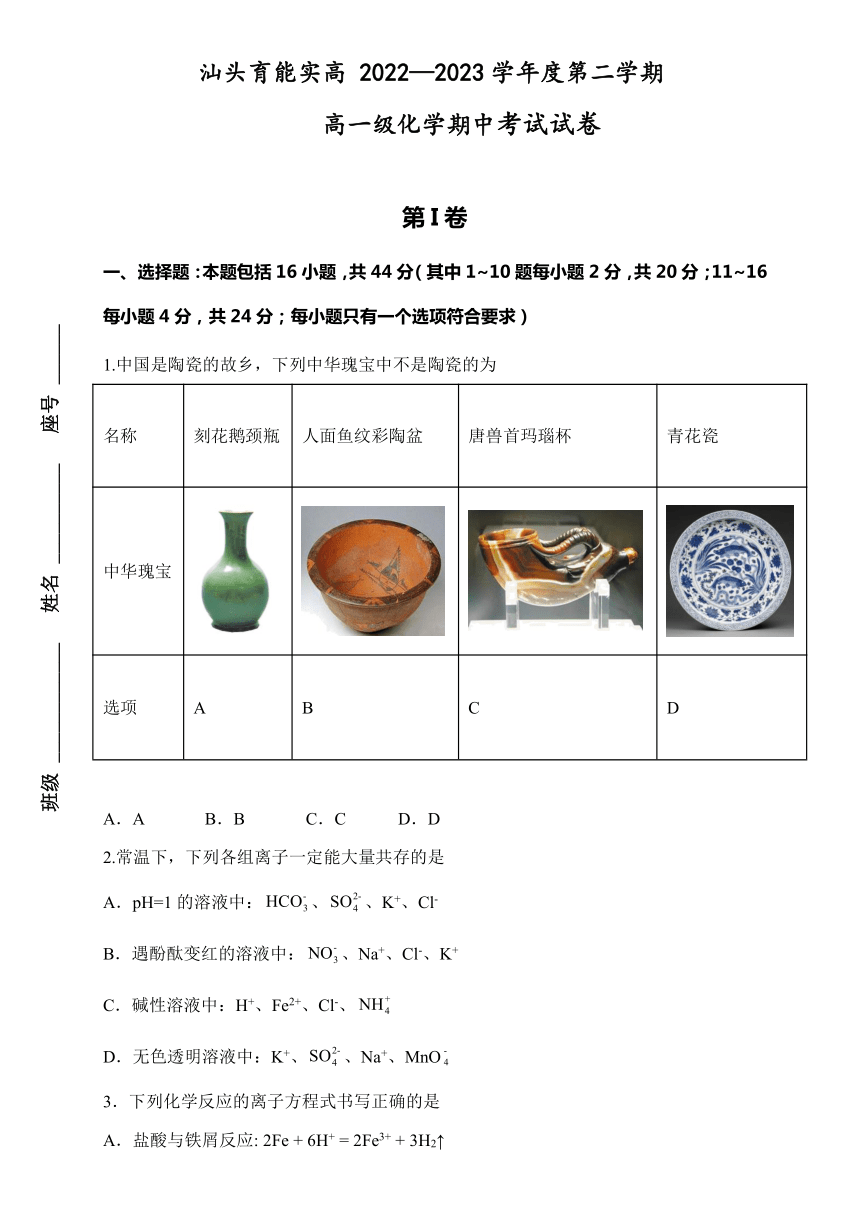 | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 17:34:23 | ||
图片预览




文档简介
第I卷
选择题:本题包括16小题,共44分(其中1~10题每小题2分,共20分;11~16每小题4分,共24分;每小题只有一个选项符合要求)
1.中国是陶瓷的故乡,下列中华瑰宝中不是陶瓷的为
名称 刻花鹅颈瓶 人面鱼纹彩陶盆 唐兽首玛瑙杯 青花瓷
中华瑰宝
选项 A B C D
A B.B C.C D.D
2.常温下,下列各组离子一定能大量共存的是
A.pH=1的溶液中:、、K+、Cl-
B.遇酚酞变红的溶液中:、Na+、Cl-、K+
C.碱性溶液中:H+、Fe2+、Cl-、
D.无色透明溶液中:K+、、Na+、MnO
3.下列化学反应的离子方程式书写正确的是
A.盐酸与铁屑反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
B.金属铜投入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.氢氧化铜固体投入稀硝酸: Cu(OH)2 + 2H+ = Cu2+ + 2H2O
D.大理石与盐酸反应: CO+ 2H+ = CO2↑+ H2O
4.下列有关SO2的说法不正确的是
A.SO2和CO2均能和澄清石灰水反应,现象相同
B.将SO2气体通入溴水中,溶液褪色说明SO2具有漂白性
C.SO2具有漂白性,但遇石蕊溶液却不能将之漂白
D.SO2和Cl2均能使品红溶液褪色
5.关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是
A.CO是氧化产物 B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4 D.还原性:SiH4>CO
6.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.在常温常压下,1.7gNH3含有的原子数为0.4NA
B.标准状况下,NA个H2O分子的体积约为22.4L
C.0.2mol/LNa2SO4溶液中,Na+的数目为0.4NA
D.50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
7.氮化镁(Mg3N2)是一种应用范围非常广泛的无机化合物,它可与水发生反应,其反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,下列化学用语的表示错误的是
A.Mg3N2中氮的化合价为:-3 B.中子数为10的氧的核素为:O
C.H2O的电子式为: D.NH3的结构式为:
8.对反应来说,下列反应速率最大的是
A. B.
C. D.
9.在密闭容器中发生反应C+CO2=2CO可使反应速率增大的是
(1)增大压强(2)升高温度(3)增加碳的量(4)减小压强
A.(1)(2)(3)(4) B.(2)(3)(4) C.(1)(2) D.(3)(4)
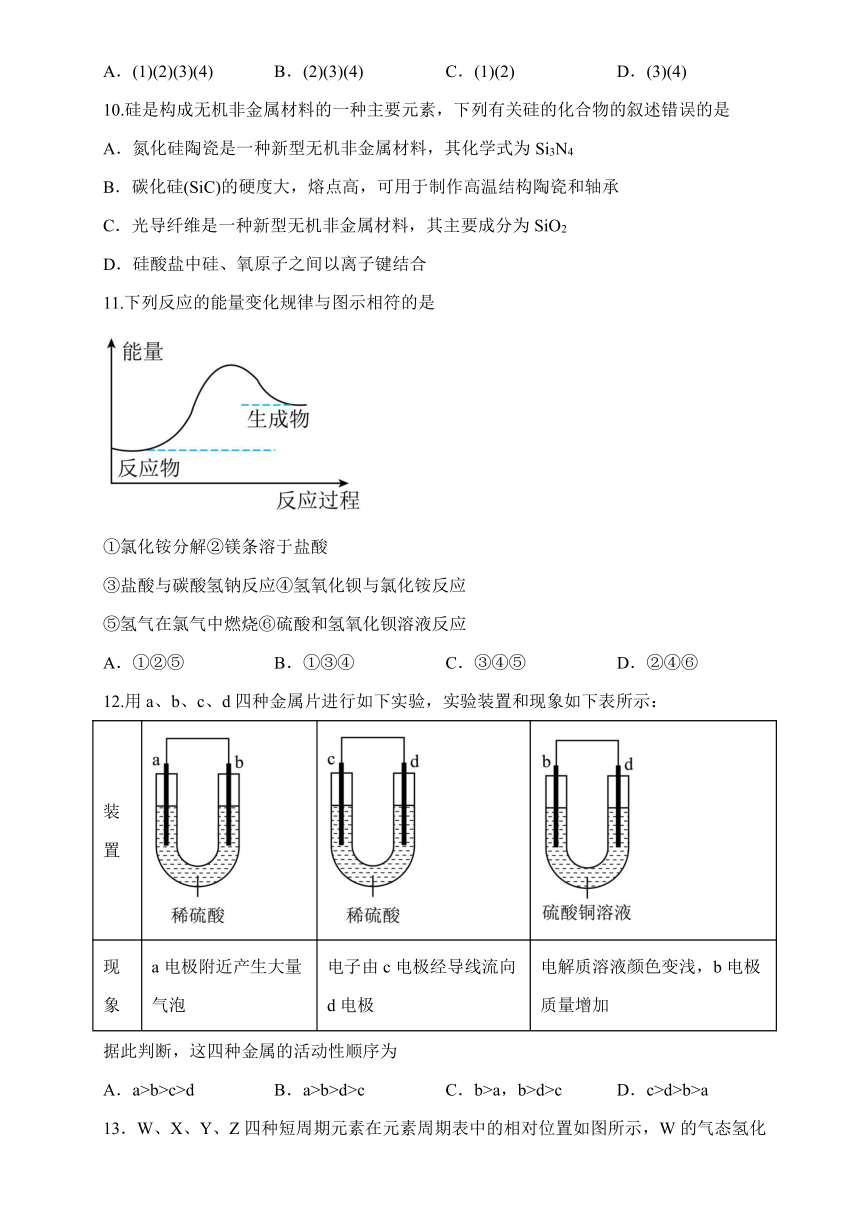
10.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2
D.硅酸盐中硅、氧原子之间以离子键结合
11.下列反应的能量变化规律与图示相符的是
①氯化铵分解②镁条溶于盐酸
③盐酸与碳酸氢钠反应④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①③④ C.③④⑤ D.②④⑥
12.用a、b、c、d四种金属片进行如下实验,实验装置和现象如下表所示:
装置
现象 a电极附近产生大量气泡 电子由c电极经导线流向d电极 电解质溶液颜色变浅,b电极质量增加
据此判断,这四种金属的活动性顺序为
A.a>b>c>d B.a>b>d>c C.b>a,b>d>c D.c>d>b>a
13.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水,水溶液呈碱性。下列说法正确的是
W X
Y Z
A.X、Y、Z的简单氢化物稳定性最强的是Y
B.W的氧化物对应的水化物都是强酸
C.X的简单阴离子的还原性强于Y的简单阴离子
D.Z的单质在化学反应中既可表现氧化性也可表现还原性
14.一定条件下,白磷转化为红磷的能量关系如图所示。在该条件下,下列说法正确的是
A.白磷比红磷稳定 B.红磷转化为白磷是吸热反应
C.红磷与白磷互为同位素 D.等质量的红磷与白磷完全燃烧释放的热量相同
15.表格中的实验操作、实验现象和结论均正确且相符的是
选项 实验操作 实验现象 结论
A 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸只体现脱水性
B 向某溶液中滴加BaCl2溶液 产生白色沉淀 溶液中含有
C 将浓硫酸和铜加热,冷却后将混合液加入水中稀释 产生刺激性气味气体,溶液呈蓝色 浓硫酸既表现氧化性,又表现酸性
D 将足量锌和浓硫酸共热,将气体通入品红溶液 产生刺激性气味气体,品红溶液褪色 产生的气体只有SO2
16.下列有关实验的说法正确的是
A.可利用甲装置制取得到干燥的NH3 B.可利用乙装置制取SO2
C.可利用丙装置除去Cl2中的HCl、H2O D.可利用丁装置收集满一瓶NO2
第II卷
二、非选择题:本题包括4小题,共56分。
17.下表显示了元素周期表中短周期的一部分,①-⑤代表两种短周期元素
N
① ② ③ P ④ ⑤
(1)N在元素周期表中的位置是___________。
(2)写出N的氢化物的电子式 ___________。
(3)写出实验室制NH3的方程式___________。。
(5)写出②的单质与热水反应的化学方程式:___________。
(6)写出③的单质与氢氧化钠溶液反应的离子方程式:___________。
(7)稳定性:PH3___________NH3(填“<”或“>”),从原子结构解释原因___________。
18.(14分)某同学为了验证木炭和浓硫酸反应的产物,设计了如图所示的实验装置。
回答下列问题:
(1)A装置中发生反应的化学方程式为_____。
(2)B装置的作用是_____,现象是_____。
(3)C装置的作用是_____,现象是_____。
(4)D装置的作用是_____。
(5)E装置的作用是_____。
(6)F装置的作用是_____,反应的离子方程式是_____。
(7)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
①甲装置中发生的主要反应的化学方程式是_____。
②浸有碱液的棉花的作用_____。
19.(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从_______口通入(填“A”或“B”);
②a极的电极反应为:_______。
(2) A、B、C、D四种金属按下表中装置进行实验。
装置
现象 金属A不断溶解 C的质量增加 A上有气体产生
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向_______ (填“A”或“B”)极。
②装置乙中正极的电极反应式为_______。
③四种金属活动性由强到弱的顺序是_______。
锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_______;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______
20.(12分)已知反应:。某温度时,在容积恒定为2.0L的密闭容器中充入2.0mol 和2.0mol ,一段时间后反应达平衡状态,实验数据如表所示:
t/s 0 50 150 250 350
0 0.24 0.36 0.40 0.40
(1)0~50s内的平均反应速率_______。
(2)250s时,容器中的物质的量是_______,的转化率是_______。
(3)为加快该反应速率,可以采取的措施是_______。
a.降低温度 b.使用催化剂 c.恒容时充入He气 d.恒压时充入He气
(4)已知:断开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要吸收能量为436 kJ、391 kJ、946 kJ,则生成1mol 过程中_______(填“吸收”或“放出”)的能量为_______试卷第1页,共3页
选择题:本题包括16小题,共44分(其中1~10题每小题2分,共20分;11~16每小题4分,共24分;每小题只有一个选项符合要求)
1.中国是陶瓷的故乡,下列中华瑰宝中不是陶瓷的为
名称 刻花鹅颈瓶 人面鱼纹彩陶盆 唐兽首玛瑙杯 青花瓷
中华瑰宝
选项 A B C D
A B.B C.C D.D
2.常温下,下列各组离子一定能大量共存的是
A.pH=1的溶液中:、、K+、Cl-
B.遇酚酞变红的溶液中:、Na+、Cl-、K+
C.碱性溶液中:H+、Fe2+、Cl-、
D.无色透明溶液中:K+、、Na+、MnO
3.下列化学反应的离子方程式书写正确的是
A.盐酸与铁屑反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
B.金属铜投入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.氢氧化铜固体投入稀硝酸: Cu(OH)2 + 2H+ = Cu2+ + 2H2O
D.大理石与盐酸反应: CO+ 2H+ = CO2↑+ H2O
4.下列有关SO2的说法不正确的是
A.SO2和CO2均能和澄清石灰水反应,现象相同
B.将SO2气体通入溴水中,溶液褪色说明SO2具有漂白性
C.SO2具有漂白性,但遇石蕊溶液却不能将之漂白
D.SO2和Cl2均能使品红溶液褪色
5.关于反应4CO2+SiH44CO+SiO2+2H2O,下列说法正确的是
A.CO是氧化产物 B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4 D.还原性:SiH4>CO
6.设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.在常温常压下,1.7gNH3含有的原子数为0.4NA
B.标准状况下,NA个H2O分子的体积约为22.4L
C.0.2mol/LNa2SO4溶液中,Na+的数目为0.4NA
D.50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
7.氮化镁(Mg3N2)是一种应用范围非常广泛的无机化合物,它可与水发生反应,其反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,下列化学用语的表示错误的是
A.Mg3N2中氮的化合价为:-3 B.中子数为10的氧的核素为:O
C.H2O的电子式为: D.NH3的结构式为:
8.对反应来说,下列反应速率最大的是
A. B.
C. D.
9.在密闭容器中发生反应C+CO2=2CO可使反应速率增大的是
(1)增大压强(2)升高温度(3)增加碳的量(4)减小压强
A.(1)(2)(3)(4) B.(2)(3)(4) C.(1)(2) D.(3)(4)
10.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2
D.硅酸盐中硅、氧原子之间以离子键结合
11.下列反应的能量变化规律与图示相符的是
①氯化铵分解②镁条溶于盐酸
③盐酸与碳酸氢钠反应④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①③④ C.③④⑤ D.②④⑥
12.用a、b、c、d四种金属片进行如下实验,实验装置和现象如下表所示:
装置
现象 a电极附近产生大量气泡 电子由c电极经导线流向d电极 电解质溶液颜色变浅,b电极质量增加
据此判断,这四种金属的活动性顺序为
A.a>b>c>d B.a>b>d>c C.b>a,b>d>c D.c>d>b>a
13.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水,水溶液呈碱性。下列说法正确的是
W X
Y Z
A.X、Y、Z的简单氢化物稳定性最强的是Y
B.W的氧化物对应的水化物都是强酸
C.X的简单阴离子的还原性强于Y的简单阴离子
D.Z的单质在化学反应中既可表现氧化性也可表现还原性
14.一定条件下,白磷转化为红磷的能量关系如图所示。在该条件下,下列说法正确的是
A.白磷比红磷稳定 B.红磷转化为白磷是吸热反应
C.红磷与白磷互为同位素 D.等质量的红磷与白磷完全燃烧释放的热量相同
15.表格中的实验操作、实验现象和结论均正确且相符的是
选项 实验操作 实验现象 结论
A 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸只体现脱水性
B 向某溶液中滴加BaCl2溶液 产生白色沉淀 溶液中含有
C 将浓硫酸和铜加热,冷却后将混合液加入水中稀释 产生刺激性气味气体,溶液呈蓝色 浓硫酸既表现氧化性,又表现酸性
D 将足量锌和浓硫酸共热,将气体通入品红溶液 产生刺激性气味气体,品红溶液褪色 产生的气体只有SO2
16.下列有关实验的说法正确的是
A.可利用甲装置制取得到干燥的NH3 B.可利用乙装置制取SO2
C.可利用丙装置除去Cl2中的HCl、H2O D.可利用丁装置收集满一瓶NO2
第II卷
二、非选择题:本题包括4小题,共56分。
17.下表显示了元素周期表中短周期的一部分,①-⑤代表两种短周期元素
N
① ② ③ P ④ ⑤
(1)N在元素周期表中的位置是___________。
(2)写出N的氢化物的电子式 ___________。
(3)写出实验室制NH3的方程式___________。。
(5)写出②的单质与热水反应的化学方程式:___________。
(6)写出③的单质与氢氧化钠溶液反应的离子方程式:___________。
(7)稳定性:PH3___________NH3(填“<”或“>”),从原子结构解释原因___________。
18.(14分)某同学为了验证木炭和浓硫酸反应的产物,设计了如图所示的实验装置。
回答下列问题:
(1)A装置中发生反应的化学方程式为_____。
(2)B装置的作用是_____,现象是_____。
(3)C装置的作用是_____,现象是_____。
(4)D装置的作用是_____。
(5)E装置的作用是_____。
(6)F装置的作用是_____,反应的离子方程式是_____。
(7)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
①甲装置中发生的主要反应的化学方程式是_____。
②浸有碱液的棉花的作用_____。
19.(1)燃料电池是一种高效、环境友好的供电装置,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从_______口通入(填“A”或“B”);
②a极的电极反应为:_______。
(2) A、B、C、D四种金属按下表中装置进行实验。
装置
现象 金属A不断溶解 C的质量增加 A上有气体产生
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向_______ (填“A”或“B”)极。
②装置乙中正极的电极反应式为_______。
③四种金属活动性由强到弱的顺序是_______。
锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_______;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______
20.(12分)已知反应:。某温度时,在容积恒定为2.0L的密闭容器中充入2.0mol 和2.0mol ,一段时间后反应达平衡状态,实验数据如表所示:
t/s 0 50 150 250 350
0 0.24 0.36 0.40 0.40
(1)0~50s内的平均反应速率_______。
(2)250s时,容器中的物质的量是_______,的转化率是_______。
(3)为加快该反应速率,可以采取的措施是_______。
a.降低温度 b.使用催化剂 c.恒容时充入He气 d.恒压时充入He气
(4)已知:断开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要吸收能量为436 kJ、391 kJ、946 kJ,则生成1mol 过程中_______(填“吸收”或“放出”)的能量为_______试卷第1页,共3页
同课章节目录
