河南省驻马店高级中学2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 河南省驻马店高级中学2022-2023学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 945.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 17:58:05 | ||
图片预览




文档简介
驻马店高级中学2022-2023学年高二下学期期中考试
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Ca 40 Cu 64
第Ⅰ卷
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.中国首次在月球上发现新矿物并命名为“嫦娥石”,其晶体组成为。Y是一种稀土元素,常以形式存在。下列说法不正确的是( )
A.Y属于金属元素 B.属于s区元素
C.嫦娥石中的化合价为 D.可利用X射线衍射法获取其晶体结构
2.我国科研团队在人工合成淀粉方面取得突破性进展,通过制得,进而合成了淀粉。用代表阿伏加德罗常数的值,下列说法正确的是( )
A.和混合气体的分子数为
B.通过与制得,转移电子数为
C.标准状况下,中含有的键
D.淀粉中含C原子数为
3.探究影响分解速率的影响因素,实验方案如图。
下列说法不正确的是( )
A.对比①②,可探究溶液对分解速率的影响
B.对比②③④,可探究温度对分解速率的影响
C.是直线形的非极性分子
D.易溶于水,主要是由于与分子之间能形成氢键
4.冠醚分子内形成空腔,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与形成的螯合离子的结构如图所示。
下列说法错误的是( )
A.该螯合离子所形成的物质是离子晶体,晶体中存在离子键、极性键、非极性键。
B.该螯合离子有4种一氯代物,中心离子的配位数为6
C.该螯合离子有分子识别和自组装的功能
D.该螯合离子中C原子杂化方式有2种,6个O原子与可能在同一平面上
5.我国科研人员发现氟磺酰基叠氮是一种安全、高效的“点击化学”试剂,其结构式如图,其中S为+6价,下列说法正确的是( )
A.该分子中S原子的价层电子对数为4 B.该分子中N原子均为杂化
C.电负性: D.第一电离能:
6.下列关于物质的结构或性质的描述及解释都正确的是( )
A.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强
B.稳定性:,是由于水分子间存在氢键
C.已知:B元素和元素的电负性差值大于N元素和元素的电负性差值,故极性:
D.键角:是由于中O上孤电子对数比分中O上的少
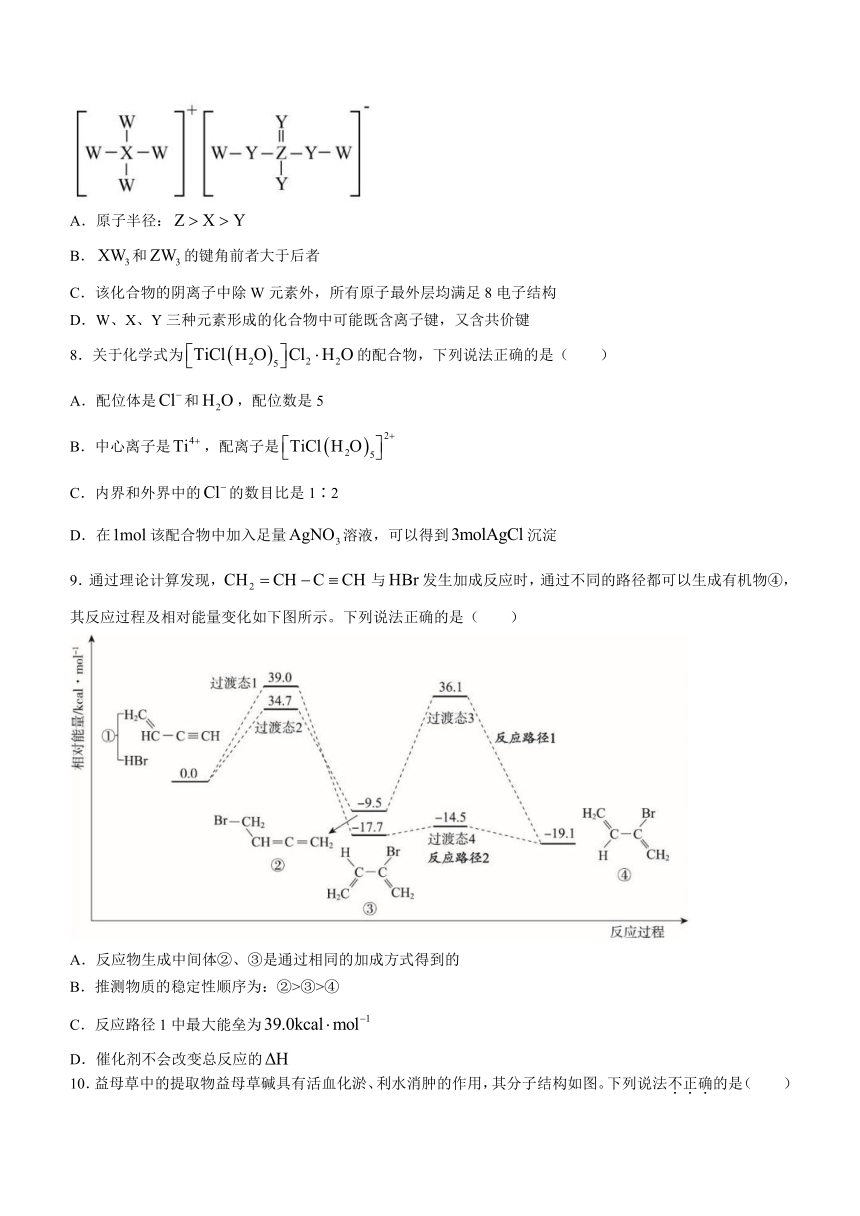
7.一种由四种短周期主族元素组成的化合物(结构如图所示)可用于制化肥、药物、木材防火剂,其中W、X、Y、Z的原子序数依次增大,且X与Y、Z均相邻。下列有关说法错误的是( )
A.原子半径:
B.和的键角前者大于后者
C.该化合物的阴离子中除W元素外,所有原子最外层均满足8电子结构
D.W、X、Y三种元素形成的化合物中可能既含离子键,又含共价键
8.关于化学式为的配合物,下列说法正确的是( )
A.配位体是和,配位数是5
B.中心离子是,配离子是
C.内界和外界中的的数目比是1∶2
D.在该配合物中加入足量溶液,可以得到沉淀
9.通过理论计算发现,与发生加成反应时,通过不同的路径都可以生成有机物④,其反应过程及相对能量变化如下图所示。下列说法正确的是( )
A.反应物生成中间体②、③是通过相同的加成方式得到的
B.推测物质的稳定性顺序为:②>③>④
C.反应路径1中最大能垒为
D.催化剂不会改变总反应的
10.益母草中的提取物益母草碱具有活血化淤、利水消肿的作用,其分子结构如图。下列说法不正确的是( )
A.存在3种含氧官能团 B.能发生取代、加成和氧化反应
C.既能与溶液反应又能与盐酸反应 D.分子中N原子的杂化方式都是
11.下列反应与电离平衡无关的是( )
A.溶液与溶液反应制备
B.电解饱和溶液制备
C.加氨水除去溶液中的杂质
D.将溶液加入水垢中使转化为
12.我国科学家设计可同时实现制备和海水淡化的新型电池,装置示意图如下。下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式:
C.每生成,有发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
13.时速600公里的磁浮列车需用到超导材料。超导材料具有型结构(如图所示),已知晶胞参数(晶胞边长)为,的相对分子质量为M。下列说法不正确的是( )
A.基态原子的电子排布式为 B.晶体中阴、阳离子的配位数都是4
C.该晶胞沿z轴的投影图为 D.该晶体的密度为
14.纳米是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )
A.化合物甲、乙均含有手性碳原子 B.化合物甲中至少有3个碳原子共平面
C.化合物乙中采取杂化的原子只有N、C D.化合物甲的沸点明显高于化合物乙
15.下列有关螺辛烷的说法正确的是( )
A.分子式为 B.一氯代物有4种
C.分子中所有碳原子共面 D.与互为同分异构体
16.二草酸合铜(Ⅱ)酸钾晶体是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是( )
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数
A.过程①微热的目的是加快草酸溶解,但会使草酸分解
B.过程②中加入的碳酸钾物质的量与草酸物质的量相等时,得到草酸氢钾溶液
C.操作③为趁热过滤,操作④为降温结晶、过滤洗涤、干燥
D.得到的产品用热水洗涤优于冷水洗涤
第Ⅱ卷
本部分共4题,共52分,除标注外每空2分
17.(14分)2022年北京冬奥会准备了678道营养丰富的餐点,其中维生素C重要的营养素,其结构如图所示:
(1)维生素C的分子式是_________,其中含有_________种官能团。
(2)维生素C易溶于水,可能的原因是___________________________。
(3)提取维生素C常用萃取的方法,有机物A是常用的有机萃取剂,也可以在手术时作麻醉剂,使用现代分析仪器对其分子结构进行测定,相关结果如图:
①利用有机物A萃取时用到的主要玻璃仪器是_________。(1分)
②有机物A的相对分子质量是_________。(1分)
③图3中两个峰的面积之比为2∶3,有机物A的结构简式是_________。
④有机物B是A的同分异构体,分子中含有一个羟基,核磁共振氢谱中含有两组峰,峰面积之比为1∶9,写出有机物B的结构简式_________.
(4)分子式为的有机物中,含有乙基支链的同分异构体分别是:_________(写出结构简式)
18.(14分)一种用硫铜矿(主要含及少量等)为原料制备的工艺流程如下:
已知:①是难溶于水和醇的白色固体,在热水中迅速水解生成;
②在潮湿的空气中易被氧化,生成的碱式盐为;
③已知开始生成沉淀和沉淀完全时的如下表:
金属离子
开始沉淀 4.7 8.1 1.2
完全沉淀 6.7 9.6 3.2
回答下列问题:
(1)“酸浸”时,富氧空气的作用_________。
(2)用氨水调时,应将溶液的范围调整为_________。
(3)“酸浸”时,反应的化学方程式为_________。
(4)“合成”时,生成发生反应的离子方程式为_________。
(5)准确称取所制备的氯化亚铜样品,将其置于过量的溶液中,待样品完全溶解后,加入适量稀硫酸,用的溶液滴定到终点,发生反应为,消耗溶液,样品中的质量分数为_________(杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为。
①图中原子的坐标参数:A为,B为,则C的坐标参数为_________。
②与最短的距离是_________。
19.(10分)二甲醚是无色气体,可作为一种新型能源。由合成气(组成为和少量)直接制备二甲醚,其中的主要过程包括以下四个反应:
①
②
③
④
试回答下列问题:
(1)一步法合成二甲醚的热化学方程式:_________;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为反应达到化学平衡状态的依据是_________。
A.平均摩尔质量保持不变 B.容器的密度不变
C.容器内压强保持不变 D.单位时间内消耗同时消耗二甲醚
(2)燃煤废气中的转化为二甲醚的反应原理为:,一定条件下,现有两个体积均为恒容密闭容器甲和乙,在甲中充入和,在乙中充入和,发生上述反应并达到平衡。该反应中的平衡转化率随温度的变化曲线如图1所示:容器甲中,在不同催化剂作用下,相同时间内的转化率随温度变化如图2所示。下列说法正确的是_________。
A.图1中,反应的
B.图1中,逆反应速率:状态Ⅰ<状态Ⅲ
C.图1中,表示乙容器的平衡转化率随温度变化的是曲线B
D.图2中,对应的平衡常数小于对应的平衡常数
E.图2中,根据图中曲线分析,催化剂Ⅲ的催化效果最好
(3)若和仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按(总量为)投料于恒容密闭容器中进行反应,的平衡转化率和甲醇的选择率(甲醇的选择率:转化的中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
①根据图中数据,温度选择_________K(填“473”、“513”或“553”),达到平衡时,反应体系内甲醇的产量最高。
②时,反应③的_________。
20.(14分)研究小组探究高铜酸钠()的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
实验Ⅰ.向溶液中滴加溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1)蓝绿色沉淀中含有。用离子方程式表示溶液显碱性的原因:_________.
(2)探究棕黑色沉淀的组成。
实验Ⅱ.将一份浊液a过滤、洗涤、干燥,得到固体b。取少量固体b,滴加稀,沉淀溶解,有气泡产生,得到蓝色溶液。
①另取少量固体b进行实验,证实了中钠元素的存在,实验操作的名称是_________.
②进一步检验,棕黑色固体是。与稀反应的离子方程式是_________。
(3)探究实验条件对制备的影响。
实验Ⅲ.向另一份浊液a中继续滴加溶液,沉淀由棕黑色变为蓝绿色,溶液的约为5,有产生。
①对的来源,甲同学认为是和反应生成了,乙同学认为该说法不严谨,提出了生成的其他原因:_________。
②探究“继续滴加溶液,能氧化”的原因。
ⅰ.提出假设1:增大,的还原性增强。实验证明假设成立。操作和现象是:取少量固体于试管中,_________。
ⅱ.提出假设2:_________,经证实该假设也成立。
(4)改进实验方案,进行实验。
实验Ⅳ,向溶液中滴加溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉试纸变蓝。
放置过程中产生气体的化学方程式是_________。
化学答案
第Ⅰ卷
本部分共16题,每题3分,共48分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C D C D A D C C D D D C B B B C
第Ⅱ卷
除标注外每空2分,共52分
17.(14分)(1) 3
(2)维C分子中含有多个羟基,与水形成分子间氢键,增大其在水中的溶解度
(3)分液漏斗 74
(4);;
18.(1)促进硫铜矿被溶解,将铁元素氧化成
(2) (3)
(4) (5) (6)
19.(1) B (2)AB (3)①553 ②
20.(14分)(1)
(2)①焰色试验 ②
(3)①减小,也可能氧化生成
②ⅰ.滴加浓溶液,产生使湿润的淀粉试纸变蓝的气体
ⅱ.增大,的氧化性增强
(4)
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Ca 40 Cu 64
第Ⅰ卷
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.中国首次在月球上发现新矿物并命名为“嫦娥石”,其晶体组成为。Y是一种稀土元素,常以形式存在。下列说法不正确的是( )
A.Y属于金属元素 B.属于s区元素
C.嫦娥石中的化合价为 D.可利用X射线衍射法获取其晶体结构
2.我国科研团队在人工合成淀粉方面取得突破性进展,通过制得,进而合成了淀粉。用代表阿伏加德罗常数的值,下列说法正确的是( )
A.和混合气体的分子数为
B.通过与制得,转移电子数为
C.标准状况下,中含有的键
D.淀粉中含C原子数为
3.探究影响分解速率的影响因素,实验方案如图。
下列说法不正确的是( )
A.对比①②,可探究溶液对分解速率的影响
B.对比②③④,可探究温度对分解速率的影响
C.是直线形的非极性分子
D.易溶于水,主要是由于与分子之间能形成氢键
4.冠醚分子内形成空腔,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与形成的螯合离子的结构如图所示。
下列说法错误的是( )
A.该螯合离子所形成的物质是离子晶体,晶体中存在离子键、极性键、非极性键。
B.该螯合离子有4种一氯代物,中心离子的配位数为6
C.该螯合离子有分子识别和自组装的功能
D.该螯合离子中C原子杂化方式有2种,6个O原子与可能在同一平面上
5.我国科研人员发现氟磺酰基叠氮是一种安全、高效的“点击化学”试剂,其结构式如图,其中S为+6价,下列说法正确的是( )
A.该分子中S原子的价层电子对数为4 B.该分子中N原子均为杂化
C.电负性: D.第一电离能:
6.下列关于物质的结构或性质的描述及解释都正确的是( )
A.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强
B.稳定性:,是由于水分子间存在氢键
C.已知:B元素和元素的电负性差值大于N元素和元素的电负性差值,故极性:
D.键角:是由于中O上孤电子对数比分中O上的少
7.一种由四种短周期主族元素组成的化合物(结构如图所示)可用于制化肥、药物、木材防火剂,其中W、X、Y、Z的原子序数依次增大,且X与Y、Z均相邻。下列有关说法错误的是( )
A.原子半径:
B.和的键角前者大于后者
C.该化合物的阴离子中除W元素外,所有原子最外层均满足8电子结构
D.W、X、Y三种元素形成的化合物中可能既含离子键,又含共价键
8.关于化学式为的配合物,下列说法正确的是( )
A.配位体是和,配位数是5
B.中心离子是,配离子是
C.内界和外界中的的数目比是1∶2
D.在该配合物中加入足量溶液,可以得到沉淀
9.通过理论计算发现,与发生加成反应时,通过不同的路径都可以生成有机物④,其反应过程及相对能量变化如下图所示。下列说法正确的是( )
A.反应物生成中间体②、③是通过相同的加成方式得到的
B.推测物质的稳定性顺序为:②>③>④
C.反应路径1中最大能垒为
D.催化剂不会改变总反应的
10.益母草中的提取物益母草碱具有活血化淤、利水消肿的作用,其分子结构如图。下列说法不正确的是( )
A.存在3种含氧官能团 B.能发生取代、加成和氧化反应
C.既能与溶液反应又能与盐酸反应 D.分子中N原子的杂化方式都是
11.下列反应与电离平衡无关的是( )
A.溶液与溶液反应制备
B.电解饱和溶液制备
C.加氨水除去溶液中的杂质
D.将溶液加入水垢中使转化为
12.我国科学家设计可同时实现制备和海水淡化的新型电池,装置示意图如下。下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式:
C.每生成,有发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
13.时速600公里的磁浮列车需用到超导材料。超导材料具有型结构(如图所示),已知晶胞参数(晶胞边长)为,的相对分子质量为M。下列说法不正确的是( )
A.基态原子的电子排布式为 B.晶体中阴、阳离子的配位数都是4
C.该晶胞沿z轴的投影图为 D.该晶体的密度为
14.纳米是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )
A.化合物甲、乙均含有手性碳原子 B.化合物甲中至少有3个碳原子共平面
C.化合物乙中采取杂化的原子只有N、C D.化合物甲的沸点明显高于化合物乙
15.下列有关螺辛烷的说法正确的是( )
A.分子式为 B.一氯代物有4种
C.分子中所有碳原子共面 D.与互为同分异构体
16.二草酸合铜(Ⅱ)酸钾晶体是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是( )
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数
A.过程①微热的目的是加快草酸溶解,但会使草酸分解
B.过程②中加入的碳酸钾物质的量与草酸物质的量相等时,得到草酸氢钾溶液
C.操作③为趁热过滤,操作④为降温结晶、过滤洗涤、干燥
D.得到的产品用热水洗涤优于冷水洗涤
第Ⅱ卷
本部分共4题,共52分,除标注外每空2分
17.(14分)2022年北京冬奥会准备了678道营养丰富的餐点,其中维生素C重要的营养素,其结构如图所示:
(1)维生素C的分子式是_________,其中含有_________种官能团。
(2)维生素C易溶于水,可能的原因是___________________________。
(3)提取维生素C常用萃取的方法,有机物A是常用的有机萃取剂,也可以在手术时作麻醉剂,使用现代分析仪器对其分子结构进行测定,相关结果如图:
①利用有机物A萃取时用到的主要玻璃仪器是_________。(1分)
②有机物A的相对分子质量是_________。(1分)
③图3中两个峰的面积之比为2∶3,有机物A的结构简式是_________。
④有机物B是A的同分异构体,分子中含有一个羟基,核磁共振氢谱中含有两组峰,峰面积之比为1∶9,写出有机物B的结构简式_________.
(4)分子式为的有机物中,含有乙基支链的同分异构体分别是:_________(写出结构简式)
18.(14分)一种用硫铜矿(主要含及少量等)为原料制备的工艺流程如下:
已知:①是难溶于水和醇的白色固体,在热水中迅速水解生成;
②在潮湿的空气中易被氧化,生成的碱式盐为;
③已知开始生成沉淀和沉淀完全时的如下表:
金属离子
开始沉淀 4.7 8.1 1.2
完全沉淀 6.7 9.6 3.2
回答下列问题:
(1)“酸浸”时,富氧空气的作用_________。
(2)用氨水调时,应将溶液的范围调整为_________。
(3)“酸浸”时,反应的化学方程式为_________。
(4)“合成”时,生成发生反应的离子方程式为_________。
(5)准确称取所制备的氯化亚铜样品,将其置于过量的溶液中,待样品完全溶解后,加入适量稀硫酸,用的溶液滴定到终点,发生反应为,消耗溶液,样品中的质量分数为_________(杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为。
①图中原子的坐标参数:A为,B为,则C的坐标参数为_________。
②与最短的距离是_________。
19.(10分)二甲醚是无色气体,可作为一种新型能源。由合成气(组成为和少量)直接制备二甲醚,其中的主要过程包括以下四个反应:
①
②
③
④
试回答下列问题:
(1)一步法合成二甲醚的热化学方程式:_________;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为反应达到化学平衡状态的依据是_________。
A.平均摩尔质量保持不变 B.容器的密度不变
C.容器内压强保持不变 D.单位时间内消耗同时消耗二甲醚
(2)燃煤废气中的转化为二甲醚的反应原理为:,一定条件下,现有两个体积均为恒容密闭容器甲和乙,在甲中充入和,在乙中充入和,发生上述反应并达到平衡。该反应中的平衡转化率随温度的变化曲线如图1所示:容器甲中,在不同催化剂作用下,相同时间内的转化率随温度变化如图2所示。下列说法正确的是_________。
A.图1中,反应的
B.图1中,逆反应速率:状态Ⅰ<状态Ⅲ
C.图1中,表示乙容器的平衡转化率随温度变化的是曲线B
D.图2中,对应的平衡常数小于对应的平衡常数
E.图2中,根据图中曲线分析,催化剂Ⅲ的催化效果最好
(3)若和仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按(总量为)投料于恒容密闭容器中进行反应,的平衡转化率和甲醇的选择率(甲醇的选择率:转化的中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
①根据图中数据,温度选择_________K(填“473”、“513”或“553”),达到平衡时,反应体系内甲醇的产量最高。
②时,反应③的_________。
20.(14分)研究小组探究高铜酸钠()的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
实验Ⅰ.向溶液中滴加溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1)蓝绿色沉淀中含有。用离子方程式表示溶液显碱性的原因:_________.
(2)探究棕黑色沉淀的组成。
实验Ⅱ.将一份浊液a过滤、洗涤、干燥,得到固体b。取少量固体b,滴加稀,沉淀溶解,有气泡产生,得到蓝色溶液。
①另取少量固体b进行实验,证实了中钠元素的存在,实验操作的名称是_________.
②进一步检验,棕黑色固体是。与稀反应的离子方程式是_________。
(3)探究实验条件对制备的影响。
实验Ⅲ.向另一份浊液a中继续滴加溶液,沉淀由棕黑色变为蓝绿色,溶液的约为5,有产生。
①对的来源,甲同学认为是和反应生成了,乙同学认为该说法不严谨,提出了生成的其他原因:_________。
②探究“继续滴加溶液,能氧化”的原因。
ⅰ.提出假设1:增大,的还原性增强。实验证明假设成立。操作和现象是:取少量固体于试管中,_________。
ⅱ.提出假设2:_________,经证实该假设也成立。
(4)改进实验方案,进行实验。
实验Ⅳ,向溶液中滴加溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉试纸变蓝。
放置过程中产生气体的化学方程式是_________。
化学答案
第Ⅰ卷
本部分共16题,每题3分,共48分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案 C D C D A D C C D D D C B B B C
第Ⅱ卷
除标注外每空2分,共52分
17.(14分)(1) 3
(2)维C分子中含有多个羟基,与水形成分子间氢键,增大其在水中的溶解度
(3)分液漏斗 74
(4);;
18.(1)促进硫铜矿被溶解,将铁元素氧化成
(2) (3)
(4) (5) (6)
19.(1) B (2)AB (3)①553 ②
20.(14分)(1)
(2)①焰色试验 ②
(3)①减小,也可能氧化生成
②ⅰ.滴加浓溶液,产生使湿润的淀粉试纸变蓝的气体
ⅱ.增大,的氧化性增强
(4)
同课章节目录
