人教版(2019)必修二 6.1.2 化学反应与电能 课件(共32张PPT)
文档属性
| 名称 | 人教版(2019)必修二 6.1.2 化学反应与电能 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 10:07:41 | ||
图片预览






文档简介
(共32张PPT)
第一节 化学反应与能量变化
课时2 化学反应与电能
第六章
化学反应
与能量
资料卡片
我们的生活很难离开电
电是从哪来的?
资料卡片
火力发电
核电站
水力发电
风力发电
我们日常使用的电能主要来自火力发电。
资料卡片
火力发电
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
直接?
火力发电:化学能经过一系列能量转化过程,间接转化为电能。
1.煤炭是不可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.转换环节多,能量损耗大,能量的利用率低,能源的利用率
仅为30%~40%
弊端
煤炭
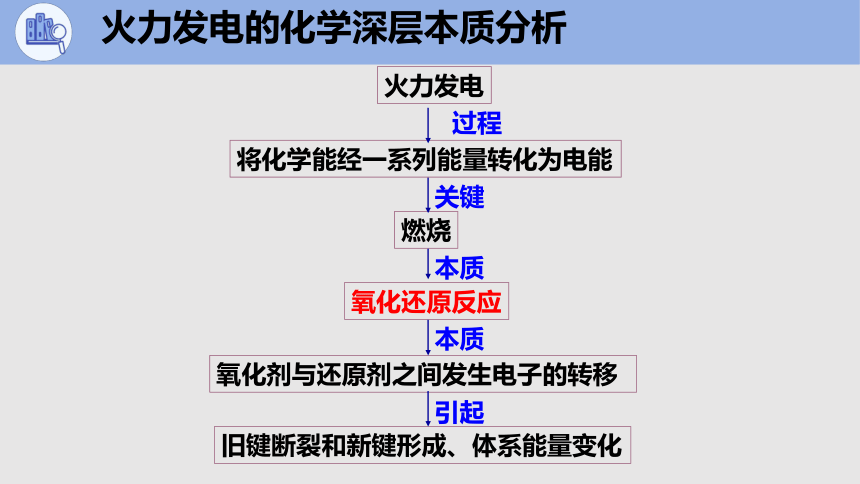
火力发电的化学深层本质分析
燃烧
氧化还原反应
氧化剂与还原剂之间发生电子的转移
火力发电
将化学能经一系列能量转化为电能
旧键断裂和新键形成、体系能量变化
过程
关键
本质
本质
引起
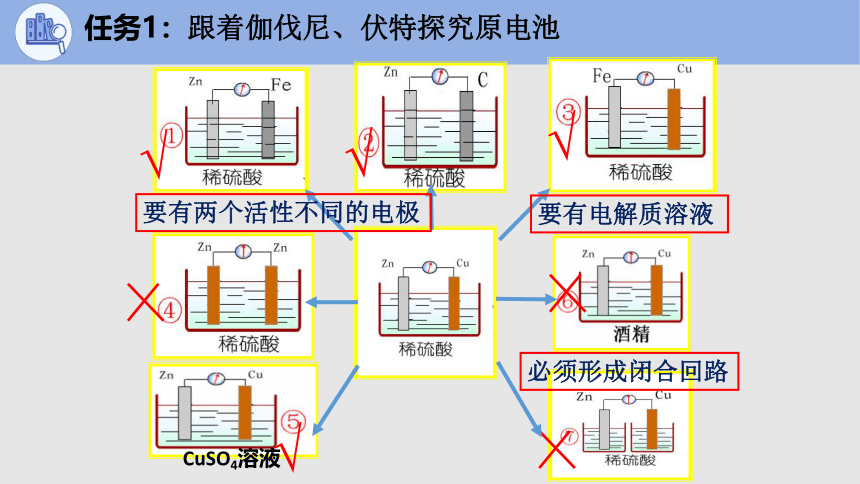
任务1:跟着伽伐尼、伏特探究原电池
伏打发现在用银质手术刀触碰放在铁盘上的青蛙的时候,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。如果只用一种金属器械去触动青蛙,就无此种反应。
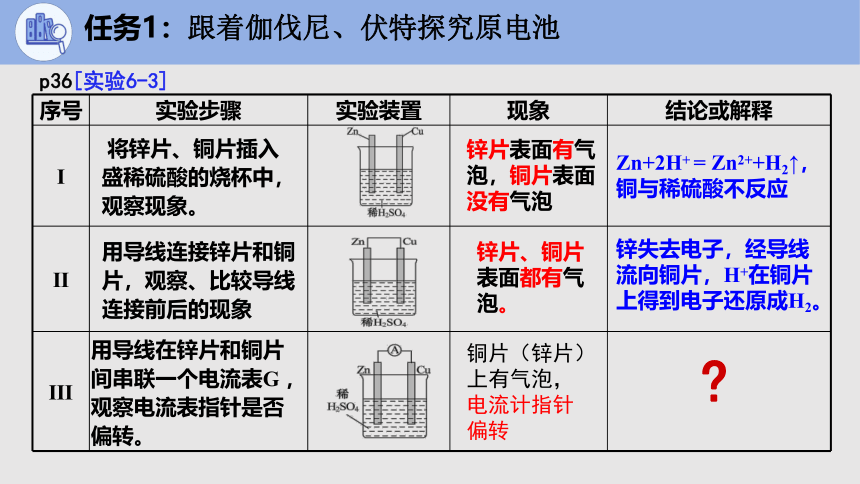
序号 实验步骤 实验装置 现象 结论或解释
Ⅰ 将锌片、铜片插入 盛稀硫酸的烧杯中,观察现象。
Ⅱ 用导线连接锌片和铜片,观察、比较导线连接前后的现象
Ⅲ 用导线在锌片和铜片间串联一个电流表G ,观察电流表指针是否偏转。
铜片(锌片)上有气泡,电流计指针偏转
任务1:跟着伽伐尼、伏特探究原电池
p36[实验6-3]
锌片表面有气泡,铜片表面没有气泡
Zn+2H+ = Zn2++H2↑,铜与稀硫酸不反应
锌片、铜片表面都有气泡。
锌失去电子,经导线流向铜片,H+在铜片上得到电子还原成H2。
任务1:跟着伽伐尼、伏特探究原电池
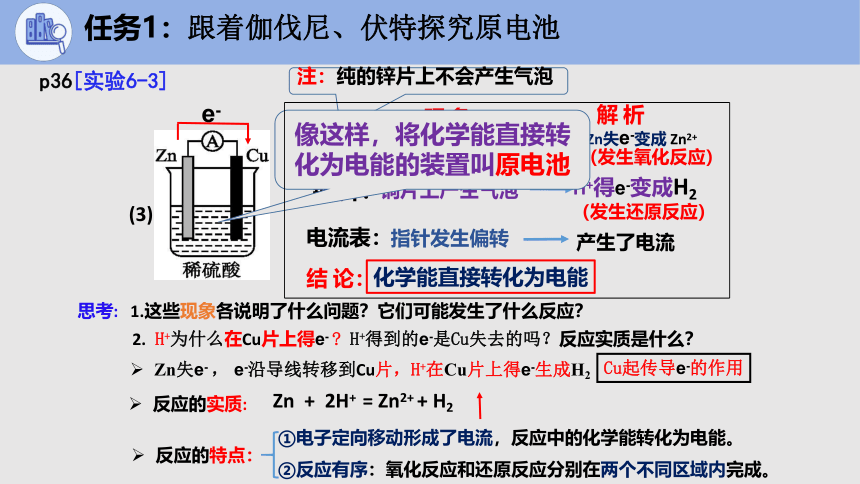
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
思考: 1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
反应的实质:
Zn + 2H+ = Zn2+ + H2
反应的特点:
电子定向移动形成了电流,反应中的化学能转化为电能。
反应有序:氧化反应和还原反应分别在两个不同区域内完成。
像这样,将化学能直接转化为电能的装置叫原电池
Cu起传导e-的作用
Zn失e- , e-沿导线转移到Cu片,H+在Cu片上得e-生成H2
e-
p36[实验6-3]
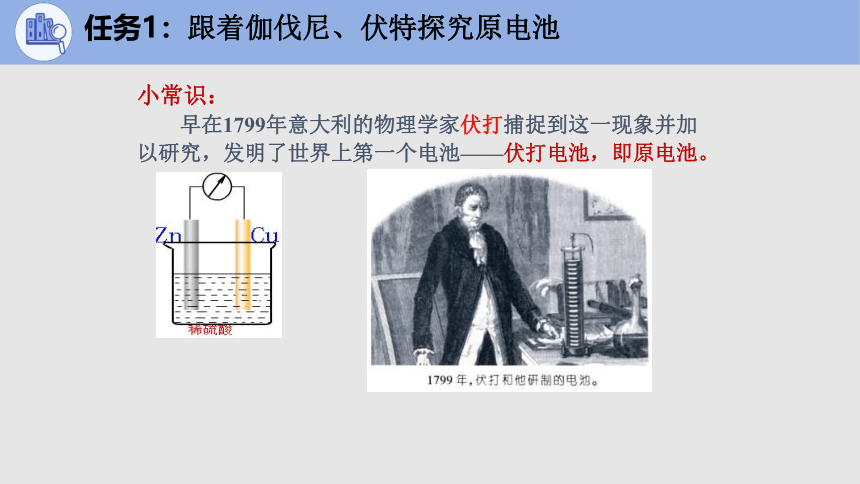
小常识:
早在1799年意大利的物理学家伏打捕捉到这一现象并加以研究,发明了世界上第一个电池——伏打电池,即原电池。
任务1:跟着伽伐尼、伏特探究原电池
任务1:跟着伽伐尼、伏特探究原电池
CuSO4溶液
√
√
√
√
要有两个活性不同的电极
要有电解质溶液
必须形成闭合回路
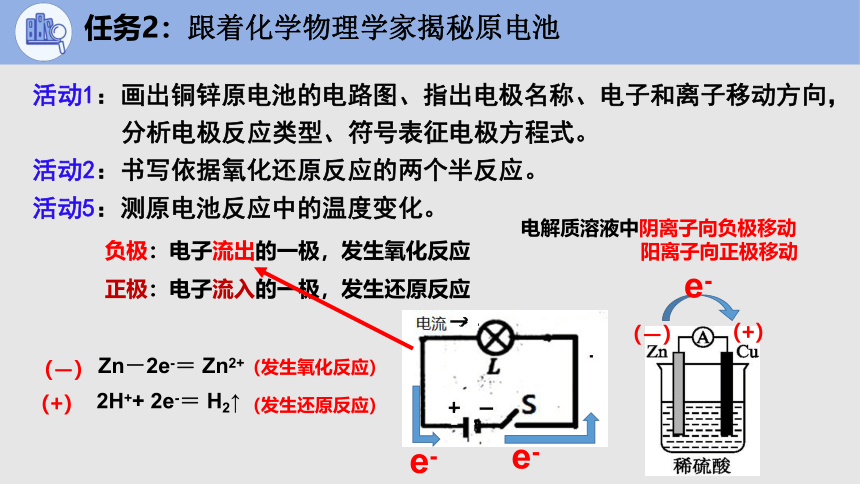
任务2:跟着化学物理学家揭秘原电池
(—)
(+)
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
e-
e-
e-
活动1:画出铜锌原电池的电路图、指出电极名称、电子和离子移动方向,
分析电极反应类型、符号表征电极方程式。
活动2:书写依据氧化还原反应的两个半反应。
活动5:测原电池反应中的温度变化。
Zn-2e-= Zn2+
2H++ 2e-= H2↑
(—)
(+)
(发生氧化反应)
(发生还原反应)
电解质溶液中阴离子向负极移动
阳离子向正极移动
任务2:跟着化学物理学家揭秘原电池
思考:实验Ⅰ和实验Ⅲ中能量转化形式有什么不同的?
化学能 热能
化学能 电能
Zn逐渐溶解
Zn表面产生气泡
溶液变热
Zn逐渐溶解
Cu表面产生气泡
指针偏转
任务2:跟着化学物理学家揭秘原电池
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-===Zn2+
氧化反应
还原反应
负极
正极
阳离子
阴离子
发生溶解
产生气泡
原电池总反应:Zn+2H+===Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
I
小结
任务2:跟着化学物理学家揭秘原电池
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
Ag
Fe
I
e-
e-
I
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式。
任务3:跟着理论模型解释化学现象并设计新型原电池
活动4:教师演示99.9%的锌片与稀硫酸接触后滴入硫酸铜实验,解释原理
任务3:跟着理论模型解释化学现象并设计新型原电池
任务3:跟着理论模型解释化学现象并设计新型原电池
活动5:制作一个水果电池。
任务3:跟着理论模型解释化学现象并设计新型原电池
电解质溶液
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
任务3:跟着理论模型解释化学现象并设计新型原电池
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
对比实验①②③或⑤⑥,得出结论:
在其他条件相同时,电极材料活泼性差别越大,电池效果越好。
思考:电极材料的选择对电池效果的影响?
任务3:跟着理论模型解释化学现象并设计新型原电池
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
2. 原电池的构成要素
任务3:跟着理论模型解释化学现象并设计新型原电池
活动6:阅读燃料电池(氢氧燃料电池)的资料
任务4:了解常见的化学电源
1.一次电池:放电之后不能充电的电池。
(内部氧化还原反应无法逆向进行)
负极(锌筒):Zn – 2e- = Zn2+ 氧化反应
正极(石墨棒):MnO2 得电子 还原反应
锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
p38页
任务4:了解常见的化学电源
负极: Pb +SO42- - 2e- = PbSO4
正极: PbO2 + 4H+ +SO42- +2e- = PbSO4 + 2H2O
正极:PbO2
负极:Pb
电解质:H2SO4溶液
氧化反应
还原反应
正负极材料
Pb + PbO2 + 4H+ +2SO42- 2PbSO4 + 2H2O
放电
充电
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅酸蓄电池。
化学与职业
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
原电池
电极
正极
负极
电子流出(失电子)的一极
电极材料:
较活泼金属
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子移动方向:
阳离子移向正极,阴离子移向负极
定义:把化学能转变为电能的装置
原电池形成条件
自发的氧化还原反应,电极材料,电解质溶液,闭合回路
原电池的应用
设计原电池
判断金属活泼性
加快反应速率
防止金属被腐蚀
整理与提升
原电池正负极的判断方法
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解
质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
稀硫酸
学习评价
1. 下列关于原电池的叙述中,不正确的是( )
C
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
稀硫酸
学习评价
稀硫酸
Al
Mg
A
氢氧化钠
Al
Mg
A
稀硝酸
Fe
Cu
A
浓硝酸
Fe
Cu
A
稀硫酸
硫酸铜
Zn
2. 请判断以下能否形成原电池,如果能形成,负极是哪一极?
学习评价
3.一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该反应的原电池组成合理的是
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn H2SO4溶液
D Cu Zn CuSO4溶液
√
学习评价
4.如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
以大概念为统摄的单元教学实践
案例2 “化学反应与能量”的单元教学设计与实施
4.围绕化学大概念的教学流程
单元课时 与情境 驱动任务 表现性活动 设计意图 持续性评价
第2课时 化学反应 与电能 情境: 火力发电中,能源的利用率仅为30%~ 40%。而且煤是不可再生的资源,会有用完的一年。伽伐尼的青蛙痉挛实验、伏打电池的发明史料。 跟着伽伐尼、伏特探究原电池 活动1:根据情境1思考:能否减少中间的能量转化环节,将化学能直接转化为电能?能否找到一类物质来代替煤进行发电? 活动2:提供多种电极材料(如铜、石墨、塑料棒等)与溶液(包含乙醇、稀硫酸、硫酸铜、氯化钠等)、电流表,探究形成原电池的基本要素。 根据生活情境,体会电池产生的必要性。 通过实验活动,和科学大师一起想,像科学家一样思考,得出形成原电池的基本要素,形成一般的科学方法和思想。(科学探究) 考查学生的实验观察能力、分析推理能力,原电池装置形成条件的归纳能力。
跟着化学物理学家揭秘原电池 活动3:画出铜锌原电池的电路图、指出电极名称、电子和离子移动方向,分析电极反应类型、符号表征电极方程式。 活动4:书写依据氧化还原反应的两个半反应。活动5:测原电池反应中的温度变化。 和老师一起想,在老师的引导、帮助、启发下展开思考,学会三重表征原电池原理,构建原电池理论模型(微观探析、模型认知) 为后续双液原电池留下窗口。 考查学生宏、微、符结合的水平,判断学生能否从微观 角读分析原电池装置中电子和离子的移动方向,书写电极反应式,模型构建能力
跟着理论模型解释化学现象并设计新型原电池 活动6:教师演示99.9%的锌片与稀硫酸接触后滴入硫酸铜实验,解释原理 活动7:制作一个水果电池。 活动7:阅读燃料电池(氢氧燃料电池)的资料 和同学们一起合作、思考,解决问题,体系教学评一体化。(科学探究、学科价值与社会责任) 考查同学的实验设计能力、合作能力、迁移应用能力、社会责任感。
第一节 化学反应与能量变化
课时2 化学反应与电能
第六章
化学反应
与能量
资料卡片
我们的生活很难离开电
电是从哪来的?
资料卡片
火力发电
核电站
水力发电
风力发电
我们日常使用的电能主要来自火力发电。
资料卡片
火力发电
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
直接?
火力发电:化学能经过一系列能量转化过程,间接转化为电能。
1.煤炭是不可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.转换环节多,能量损耗大,能量的利用率低,能源的利用率
仅为30%~40%
弊端
煤炭
火力发电的化学深层本质分析
燃烧
氧化还原反应
氧化剂与还原剂之间发生电子的转移
火力发电
将化学能经一系列能量转化为电能
旧键断裂和新键形成、体系能量变化
过程
关键
本质
本质
引起
任务1:跟着伽伐尼、伏特探究原电池
伏打发现在用银质手术刀触碰放在铁盘上的青蛙的时候,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。如果只用一种金属器械去触动青蛙,就无此种反应。
序号 实验步骤 实验装置 现象 结论或解释
Ⅰ 将锌片、铜片插入 盛稀硫酸的烧杯中,观察现象。
Ⅱ 用导线连接锌片和铜片,观察、比较导线连接前后的现象
Ⅲ 用导线在锌片和铜片间串联一个电流表G ,观察电流表指针是否偏转。
铜片(锌片)上有气泡,电流计指针偏转
任务1:跟着伽伐尼、伏特探究原电池
p36[实验6-3]
锌片表面有气泡,铜片表面没有气泡
Zn+2H+ = Zn2++H2↑,铜与稀硫酸不反应
锌片、铜片表面都有气泡。
锌失去电子,经导线流向铜片,H+在铜片上得到电子还原成H2。
任务1:跟着伽伐尼、伏特探究原电池
现 象:
(3)
锌 片:
注:纯的锌片上不会产生气泡
指针发生偏转
铜片上产生气泡
铜 片:
锌片部分溶解
电流表:
思考: 1.这些现象各说明了什么问题?它们可能发生了什么反应?
解 析
Zn失e-变成 Zn2+
H+得e-变成H2
产生了电流
化学能直接转化为电能
(发生氧化反应)
(发生还原反应)
结 论:
2. H+为什么在Cu片上得e- H+得到的e-是Cu失去的吗?反应实质是什么?
反应的实质:
Zn + 2H+ = Zn2+ + H2
反应的特点:
电子定向移动形成了电流,反应中的化学能转化为电能。
反应有序:氧化反应和还原反应分别在两个不同区域内完成。
像这样,将化学能直接转化为电能的装置叫原电池
Cu起传导e-的作用
Zn失e- , e-沿导线转移到Cu片,H+在Cu片上得e-生成H2
e-
p36[实验6-3]
小常识:
早在1799年意大利的物理学家伏打捕捉到这一现象并加以研究,发明了世界上第一个电池——伏打电池,即原电池。
任务1:跟着伽伐尼、伏特探究原电池
任务1:跟着伽伐尼、伏特探究原电池
CuSO4溶液
√
√
√
√
要有两个活性不同的电极
要有电解质溶液
必须形成闭合回路
任务2:跟着化学物理学家揭秘原电池
(—)
(+)
正极:电子流入的一极,发生还原反应
负极:电子流出的一极,发生氧化反应
e-
e-
e-
活动1:画出铜锌原电池的电路图、指出电极名称、电子和离子移动方向,
分析电极反应类型、符号表征电极方程式。
活动2:书写依据氧化还原反应的两个半反应。
活动5:测原电池反应中的温度变化。
Zn-2e-= Zn2+
2H++ 2e-= H2↑
(—)
(+)
(发生氧化反应)
(发生还原反应)
电解质溶液中阴离子向负极移动
阳离子向正极移动
任务2:跟着化学物理学家揭秘原电池
思考:实验Ⅰ和实验Ⅲ中能量转化形式有什么不同的?
化学能 热能
化学能 电能
Zn逐渐溶解
Zn表面产生气泡
溶液变热
Zn逐渐溶解
Cu表面产生气泡
指针偏转
任务2:跟着化学物理学家揭秘原电池
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-===Zn2+
氧化反应
还原反应
负极
正极
阳离子
阴离子
发生溶解
产生气泡
原电池总反应:Zn+2H+===Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
外电路
内电路
阴离子 负极
阳离子 正极
外电路
内电路
I
小结
任务2:跟着化学物理学家揭秘原电池
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
Ag
Fe
I
e-
e-
I
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式。
任务3:跟着理论模型解释化学现象并设计新型原电池
活动4:教师演示99.9%的锌片与稀硫酸接触后滴入硫酸铜实验,解释原理
任务3:跟着理论模型解释化学现象并设计新型原电池
任务3:跟着理论模型解释化学现象并设计新型原电池
活动5:制作一个水果电池。
任务3:跟着理论模型解释化学现象并设计新型原电池
电解质溶液
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
任务3:跟着理论模型解释化学现象并设计新型原电池
序号 电极(大小相同) 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
对比实验①②③或⑤⑥,得出结论:
在其他条件相同时,电极材料活泼性差别越大,电池效果越好。
思考:电极材料的选择对电池效果的影响?
任务3:跟着理论模型解释化学现象并设计新型原电池
自发进行的氧化还原反应
电极材料(金属、石墨棒)
形成闭合回路(导线、电解质溶液等)
2. 原电池的构成要素
任务3:跟着理论模型解释化学现象并设计新型原电池
活动6:阅读燃料电池(氢氧燃料电池)的资料
任务4:了解常见的化学电源
1.一次电池:放电之后不能充电的电池。
(内部氧化还原反应无法逆向进行)
负极(锌筒):Zn – 2e- = Zn2+ 氧化反应
正极(石墨棒):MnO2 得电子 还原反应
锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
p38页
任务4:了解常见的化学电源
负极: Pb +SO42- - 2e- = PbSO4
正极: PbO2 + 4H+ +SO42- +2e- = PbSO4 + 2H2O
正极:PbO2
负极:Pb
电解质:H2SO4溶液
氧化反应
还原反应
正负极材料
Pb + PbO2 + 4H+ +2SO42- 2PbSO4 + 2H2O
放电
充电
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅酸蓄电池。
化学与职业
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
原电池
电极
正极
负极
电子流出(失电子)的一极
电极材料:
较活泼金属
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子移动方向:
阳离子移向正极,阴离子移向负极
定义:把化学能转变为电能的装置
原电池形成条件
自发的氧化还原反应,电极材料,电解质溶液,闭合回路
原电池的应用
设计原电池
判断金属活泼性
加快反应速率
防止金属被腐蚀
整理与提升
原电池正负极的判断方法
电极材料
反应类型
电子流向
电极现象
离子移向
负极
正极
较活泼金属
较不活泼金属或
能导电的非金属
氧化反应
还原反应
电子流出
电子流入
e-
不断溶解
质量减小
电极增重或
有气体产生
阴离子移向
阳离子移向
稀硫酸
学习评价
1. 下列关于原电池的叙述中,不正确的是( )
C
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
稀硫酸
学习评价
稀硫酸
Al
Mg
A
氢氧化钠
Al
Mg
A
稀硝酸
Fe
Cu
A
浓硝酸
Fe
Cu
A
稀硫酸
硫酸铜
Zn
2. 请判断以下能否形成原电池,如果能形成,负极是哪一极?
学习评价
3.一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该反应的原电池组成合理的是
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn H2SO4溶液
D Cu Zn CuSO4溶液
√
学习评价
4.如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
以大概念为统摄的单元教学实践
案例2 “化学反应与能量”的单元教学设计与实施
4.围绕化学大概念的教学流程
单元课时 与情境 驱动任务 表现性活动 设计意图 持续性评价
第2课时 化学反应 与电能 情境: 火力发电中,能源的利用率仅为30%~ 40%。而且煤是不可再生的资源,会有用完的一年。伽伐尼的青蛙痉挛实验、伏打电池的发明史料。 跟着伽伐尼、伏特探究原电池 活动1:根据情境1思考:能否减少中间的能量转化环节,将化学能直接转化为电能?能否找到一类物质来代替煤进行发电? 活动2:提供多种电极材料(如铜、石墨、塑料棒等)与溶液(包含乙醇、稀硫酸、硫酸铜、氯化钠等)、电流表,探究形成原电池的基本要素。 根据生活情境,体会电池产生的必要性。 通过实验活动,和科学大师一起想,像科学家一样思考,得出形成原电池的基本要素,形成一般的科学方法和思想。(科学探究) 考查学生的实验观察能力、分析推理能力,原电池装置形成条件的归纳能力。
跟着化学物理学家揭秘原电池 活动3:画出铜锌原电池的电路图、指出电极名称、电子和离子移动方向,分析电极反应类型、符号表征电极方程式。 活动4:书写依据氧化还原反应的两个半反应。活动5:测原电池反应中的温度变化。 和老师一起想,在老师的引导、帮助、启发下展开思考,学会三重表征原电池原理,构建原电池理论模型(微观探析、模型认知) 为后续双液原电池留下窗口。 考查学生宏、微、符结合的水平,判断学生能否从微观 角读分析原电池装置中电子和离子的移动方向,书写电极反应式,模型构建能力
跟着理论模型解释化学现象并设计新型原电池 活动6:教师演示99.9%的锌片与稀硫酸接触后滴入硫酸铜实验,解释原理 活动7:制作一个水果电池。 活动7:阅读燃料电池(氢氧燃料电池)的资料 和同学们一起合作、思考,解决问题,体系教学评一体化。(科学探究、学科价值与社会责任) 考查同学的实验设计能力、合作能力、迁移应用能力、社会责任感。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
