人教版(2019)必修二 7.4.2 蛋白质 课件(共21张PPT)
文档属性
| 名称 | 人教版(2019)必修二 7.4.2 蛋白质 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 11:34:11 | ||
图片预览



文档简介
(共21张PPT)
第七章 第四节
第二课时
基本营养物质--蛋白质
学
习
目
标
学
习
重
点
学
习
难
点
设计实验探究蛋白质性质
1、掌握氨基酸、蛋白质的组成、结构及其主要性质
2、了解蛋白质在日常生活、生产中的应用
核
心
素
养
2、科学探究:蛋白质的结构、性质提出可能的假设,设计实验探究蛋白质的性质。
1、微观探析:能从官能团的角度认识蛋白质的组成、结构、 性质和变化,形成“结构决定性质”的观念。
氨基酸、蛋白质的组成、结构及其主要性质
[问题1]你知道哪些物质中富含蛋白质吗?
一、蛋白质
1.主要存在
动物蛋白
植物蛋白
肌肉、毛发、皮肤、脚蹄、蛋清、酶、激素、抗体、病毒、乳汁、血红蛋白、血液
大豆、花生、谷物、蚕丝
2.组成
由碳、氢、氧、氮、硫等元素组成,是一类非常复杂的天然有机高分子。
[问题2]结合我们生活中接触的蛋白质,思考蛋白质能溶于水吗?
3.物理性质
有的蛋白质能溶于水,如鸡蛋清等;有的难溶于水,如丝、毛等。
(最终产物)
多肽
氨基酸
蛋白质
酸、碱或酶
水解反应
水解反应
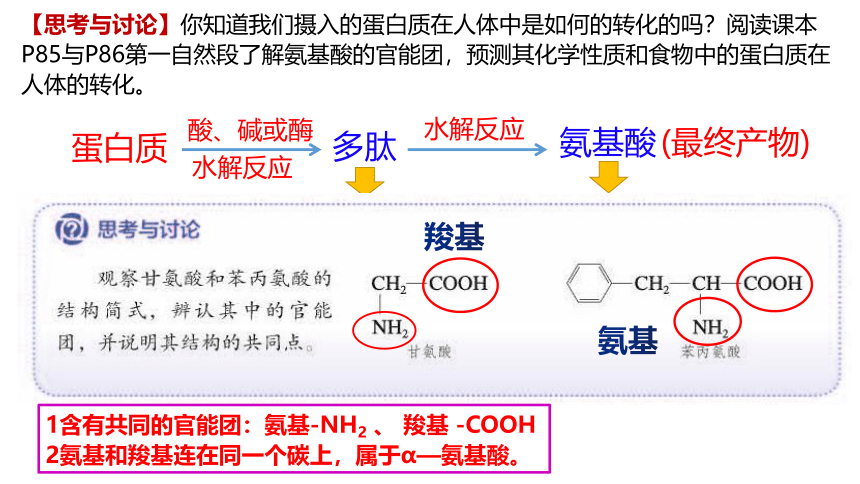
【思考与讨论】你知道我们摄入的蛋白质在人体中是如何的转化的吗?阅读课本P85与P86第一自然段了解氨基酸的官能团,预测其化学性质和食物中的蛋白质在人体的转化。
羧基
氨基
1含有共同的官能团:氨基-NH2 、 羧基 -COOH
2氨基和羧基连在同一个碳上,属于α—氨基酸。
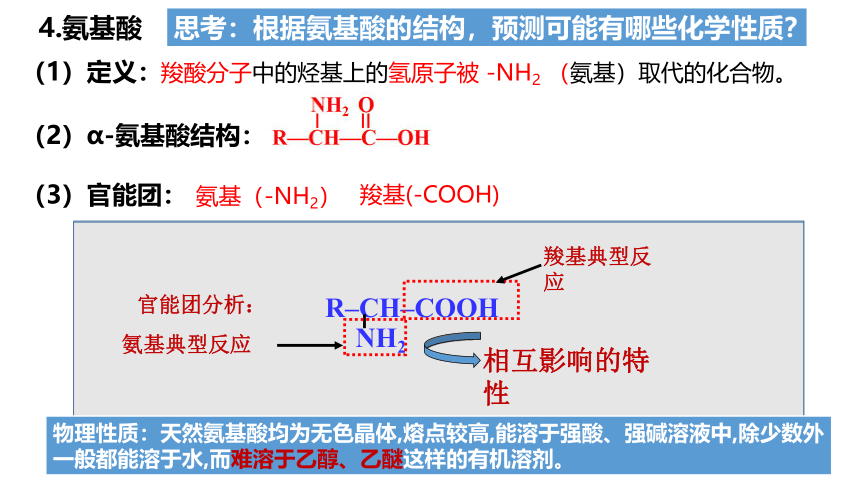
(1)定义:
(2)α-氨基酸结构:
(3)官能团:
氨基(-NH2)
羧基(-COOH)
4.氨基酸
羧酸分子中的烃基上的氢原子被 -NH2 (氨基)取代的化合物。
几种常见的氨基酸
CH2COOH
NH2
甘氨酸
CH3-CH-COOH
NH2
丙氨酸
NH2
HOOC-(CH2)2-CH-COOH
谷氨酸
苯丙氨酸
思考:根据氨基酸的结构,预测可能有哪些化学性质?
R–CH–COOH
NH2
氨基典型反应
相互影响的特性
官能团分析:
羧基典型反应
物理性质:天然氨基酸均为无色晶体,熔点较高,能溶于强酸、强碱溶液中,除少数外一般都能溶于水,而难溶于乙醇、乙醚这样的有机溶剂。
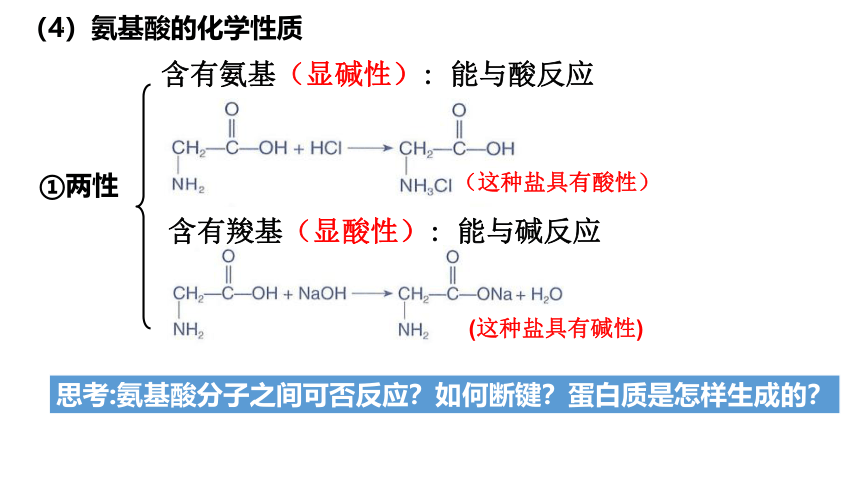
(4)氨基酸的化学性质
①两性
含有氨基(显碱性): 能与酸反应
含有羧基(显酸性): 能与碱反应
(这种盐具有酸性)
(这种盐具有碱性)
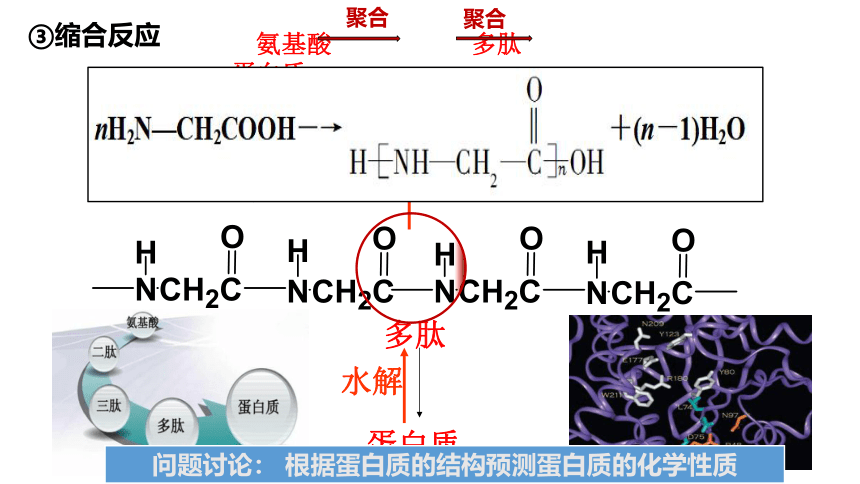
思考:氨基酸分子之间可否反应?如何断键?蛋白质是怎样生成的?
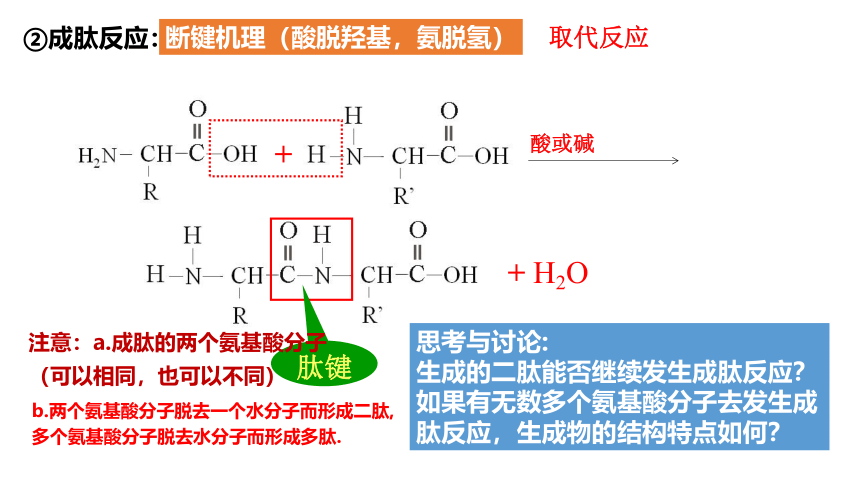
②成肽反应:
断键机理(酸脱羟基,氨脱氢)
取代反应
+ H2O
+
肽键
酸或碱
思考与讨论:
生成的二肽能否继续发生成肽反应?如果有无数多个氨基酸分子去发生成肽反应,生成物的结构特点如何?
注意:a.成肽的两个氨基酸分子
(可以相同,也可以不同)
b.两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
H2O
H2O
H2O
蛋白质
多肽
水解
水解
问题讨论: 根据蛋白质的结构预测蛋白质的化学性质
氨基酸 多肽 蛋白质
聚合
聚合
③缩合反应
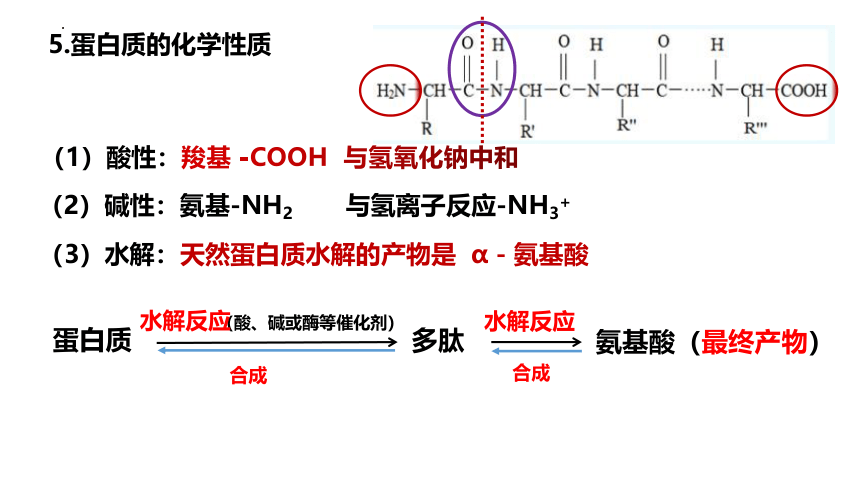
(1)酸性:羧基 -COOH 与氢氧化钠中和
(2)碱性:氨基-NH2 与氢离子反应-NH3+
(3)水解:天然蛋白质水解的产物是 α-氨基酸
5.蛋白质的化学性质
蛋白质
(酸、碱或酶等催化剂)
水解反应
氨基酸(最终产物)
多肽
水解反应
合成
合成
1、下列物质中既能与盐酸反应,又能NaOH溶液反应的是( ) ①NaHCO3 ; ②(NH4)2S ; ③Al(OH)3 ; ④NH4Cl;⑤Al; ⑥Al2O;
⑦H2N-CH2-COOH ; ⑧CH3-COOH; ⑨蛋白质
A.①②③⑧ B.①②④⑤ C.⑤⑥⑦⑧⑨ D.①②③⑤⑥⑦⑨
D
课堂检测
小结 :既能与强酸又能与强碱反应的物质
(1)两性金属:Al (2)两性氧化物:Al2O3
(3)两性氢氧化物 (4)弱酸的酸式盐
(5)弱酸的铵盐 (6)氨基酸和蛋白质(7)酯类物质
知识应用与拓展
新型冠状病毒三维结构
显微镜下的蛋白质分子
病毒都是蛋白质分子,我们知道使用消毒剂、高温等手段可以消灭病毒,这是为什么呢?
【实验7-8】
(1) 向盛有鸡蛋清溶液的试管中加入几滴酷酸铅溶液,观察现象。
(2) 向盛有鸡蛋清溶液的试管中滴入几滴浓硝酸,加热,观察现象。
(3) 在酒精灯的火焰上分别灼烧一小段头发和丝织品,小心地闻气味。
实
验
现
象
(1)加入醋酸铅溶液,试管内生成白色沉淀,加入蒸馏水后沉淀不溶解。
(2)溶液变黄
(3)产生类似烧焦羽毛的特殊气味
(4)变性:
②某些条件
物理因素:
化学因素:
加热、加压、搅拌、震荡、紫外线、超声波等
①强酸,强碱
②重金属盐(醋酸铅、硫酸铜等)
③某些有机物(甲酸、酒精、苯酚等)
①定义:蛋白质在一些化学试剂或一些物理因素作用下,失去生理活性,溶解度下降而析出的过程。
蛋白质的变性是不可逆的化学变化
④灼烧:蛋白质被灼烧时,会产生类似烧焦羽毛的气味。
③显色反应:很多蛋白质与浓硝酸作用时呈黄色。
可用于蛋白质的鉴别
应用:杀菌消毒,而疫苗等生物制剂的保存则要防止变性。
应用:鉴别羊毛制品和纤维制品
蛋白质的
特征反应
取一小段儿毛线和棉线,在火上点燃,注意观察灼烧后状态,气味。
1、误服重金属盐,为什么可以喝大量的牛奶,豆浆、蛋清?
(利用蛋白质变性)形成不溶于水的的物质排出体外,降低危害,缓解毒性。
2、如何鉴别纯毛织品和纯棉织品?
学以致用
3、羊毛织品和蚕丝织品的衣料是否可以用加酶洗衣粉洗涤?
不可以。碱性蛋白酶能使蛋白质水解,而羊毛织品和蚕丝织品的主要成分均属于蛋白质,因此不能用加酶洗衣粉洗涤。
【思考与讨论】
1.为什么医院里用高温蒸煮、紫外线照射或涂抹医用酒精的方法进行消毒?
2.在生物实验室里,用40%的甲醛溶液(俗称福尔马林)保存动物标本,其原因是什么?在农业上常用硫酸铜、生石灰和水制成的波尔多液来防治农作物病害,原因又是什么?
思考:如何从蛋白质的水溶液中分离提纯出蛋白质呢?
向两支盛有鸡蛋清溶液的试管中分别加入几滴(NH4)2SO4、Na2SO4溶液,观察现象。
【实验现象】
有机物溶液中加入某些浓的无机盐(Na2SO4(NH4)2SO4)溶液后,可以降低有机物的溶解度,使之析出,此过程为盐析。
注意 盐析是可逆的物理变化。
应用 分离提纯蛋白质
变性:加入重金属盐等 不可逆的 化学变化
有白色絮状物质析出,白色絮状物质放入水中,溶解。
【实验探究】
(5)蛋白质的盐析
加入某种物质后有沉淀生成
不可逆
可逆,加水即可
杀菌、消毒、防中毒
分离、提纯蛋白质
强酸、强碱、重金属盐、醛、加热、剧烈震动等
加入某些浓盐溶液,如: Na2SO4(NH4)2SO4等
相同点
复原
盐
不
同
用途
不
同
点
变性
盐析
盐析与变性的对比
阅读课本P86最后自然段,总结蛋白质的应用
蛋白质
动物的毛、蚕丝是很好的纺织原料
动物的皮革是衣服的原料
驴皮熬制的胶是一种药材——阿胶
牛奶中的蛋白质与甲醛制酪素塑料
大多数生物酶是蛋白质
人类的主要食品
6.蛋白质的主要应用:
1965年我国科学家首次完成牛胰岛素的
全合成,为蛋白质的研究做出了重大贡献。
(1)蛋白质都是高分子化合物,组成元素只有C、H、O、N( )
(2)蛋白质在酶的作用下,可直接水解生成各种氨基酸( )
(3)生物体内的酶都是蛋白质( )
(4)蛋白质溶液遇到盐就会变性( )
(5)蛋白质变性属于化学变化( )
×
×
×
×
√
(6)向鸡蛋白溶液中加入醋酸铅溶液,生成白色沉淀,加水可重新溶解
( )
(7)可以通过灼烧的方法鉴别真蚕丝和人造丝( )
×
√
课堂检测
1、判断下列说法是否正确
D
C
3.现有四种试剂:A.新制Cu(OH)2悬浊液;B.浓硝酸;C.AgNO3溶液;
D.碘水。为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其填入
相应的括号中。
(1) 葡萄糖溶液 ( ) (2)食盐溶液 ( )
(3) 淀粉溶液 ( ) (4)鸡蛋清溶液 ( )
A
C
D
B
4.下面关于蛋白质的叙述不正确的是( )
A.在豆浆中加入少量石膏,能使豆浆中的蛋白质凝结,从而制成豆腐
B.蛋白质都是高分子化合物
C.蛋白质在酶的作用下水解的最终产物是葡萄糖
D.若误食重金属盐而引起中毒,可服用大量牛奶或豆浆进行解救
C
课堂小结
第七章 第四节
第二课时
基本营养物质--蛋白质
学
习
目
标
学
习
重
点
学
习
难
点
设计实验探究蛋白质性质
1、掌握氨基酸、蛋白质的组成、结构及其主要性质
2、了解蛋白质在日常生活、生产中的应用
核
心
素
养
2、科学探究:蛋白质的结构、性质提出可能的假设,设计实验探究蛋白质的性质。
1、微观探析:能从官能团的角度认识蛋白质的组成、结构、 性质和变化,形成“结构决定性质”的观念。
氨基酸、蛋白质的组成、结构及其主要性质
[问题1]你知道哪些物质中富含蛋白质吗?
一、蛋白质
1.主要存在
动物蛋白
植物蛋白
肌肉、毛发、皮肤、脚蹄、蛋清、酶、激素、抗体、病毒、乳汁、血红蛋白、血液
大豆、花生、谷物、蚕丝
2.组成
由碳、氢、氧、氮、硫等元素组成,是一类非常复杂的天然有机高分子。
[问题2]结合我们生活中接触的蛋白质,思考蛋白质能溶于水吗?
3.物理性质
有的蛋白质能溶于水,如鸡蛋清等;有的难溶于水,如丝、毛等。
(最终产物)
多肽
氨基酸
蛋白质
酸、碱或酶
水解反应
水解反应
【思考与讨论】你知道我们摄入的蛋白质在人体中是如何的转化的吗?阅读课本P85与P86第一自然段了解氨基酸的官能团,预测其化学性质和食物中的蛋白质在人体的转化。
羧基
氨基
1含有共同的官能团:氨基-NH2 、 羧基 -COOH
2氨基和羧基连在同一个碳上,属于α—氨基酸。
(1)定义:
(2)α-氨基酸结构:
(3)官能团:
氨基(-NH2)
羧基(-COOH)
4.氨基酸
羧酸分子中的烃基上的氢原子被 -NH2 (氨基)取代的化合物。
几种常见的氨基酸
CH2COOH
NH2
甘氨酸
CH3-CH-COOH
NH2
丙氨酸
NH2
HOOC-(CH2)2-CH-COOH
谷氨酸
苯丙氨酸
思考:根据氨基酸的结构,预测可能有哪些化学性质?
R–CH–COOH
NH2
氨基典型反应
相互影响的特性
官能团分析:
羧基典型反应
物理性质:天然氨基酸均为无色晶体,熔点较高,能溶于强酸、强碱溶液中,除少数外一般都能溶于水,而难溶于乙醇、乙醚这样的有机溶剂。
(4)氨基酸的化学性质
①两性
含有氨基(显碱性): 能与酸反应
含有羧基(显酸性): 能与碱反应
(这种盐具有酸性)
(这种盐具有碱性)
思考:氨基酸分子之间可否反应?如何断键?蛋白质是怎样生成的?
②成肽反应:
断键机理(酸脱羟基,氨脱氢)
取代反应
+ H2O
+
肽键
酸或碱
思考与讨论:
生成的二肽能否继续发生成肽反应?如果有无数多个氨基酸分子去发生成肽反应,生成物的结构特点如何?
注意:a.成肽的两个氨基酸分子
(可以相同,也可以不同)
b.两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
H2O
H2O
H2O
蛋白质
多肽
水解
水解
问题讨论: 根据蛋白质的结构预测蛋白质的化学性质
氨基酸 多肽 蛋白质
聚合
聚合
③缩合反应
(1)酸性:羧基 -COOH 与氢氧化钠中和
(2)碱性:氨基-NH2 与氢离子反应-NH3+
(3)水解:天然蛋白质水解的产物是 α-氨基酸
5.蛋白质的化学性质
蛋白质
(酸、碱或酶等催化剂)
水解反应
氨基酸(最终产物)
多肽
水解反应
合成
合成
1、下列物质中既能与盐酸反应,又能NaOH溶液反应的是( ) ①NaHCO3 ; ②(NH4)2S ; ③Al(OH)3 ; ④NH4Cl;⑤Al; ⑥Al2O;
⑦H2N-CH2-COOH ; ⑧CH3-COOH; ⑨蛋白质
A.①②③⑧ B.①②④⑤ C.⑤⑥⑦⑧⑨ D.①②③⑤⑥⑦⑨
D
课堂检测
小结 :既能与强酸又能与强碱反应的物质
(1)两性金属:Al (2)两性氧化物:Al2O3
(3)两性氢氧化物 (4)弱酸的酸式盐
(5)弱酸的铵盐 (6)氨基酸和蛋白质(7)酯类物质
知识应用与拓展
新型冠状病毒三维结构
显微镜下的蛋白质分子
病毒都是蛋白质分子,我们知道使用消毒剂、高温等手段可以消灭病毒,这是为什么呢?
【实验7-8】
(1) 向盛有鸡蛋清溶液的试管中加入几滴酷酸铅溶液,观察现象。
(2) 向盛有鸡蛋清溶液的试管中滴入几滴浓硝酸,加热,观察现象。
(3) 在酒精灯的火焰上分别灼烧一小段头发和丝织品,小心地闻气味。
实
验
现
象
(1)加入醋酸铅溶液,试管内生成白色沉淀,加入蒸馏水后沉淀不溶解。
(2)溶液变黄
(3)产生类似烧焦羽毛的特殊气味
(4)变性:
②某些条件
物理因素:
化学因素:
加热、加压、搅拌、震荡、紫外线、超声波等
①强酸,强碱
②重金属盐(醋酸铅、硫酸铜等)
③某些有机物(甲酸、酒精、苯酚等)
①定义:蛋白质在一些化学试剂或一些物理因素作用下,失去生理活性,溶解度下降而析出的过程。
蛋白质的变性是不可逆的化学变化
④灼烧:蛋白质被灼烧时,会产生类似烧焦羽毛的气味。
③显色反应:很多蛋白质与浓硝酸作用时呈黄色。
可用于蛋白质的鉴别
应用:杀菌消毒,而疫苗等生物制剂的保存则要防止变性。
应用:鉴别羊毛制品和纤维制品
蛋白质的
特征反应
取一小段儿毛线和棉线,在火上点燃,注意观察灼烧后状态,气味。
1、误服重金属盐,为什么可以喝大量的牛奶,豆浆、蛋清?
(利用蛋白质变性)形成不溶于水的的物质排出体外,降低危害,缓解毒性。
2、如何鉴别纯毛织品和纯棉织品?
学以致用
3、羊毛织品和蚕丝织品的衣料是否可以用加酶洗衣粉洗涤?
不可以。碱性蛋白酶能使蛋白质水解,而羊毛织品和蚕丝织品的主要成分均属于蛋白质,因此不能用加酶洗衣粉洗涤。
【思考与讨论】
1.为什么医院里用高温蒸煮、紫外线照射或涂抹医用酒精的方法进行消毒?
2.在生物实验室里,用40%的甲醛溶液(俗称福尔马林)保存动物标本,其原因是什么?在农业上常用硫酸铜、生石灰和水制成的波尔多液来防治农作物病害,原因又是什么?
思考:如何从蛋白质的水溶液中分离提纯出蛋白质呢?
向两支盛有鸡蛋清溶液的试管中分别加入几滴(NH4)2SO4、Na2SO4溶液,观察现象。
【实验现象】
有机物溶液中加入某些浓的无机盐(Na2SO4(NH4)2SO4)溶液后,可以降低有机物的溶解度,使之析出,此过程为盐析。
注意 盐析是可逆的物理变化。
应用 分离提纯蛋白质
变性:加入重金属盐等 不可逆的 化学变化
有白色絮状物质析出,白色絮状物质放入水中,溶解。
【实验探究】
(5)蛋白质的盐析
加入某种物质后有沉淀生成
不可逆
可逆,加水即可
杀菌、消毒、防中毒
分离、提纯蛋白质
强酸、强碱、重金属盐、醛、加热、剧烈震动等
加入某些浓盐溶液,如: Na2SO4(NH4)2SO4等
相同点
复原
盐
不
同
用途
不
同
点
变性
盐析
盐析与变性的对比
阅读课本P86最后自然段,总结蛋白质的应用
蛋白质
动物的毛、蚕丝是很好的纺织原料
动物的皮革是衣服的原料
驴皮熬制的胶是一种药材——阿胶
牛奶中的蛋白质与甲醛制酪素塑料
大多数生物酶是蛋白质
人类的主要食品
6.蛋白质的主要应用:
1965年我国科学家首次完成牛胰岛素的
全合成,为蛋白质的研究做出了重大贡献。
(1)蛋白质都是高分子化合物,组成元素只有C、H、O、N( )
(2)蛋白质在酶的作用下,可直接水解生成各种氨基酸( )
(3)生物体内的酶都是蛋白质( )
(4)蛋白质溶液遇到盐就会变性( )
(5)蛋白质变性属于化学变化( )
×
×
×
×
√
(6)向鸡蛋白溶液中加入醋酸铅溶液,生成白色沉淀,加水可重新溶解
( )
(7)可以通过灼烧的方法鉴别真蚕丝和人造丝( )
×
√
课堂检测
1、判断下列说法是否正确
D
C
3.现有四种试剂:A.新制Cu(OH)2悬浊液;B.浓硝酸;C.AgNO3溶液;
D.碘水。为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其填入
相应的括号中。
(1) 葡萄糖溶液 ( ) (2)食盐溶液 ( )
(3) 淀粉溶液 ( ) (4)鸡蛋清溶液 ( )
A
C
D
B
4.下面关于蛋白质的叙述不正确的是( )
A.在豆浆中加入少量石膏,能使豆浆中的蛋白质凝结,从而制成豆腐
B.蛋白质都是高分子化合物
C.蛋白质在酶的作用下水解的最终产物是葡萄糖
D.若误食重金属盐而引起中毒,可服用大量牛奶或豆浆进行解救
C
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
