人教版(2019)选择性必修二 3.2 分子晶体 课件(共32张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 3.2 分子晶体 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 11:41:18 | ||
图片预览









文档简介
(共32张PPT)
分子晶体
选择性必修2 第三章 第二节
请判断下列固体是否属于晶体?并说明理由。
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
分子晶体
离子晶体
共价晶体
【思考与讨论】
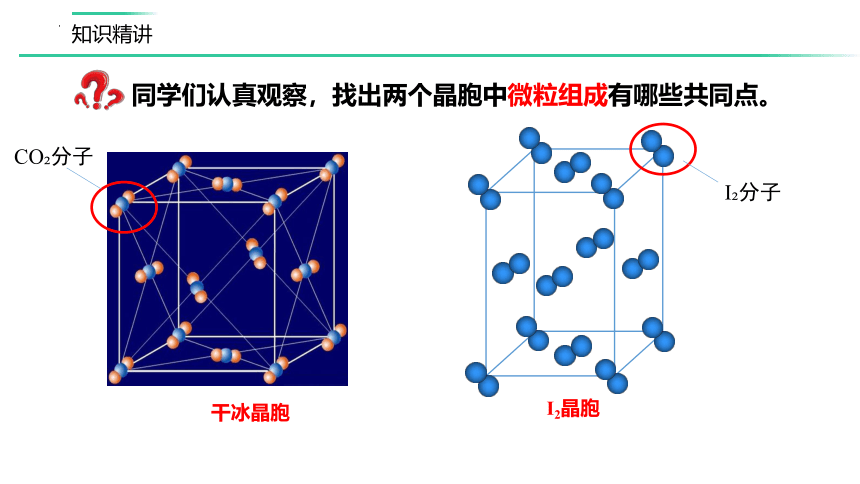
干冰晶胞
I2晶胞
同学们认真观察,找出两个晶胞中微粒组成有哪些共同点。
CO 分子
I 分子
内容内容内容
干冰
(CO2)
碘
(I2)
冰
(H2O)
一、分子晶体
只含分子的晶体叫做分子晶体
概念:
构成微粒:
分子
相互作用力:
分子内各原子之间:
分子间:
共价键
分子间作用力
氢键
范德华力
如:I2、H2O、CO2等在固态时都是分子晶体。
【注意】稀有气体是单原子分子,不含共价键
一、分子晶体
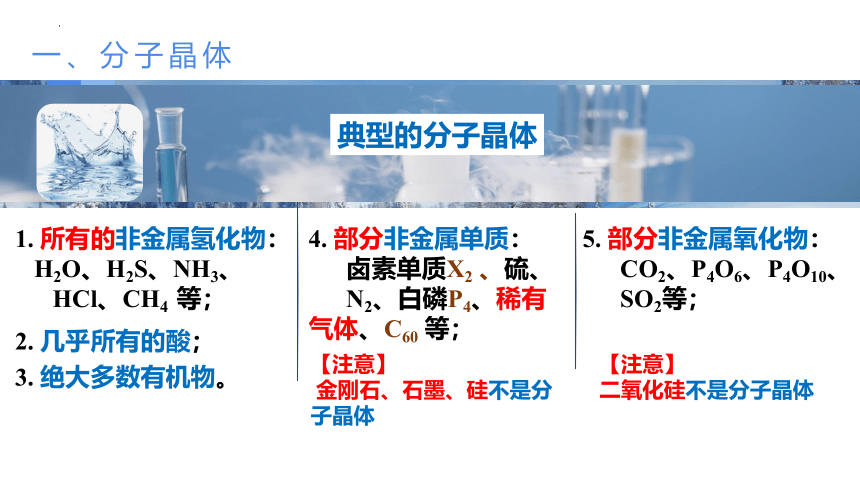
典型的分子晶体
1. 所有的非金属氢化物:
H2O、H2S、NH3、
HCl、CH4 等;
4. 部分非金属单质:
卤素单质X2 、硫、
N2、白磷P4、稀有气体、C60 等;
2. 几乎所有的酸;
3. 绝大多数有机物。
5. 部分非金属氧化物:
CO2、P4O6、P4O10、
SO2等;
【注意】
金刚石、石墨、硅不是分子晶体
【注意】
二氧化硅不是分子晶体
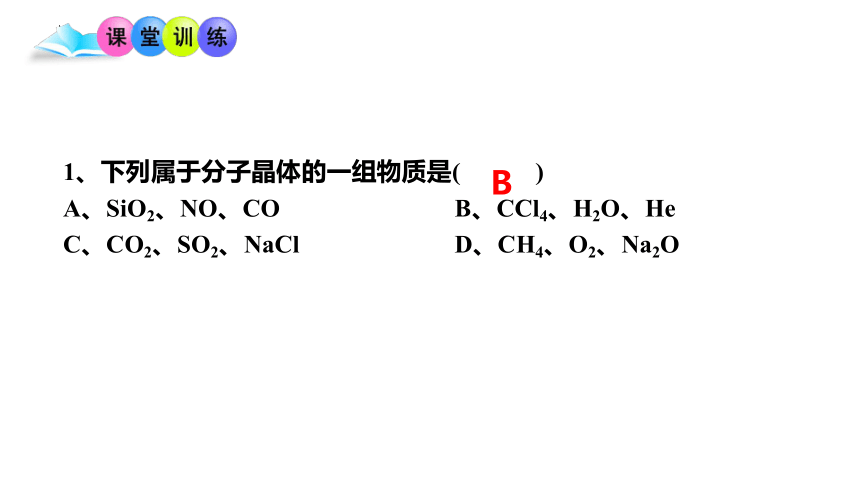
1、下列属于分子晶体的一组物质是( )
A、SiO2、NO、CO B、CCl4、H2O、He
C、CO2、SO2、NaCl D、CH4、O2、Na2O
B
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
硬度小
分子间作用力较弱,容易被克服
二、分子晶体的性质
二、分子晶体的性质
固体和熔融状态不导电
构成分子晶体的微粒是分子,没有产生自由移动的离子。
酒精
分子晶体一般是绝缘体,固体和熔融状态不导电
二、分子晶体的性质
请根据表中数据分析:分子晶体的熔点有什么特点?
熔点、沸点较低
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
分子晶体熔、沸点高低的判断
组成和结构相似,相对分子质量越大,范德华力越强,熔、沸点越高。
组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高。
含有分子间氢键的分子晶体的熔、沸点反常升高。
对于有机物中的同分异构体,支链越多,熔、沸点越低。
例如: >
例如:HI>HBr>HCl
例如:CO>Ar
例如:H2O>H2S
【归纳小结】
分子晶体的物理特性
1、熔点、沸点较低
2、硬度小
3、固体和熔融状态不导电
分子间的作用力—— 氢键、 范德华力
影响因素:
3.下列性质符合分子晶体特点的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度为0.97 g·cm-3
A.①④ B.②③ C.①② D.②④
B
√
√
2、下列有关分子晶体熔点高低的叙述中,正确的是( )
A、氯气>碘单质 B、四氯化硅>四氟化硅
C、NH3正戊烷
B
干冰 冰
熔点 -78.5℃ 0℃
密度 1.56g/cm3 0.92 g/cm
干冰和冰的熔点和密度
干冰的熔沸点比冰低、而密度比冰大这是为什么呢?
【思考与讨论1】
三、分子晶体的结构
粒子间的相互作用
干冰(CO2)
冰
(H2O)
只有范德华力
既有范德华力也有氢键
在分子晶体中,分子间的存在作用力不同会对其内部分子的排列产生什么影响呢?
干冰
(CO2)
冰
(H2O)
三、分子晶体的结构
三、分子晶体的性质
把晶胞中的每个CO2看成是一个质点
1
a
x
y
z
a
距离为a
距离小于a
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 ___ 个?
干冰
1
x
y
z
2
3
4
三、分子晶体的性质
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
12
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 ___ 个?
三、分子晶体的性质
分子密堆积
C60的晶胞
干冰晶胞
分子间作用力:
只是范德华力
以一个分子为中心,
其周围最多可以有12个紧邻的分子
三、分子晶体的性质
分子非密堆积
冰的结构
冰的结构
冰晶体中,每个水分子周围有多少个紧邻的水分子?
4个
和干冰晶体不一样的原因是什么?
水分子间存在氢键,
氢键具有方向性和饱和性
每个水分子都与4个相邻的水分子相互吸引
三、分子晶体的结构
01
分子密堆积
02
只有范德华力
既有范德华力也有氢键
干冰
(CO2)
冰
(H2O)
分子非密堆积
每个分子周围有12个紧邻的分子
周围紧邻的分子少于12个
三、分子晶体的结构
为什么干冰的熔沸点比冰低,而密度却比冰大?
由于干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,∴密度比冰的高。
冰存在分子间氢键,CO2之间只存在范德华力,∴ 干冰的熔沸点比冰低。
干冰:密堆积
冰:非密堆积
【思考与讨论1】
空间利用率低
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
融化前(冰):空隙较大的网状体
融化后(水):分子间的空隙减小
破坏了部分氢键
三、分子晶体的结构
0-4℃:温度升高,部分氢键断裂,分子间隙减小
超过4℃:温度升高,分子热运动加快,分子距离加大
0-4℃:密度随温度升高而增大
超过4℃:密度随温度升高而减小
三、分子晶体的结构
【归纳总结】
微粒间作用力
微粒堆积方式
举例
范德华力
范德华力和氢键
密堆积
非密堆积
C60、干冰、I2、O2
HF、NH3、冰
【思考与讨论2】
范德华力
范德华力和氢键
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S:分子间只有范德华力,无饱和性与方向性,形成分子密堆积。
冰:分子间存在氢键,具有方向性,形成分子非密堆积。
分子
晶体
冰
性质
熔点低
硬度小
不导电
分子
分子间作用力
影响因素
氢 键
范德华力
类型
分子密堆积
分子非密堆积
干冰、碘、C60
(每个分子周围有12个紧邻的分子)
【课堂小结】
P64 练一练
BD
P67 2-3
B
B
战
4、医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体
B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
THANKS
THANKS
感谢观看
分子晶体
选择性必修2 第三章 第二节
请判断下列固体是否属于晶体?并说明理由。
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
分子晶体
离子晶体
共价晶体
【思考与讨论】
干冰晶胞
I2晶胞
同学们认真观察,找出两个晶胞中微粒组成有哪些共同点。
CO 分子
I 分子
内容内容内容
干冰
(CO2)
碘
(I2)
冰
(H2O)
一、分子晶体
只含分子的晶体叫做分子晶体
概念:
构成微粒:
分子
相互作用力:
分子内各原子之间:
分子间:
共价键
分子间作用力
氢键
范德华力
如:I2、H2O、CO2等在固态时都是分子晶体。
【注意】稀有气体是单原子分子,不含共价键
一、分子晶体
典型的分子晶体
1. 所有的非金属氢化物:
H2O、H2S、NH3、
HCl、CH4 等;
4. 部分非金属单质:
卤素单质X2 、硫、
N2、白磷P4、稀有气体、C60 等;
2. 几乎所有的酸;
3. 绝大多数有机物。
5. 部分非金属氧化物:
CO2、P4O6、P4O10、
SO2等;
【注意】
金刚石、石墨、硅不是分子晶体
【注意】
二氧化硅不是分子晶体
1、下列属于分子晶体的一组物质是( )
A、SiO2、NO、CO B、CCl4、H2O、He
C、CO2、SO2、NaCl D、CH4、O2、Na2O
B
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
硬度小
分子间作用力较弱,容易被克服
二、分子晶体的性质
二、分子晶体的性质
固体和熔融状态不导电
构成分子晶体的微粒是分子,没有产生自由移动的离子。
酒精
分子晶体一般是绝缘体,固体和熔融状态不导电
二、分子晶体的性质
请根据表中数据分析:分子晶体的熔点有什么特点?
熔点、沸点较低
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔化时:一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
分子晶体熔、沸点高低的判断
组成和结构相似,相对分子质量越大,范德华力越强,熔、沸点越高。
组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高。
含有分子间氢键的分子晶体的熔、沸点反常升高。
对于有机物中的同分异构体,支链越多,熔、沸点越低。
例如: >
例如:HI>HBr>HCl
例如:CO>Ar
例如:H2O>H2S
【归纳小结】
分子晶体的物理特性
1、熔点、沸点较低
2、硬度小
3、固体和熔融状态不导电
分子间的作用力—— 氢键、 范德华力
影响因素:
3.下列性质符合分子晶体特点的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度为0.97 g·cm-3
A.①④ B.②③ C.①② D.②④
B
√
√
2、下列有关分子晶体熔点高低的叙述中,正确的是( )
A、氯气>碘单质 B、四氯化硅>四氟化硅
C、NH3
B
干冰 冰
熔点 -78.5℃ 0℃
密度 1.56g/cm3 0.92 g/cm
干冰和冰的熔点和密度
干冰的熔沸点比冰低、而密度比冰大这是为什么呢?
【思考与讨论1】
三、分子晶体的结构
粒子间的相互作用
干冰(CO2)
冰
(H2O)
只有范德华力
既有范德华力也有氢键
在分子晶体中,分子间的存在作用力不同会对其内部分子的排列产生什么影响呢?
干冰
(CO2)
冰
(H2O)
三、分子晶体的结构
三、分子晶体的性质
把晶胞中的每个CO2看成是一个质点
1
a
x
y
z
a
距离为a
距离小于a
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 ___ 个?
干冰
1
x
y
z
2
3
4
三、分子晶体的性质
x
y
z
1
2
3
4
5
6
7
8
9
10
11
12
12
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 ___ 个?
三、分子晶体的性质
分子密堆积
C60的晶胞
干冰晶胞
分子间作用力:
只是范德华力
以一个分子为中心,
其周围最多可以有12个紧邻的分子
三、分子晶体的性质
分子非密堆积
冰的结构
冰的结构
冰晶体中,每个水分子周围有多少个紧邻的水分子?
4个
和干冰晶体不一样的原因是什么?
水分子间存在氢键,
氢键具有方向性和饱和性
每个水分子都与4个相邻的水分子相互吸引
三、分子晶体的结构
01
分子密堆积
02
只有范德华力
既有范德华力也有氢键
干冰
(CO2)
冰
(H2O)
分子非密堆积
每个分子周围有12个紧邻的分子
周围紧邻的分子少于12个
三、分子晶体的结构
为什么干冰的熔沸点比冰低,而密度却比冰大?
由于干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,∴密度比冰的高。
冰存在分子间氢键,CO2之间只存在范德华力,∴ 干冰的熔沸点比冰低。
干冰:密堆积
冰:非密堆积
【思考与讨论1】
空间利用率低
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
融化前(冰):空隙较大的网状体
融化后(水):分子间的空隙减小
破坏了部分氢键
三、分子晶体的结构
0-4℃:温度升高,部分氢键断裂,分子间隙减小
超过4℃:温度升高,分子热运动加快,分子距离加大
0-4℃:密度随温度升高而增大
超过4℃:密度随温度升高而减小
三、分子晶体的结构
【归纳总结】
微粒间作用力
微粒堆积方式
举例
范德华力
范德华力和氢键
密堆积
非密堆积
C60、干冰、I2、O2
HF、NH3、冰
【思考与讨论2】
范德华力
范德华力和氢键
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S:分子间只有范德华力,无饱和性与方向性,形成分子密堆积。
冰:分子间存在氢键,具有方向性,形成分子非密堆积。
分子
晶体
冰
性质
熔点低
硬度小
不导电
分子
分子间作用力
影响因素
氢 键
范德华力
类型
分子密堆积
分子非密堆积
干冰、碘、C60
(每个分子周围有12个紧邻的分子)
【课堂小结】
P64 练一练
BD
P67 2-3
B
B
战
4、医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体
B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
THANKS
THANKS
感谢观看
