人教版(2019)选择性必修一 4.1 原电池 课件(共22张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 4.1 原电池 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 11:52:19 | ||
图片预览


文档简介
(共22张PPT)
探“电”奇旅
——原电池
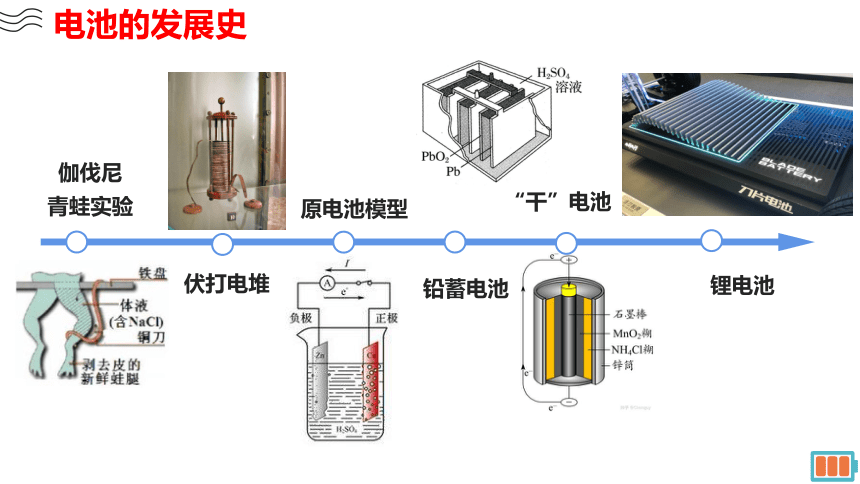
电池的发展史
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
锂电池
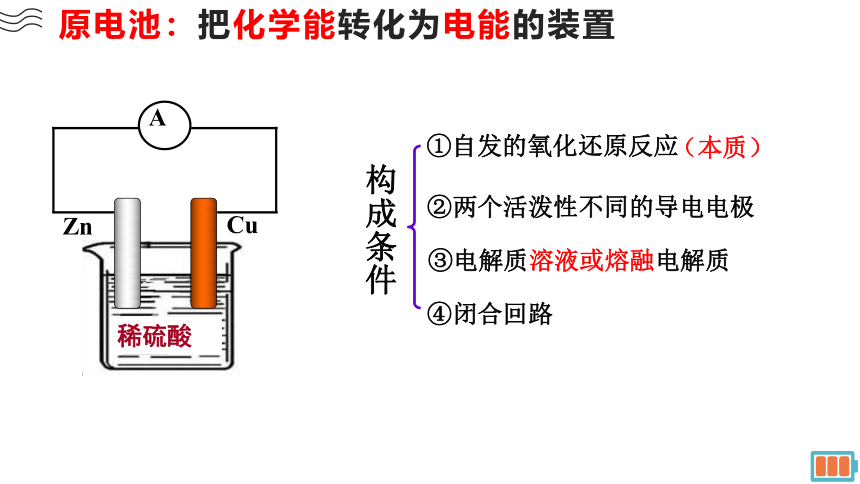
原电池:把化学能转化为电能的装置
稀硫酸
Cu
Zn
A
①自发的氧化还原反应
(本质)
②两个活泼性不同的导电电极
④闭合回路
③电解质溶液或熔融电解质
构成条件
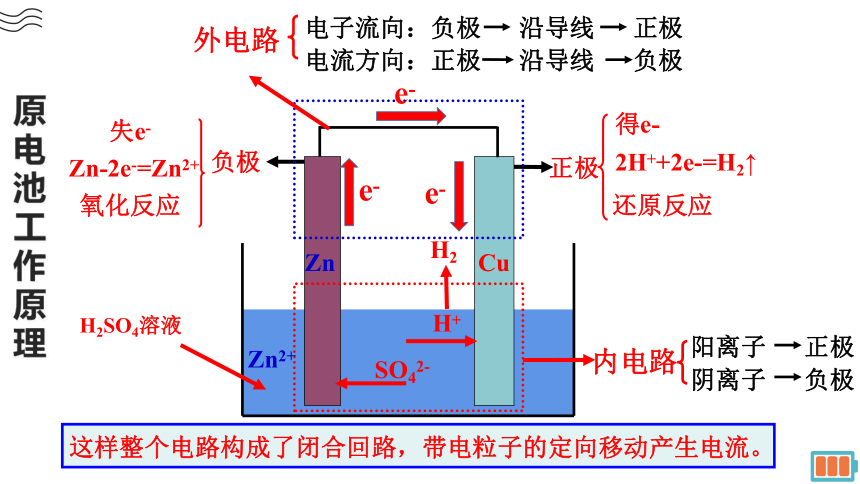
原电池工作原理
负极
氧化反应
失e-
正极
还原反应
得e-
H+
SO42-
外电路
内电路
e-
e-
e-
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流。
阴离子 负极
阳离子 正极
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn
Cu
Zn2+
H2SO4溶液
H2
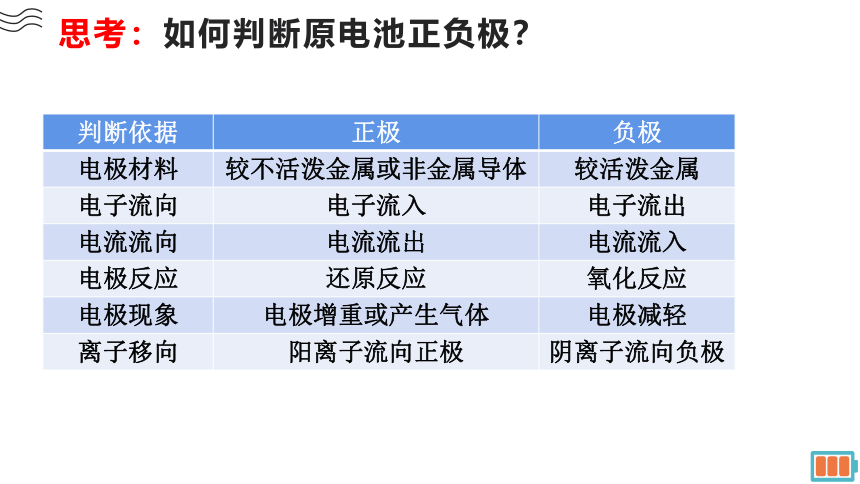
思考:如何判断原电池正负极?
判断依据 正极 负极
电极材料 较不活泼金属或非金属导体 较活泼金属
电子流向 电子流入 电子流出
电流流向 电流流出 电流流入
电极反应 还原反应 氧化反应
电极现象 电极增重或产生气体 电极减轻
离子移向 阳离子流向正极 阴离子流向负极
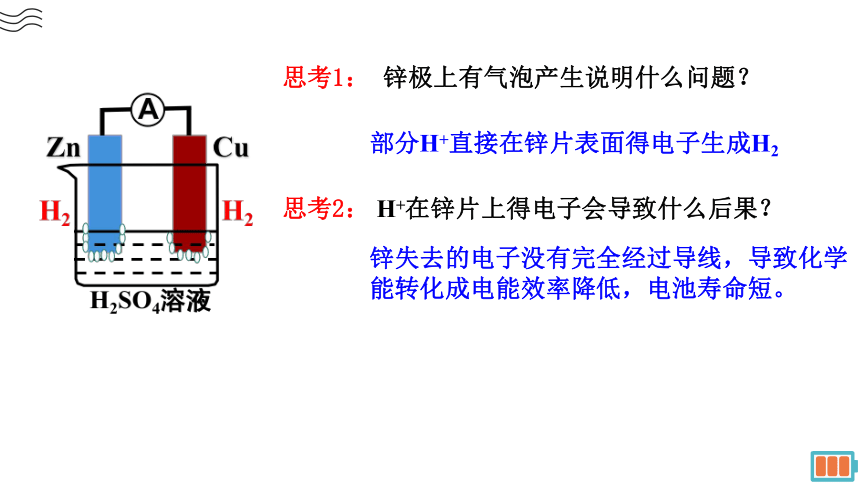
思考1: 锌极上有气泡产生说明什么问题?
思考2: H+在锌片上得电子会导致什么后果?
部分H+直接在锌片表面得电子生成H2
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,电池寿命短。
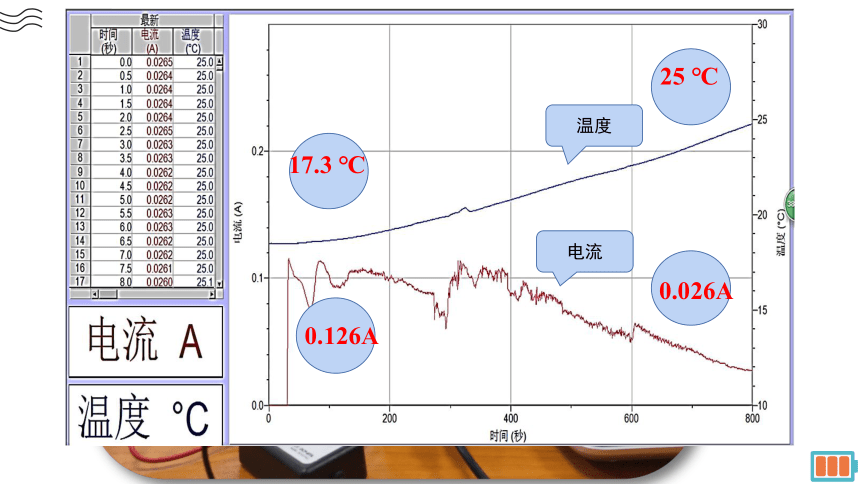
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
思考1: 锌极上有气泡产生说明什么问题?
思考2: H+在锌片上得电子会导致什么后果?
思考3:如何避免H+在锌片上得电子,提高原电池 能量转化效率
部分H+直接在锌片表面得电子生成H2
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,电池寿命短。
锌片不能伸入H2SO4溶液中
H2SO4溶液
Zn
Cu
A
Zn
A
ZnSO4溶液
H2SO4溶液
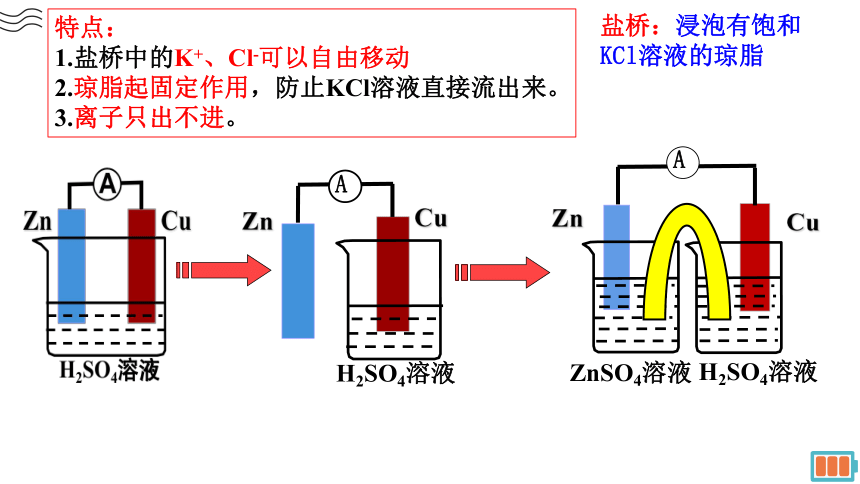
盐桥:浸泡有饱和KCl溶液的琼脂
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼脂起固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
Cu
单液
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
双液
温度
电流
17.3 ℃
0.007A
现象:能量转化率高,电流弱,但是比较稳定
2、阳离子交换膜:只允许阳离子通过
3、质子交换膜: 只允许H+通过
1、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
思考:根据电阻计算公式R=ρL/S,结合装置变化分析 双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
膜电池:能量转化率高,电流强,使用时间长
普通锌锰干电池
一次电池——干电池
牛皮纸
石墨棒
MnO2糊
NH4Cl糊
锌筒
锌筒
MnO2糊
石墨棒
NH4Cl糊
思考:一节更比六节强,为什么?
碱性锌锰干电池
总反应:2MnO2+2H2O+Zn=Zn(OH)2+2MnO(OH)
练习:书写正、负极电极反应式?
普通锌锰干电池
石墨棒
MnO2糊
NH4Cl糊
锌筒
(2022全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)42-存在)。 总反应式为Zn+4H++4OH-+MnO2=Zn(OH)42- +Mn2++2H2O
思考1:原电池装置中的Ⅱ池离子移动方向?
思考2:书写正、负极电极反应式
练习1
铅酸蓄电池:最早使用的充电电池。
优点:用途广、性能优良,造价低,可多次充放电
二次电池(充电电池)
缺点:比能量低,环境污染严重
比亚迪汽车公司设计的磷酸铁锂电池:充电一小时,续航500公里。
2019年诺贝尔化学奖获得者
比能量:参与电极反应的单位质量的电极材料放出电能的多少。理论上说,单位质量的电极材料转移的电子数目越多,比能量越大。
金属M可以是铁、镁、铝、钠、锂等。计算1g金属所转移的电子,比较其比能量的大小。
Li Al Mg Na Fe Zn …… Pb
燃料电池——氢氧燃料电池
碱性氢氧燃料电池
负极:2H2-4e-+4OH-=4H2O
正极:O2+4e-+2H2O=4OH-
酸性氢氧
燃料电池
负极:2H2-4e-=4H+
正极:O2+4e-+4H+=2H2O
总反应:2H2+O2=2H2O
练习3
固态氧化钇+氧化锆
有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e-= 2O2-
B.电池负极发生的反应:CH4+4O2--8e-= CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极流向负极)
D
电池的发展史
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
锂电池
燃料电池
海洋电池
浓差电池
微生物电池
铝离子电池
……
(安徽高考题)高密度储能电池锌溴电池如图所示,总反应为Zn+Br2=ZnBr2。下列说法错误的是
A.电极M为正极
B.负极的电极反应式为Zn-2e-=Zn2+
D.每转移2mole-,理论上有1mol Zn2+通过离子交换膜
C.随着放电的进行,ZnBr2溶液的浓度减小
C
探“电”奇旅
——原电池
电池的发展史
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
锂电池
原电池:把化学能转化为电能的装置
稀硫酸
Cu
Zn
A
①自发的氧化还原反应
(本质)
②两个活泼性不同的导电电极
④闭合回路
③电解质溶液或熔融电解质
构成条件
原电池工作原理
负极
氧化反应
失e-
正极
还原反应
得e-
H+
SO42-
外电路
内电路
e-
e-
e-
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流。
阴离子 负极
阳离子 正极
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn
Cu
Zn2+
H2SO4溶液
H2
思考:如何判断原电池正负极?
判断依据 正极 负极
电极材料 较不活泼金属或非金属导体 较活泼金属
电子流向 电子流入 电子流出
电流流向 电流流出 电流流入
电极反应 还原反应 氧化反应
电极现象 电极增重或产生气体 电极减轻
离子移向 阳离子流向正极 阴离子流向负极
思考1: 锌极上有气泡产生说明什么问题?
思考2: H+在锌片上得电子会导致什么后果?
部分H+直接在锌片表面得电子生成H2
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,电池寿命短。
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
思考1: 锌极上有气泡产生说明什么问题?
思考2: H+在锌片上得电子会导致什么后果?
思考3:如何避免H+在锌片上得电子,提高原电池 能量转化效率
部分H+直接在锌片表面得电子生成H2
锌失去的电子没有完全经过导线,导致化学能转化成电能效率降低,电池寿命短。
锌片不能伸入H2SO4溶液中
H2SO4溶液
Zn
Cu
A
Zn
A
ZnSO4溶液
H2SO4溶液
盐桥:浸泡有饱和KCl溶液的琼脂
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼脂起固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
Cu
单液
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
双液
温度
电流
17.3 ℃
0.007A
现象:能量转化率高,电流弱,但是比较稳定
2、阳离子交换膜:只允许阳离子通过
3、质子交换膜: 只允许H+通过
1、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
思考:根据电阻计算公式R=ρL/S,结合装置变化分析 双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
膜电池:能量转化率高,电流强,使用时间长
普通锌锰干电池
一次电池——干电池
牛皮纸
石墨棒
MnO2糊
NH4Cl糊
锌筒
锌筒
MnO2糊
石墨棒
NH4Cl糊
思考:一节更比六节强,为什么?
碱性锌锰干电池
总反应:2MnO2+2H2O+Zn=Zn(OH)2+2MnO(OH)
练习:书写正、负极电极反应式?
普通锌锰干电池
石墨棒
MnO2糊
NH4Cl糊
锌筒
(2022全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)42-存在)。 总反应式为Zn+4H++4OH-+MnO2=Zn(OH)42- +Mn2++2H2O
思考1:原电池装置中的Ⅱ池离子移动方向?
思考2:书写正、负极电极反应式
练习1
铅酸蓄电池:最早使用的充电电池。
优点:用途广、性能优良,造价低,可多次充放电
二次电池(充电电池)
缺点:比能量低,环境污染严重
比亚迪汽车公司设计的磷酸铁锂电池:充电一小时,续航500公里。
2019年诺贝尔化学奖获得者
比能量:参与电极反应的单位质量的电极材料放出电能的多少。理论上说,单位质量的电极材料转移的电子数目越多,比能量越大。
金属M可以是铁、镁、铝、钠、锂等。计算1g金属所转移的电子,比较其比能量的大小。
Li Al Mg Na Fe Zn …… Pb
燃料电池——氢氧燃料电池
碱性氢氧燃料电池
负极:2H2-4e-+4OH-=4H2O
正极:O2+4e-+2H2O=4OH-
酸性氢氧
燃料电池
负极:2H2-4e-=4H+
正极:O2+4e-+4H+=2H2O
总反应:2H2+O2=2H2O
练习3
固态氧化钇+氧化锆
有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e-= 2O2-
B.电池负极发生的反应:CH4+4O2--8e-= CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极流向负极)
D
电池的发展史
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
锂电池
燃料电池
海洋电池
浓差电池
微生物电池
铝离子电池
……
(安徽高考题)高密度储能电池锌溴电池如图所示,总反应为Zn+Br2=ZnBr2。下列说法错误的是
A.电极M为正极
B.负极的电极反应式为Zn-2e-=Zn2+
D.每转移2mole-,理论上有1mol Zn2+通过离子交换膜
C.随着放电的进行,ZnBr2溶液的浓度减小
C
