江西省宜春市樟树市三校2022-2023学年高二下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 江西省宜春市樟树市三校2022-2023学年高二下学期5月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 11:51:27 | ||
图片预览



文档简介
樟树市三校2022-2023学年高二下学期5月期中考试
化学
一.单选题(每小题3分,共30分)
1.《神农本草经》中记载白矾的主要成分为。下列说法错误的是(▲)
A.离子半径: B.碱性:
C.热稳定性: D.第一电离能:
2.三氯蔗糖(C11H15O8Cl3)具有热值极低、安全性好等优点,可供糖尿病患者少量食用,被认为是近乎完美的甜味剂,下列说法正确的是(▲)
A.基态氧原子的核外电子排布式为[Ne]2s22p4
B.氯原子的结构示意图为
C.O2与O3互为同位素
D.中子数为8的碳原子:C
3.下列Be原子轨道表示式的状态中,能量最高的是(▲)
A. B.
C. D.
4.某中德联合研究小组制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是(▲)
A.“水瓶”是纯净物 B.水分子空间构型是V型
C.C60是极性分子 D.富勒烯与石墨是同位素
5.完全燃烧1.00 g某有机化合物,生成3.08 g CO2和1.44gH2O。质谱法测得其相对分子质量为100,下列说法正确的是(▲)
A.该有机物中可能含有氧元素
B.该有机物中C、H原子个数比为7:8
C.该有机物主链有5个碳原子的结构有5种
D.该有机物可以发生取代反应,也可以发生加成反应
6.有机化合物X是一种姜黄素类似物,其结构简式如图所示。下列关于X的说法错误的是(▲)
A.含醚键、酚羟基和酮羰基三种含氧官能团 B.所有碳原子可能共平面
C.苯环上的一氯代物有6种(不包含立体异构) D.能与发生显色反应
7.芴基多孔芳香骨架(PAFs)具有较大的微孔体积、较高的比表面积,使其具有良好的氧化还原活性和电化学性能,PAFs可用TCN-1制备,TCN-1的结构简式如图。下列说法正确的是(▲)
A.TCN-1的分子式为 B.1molTCN-1最多可与18mol发生加成反应
C.TCN-1可以与氢氧化钠发生反应 D.TCN-1分子中不含有手性碳原子
8.“点击化学”是一种简单、高效、可控和快捷的合成方法。已知“点击化学”中的一个经典反应如图所示,该反应具有快速、条件温和、对水分不敏感的特性,使其在固体推进剂中具有广阔的应用前景。下列说法中错误的是(▲)
A.该反应为加成反应
B.N3-C6H13属于极性分子
C.上述反应所涉及的物质均为纯净物
D.上述反应所涉及的物质中,C原子的杂化类型为sp、sp2、sp3
9.利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“”表示)分离和的过程如图2所示。下列说法不正确的是(▲)
A.与结构相似,由于键的键长小于键,所以的熔、沸点低于
B.该流程体现了超分子具有“分子识别”的特征
C.,互为同素异形体
D.杯酚中所有原子不可能位于同一平面
10.某水性钠离子电池电极材料由、、、组成,随着立方晶胞嵌入和嵌出,与含量发生变化,依次为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是(▲)
A.基态Fe原子的价电子排布式为,失去4s电子转化为
B.导电能力普鲁士蓝小于普鲁士白
C.普鲁士蓝中与个数比为1:2
D.普鲁士白的化学式可表示为
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.能与悬浮在大气中的海盐粒子作用,反应为(CINO各原子均达到8电子稳定结构)。下列说法正确的是(▲)
A.晶体属于分子晶体 B.ClNO的结构式为
C.NaCl晶胞中的配位数为6 D.是由极性键构成的非极性分子
12.一种钴的氧化物在纳米储能领域研究广泛,其晶胞结构如图所示(白球为Co,黑球为O),已知该晶胞参数为,阿伏加德罗常数为。下列说法错误的是(▲)
A.该晶体的化学式为CoO
B.基态Co原子有2个未成对电子
C.与O原子最近且等距离的O原子有12个
D.氧化物的摩尔体积
13.下列实验现象与实验操作不匹配的是(▲)
实验操作 实验现象
A 已知[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O △H>0,[CuCl4]2-为黄绿色,将盛有2mL0.5mol L-1CuCl2溶液的试管加热 溶液变为蓝色
B 将绕成螺旋状的铜丝伸入到盛有浓硝酸的试管中 铜丝溶解,溶液变为蓝色,生成红棕色气体
C 向盛有4.0mL0.1mol L-1CuSO4溶液的试管里逐滴滴加氨水至过量 先产生蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液
D 用玻璃棒摩擦装有过饱和醋酸钠溶液的试管内壁 有晶体析出
A.A B.B C.C D.D
14.中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎患者有确切的疗效。其有效成分绿原酸的结构简式如图所示,下列有关绿原酸说法正确的是(▲)
A.所有碳原子均可能共平面
B.与足量H2加成的产物中含有7个手性碳原子
C.1mol绿原酸可消耗5molNaOH
D.能发生酯化、加成、消去、还原反应
15.一种生产聚苯乙烯的流程如下:
下列叙述不正确的是(▲)
A.反应①属于加成反应
B.1 mol苯乙烯最多可与4 mol Br2发生加成
C.鉴别苯与苯乙烯可用KMnO4酸性溶液
D.苯、苯乙烯和聚苯乙烯分子中所有原子不可能都处于同一平面
三、填空题(共50分)
16.(12分)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯()与四氟乙烯()的共聚物()制成。回答下列问题:
(1)基态原子的价电子排布图(轨道表示式)为 ▲ ;下列表示氟原子激发态的电子排布式有 ▲ ,其中能量较高的是 ▲ 。(填标号)
a. B. C. D.
(2)图、、分别表示、、和的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是 ▲ 填标号);第三电离能的变化图是 ▲ (填标号)。
(3)试写出的结构简式 ▲ ;中所含元素电负性由大到小的顺序是 ▲ 。
(4)和分子中的杂化轨道类型分别为 ▲ 和 ▲ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因 ▲ 。
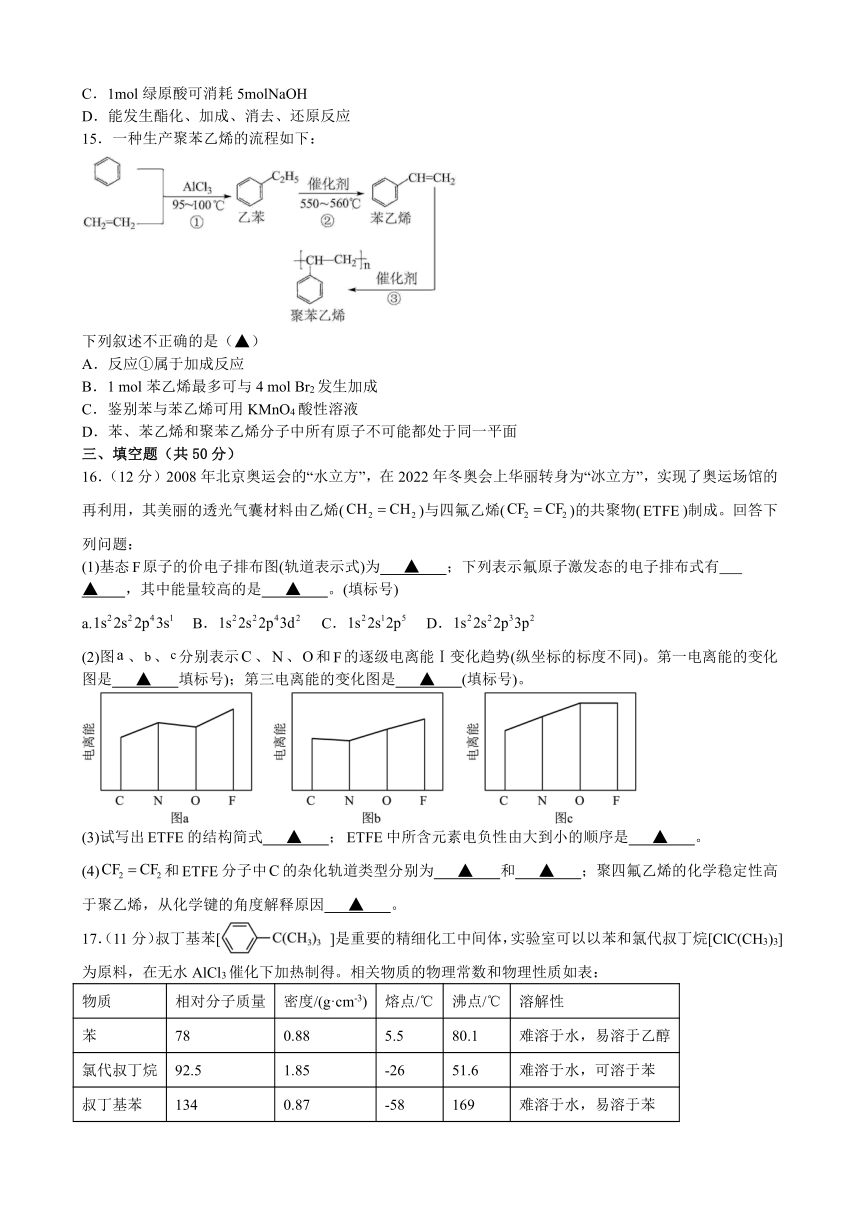
17.(11分)叔丁基苯[ ]是重要的精细化工中间体,实验室可以以苯和氯代叔丁烷[ClC(CH3)3]为原料,在无水AlCl3催化下加热制得。相关物质的物理常数和物理性质如表:
物质 相对分子质量 密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
苯 78 0.88 5.5 80.1 难溶于水,易溶于乙醇
氯代叔丁烷 92.5 1.85 -26 51.6 难溶于水,可溶于苯
叔丁基苯 134 0.87 -58 169 难溶于水,易溶于苯
叔丁基苯的制取原理为:
实验室制取叔丁基苯的装置如图所示(加热和夹持仪器略去)
实验步骤:
在三口烧瓶中加入120 mL的苯和适量无水AlCl3,由恒压滴液漏斗滴加氯代叔丁烷15 mL,控制温度反应一段时间。将反应后的混合物依次用稀盐酸、2% Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静置、过滤,先常压蒸馏,再减压蒸馏收集馏分,得叔丁基苯30 g。
(1)仪器a的名称为 ▲ ,其作用是 ▲ 。
(2)洗涤操作中,水洗的目的是 ▲ ;无水硫酸镁的作用是 ▲ 。
(3)常压蒸馏时,最低控制温度为 ▲ ℃。在蒸馏纯化的过程中,下列说法错误的是 ▲ 。
a.加热一段时间后发现忘加碎瓷片,应在冷却后补加
b.蒸馏烧瓶中液体的量是烧瓶容量的~
c.冷却水的方向是上进下出,保证冷却水快速流动
(4)该实验中叔丁基苯的产率为 ▲ 。(小数点后保留两位数字)
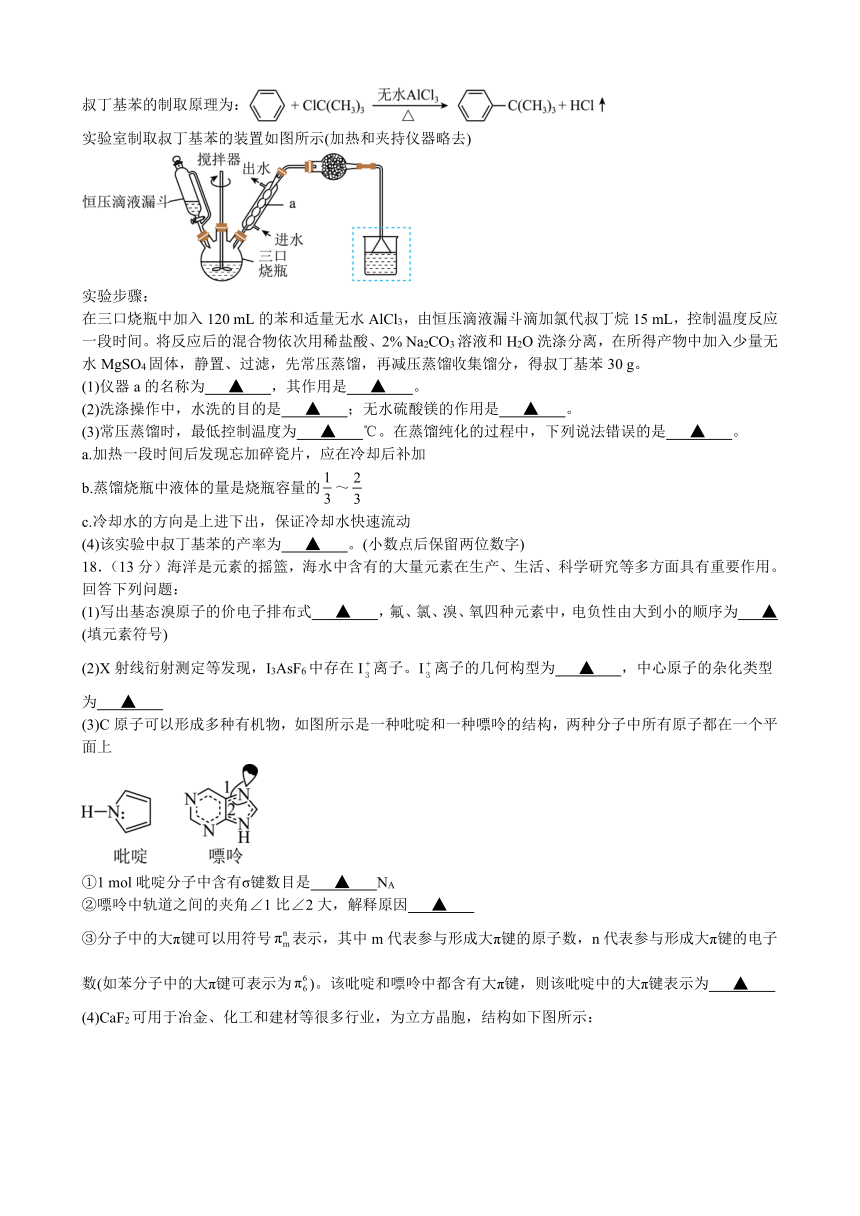
18.(13分)海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题:
(1)写出基态溴原子的价电子排布式 ▲ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为 ▲ (填元素符号)
(2)X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为 ▲ ,中心原子的杂化类型为 ▲
(3)C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上
①1 mol吡啶分子中含有σ键数目是 ▲ NA
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因 ▲
③分子中的大π键可以用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为 ▲
(4)CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
①“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( ▲ , ▲ ,), ▲
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为 ▲ g·cm-3 (列出计算式即可)
19.(14分)阿司匹林是非甾体抗炎药、抗血小板聚集药,具有缓解疼痛、抑制血栓形成等作用。一种长效、缓释阿司匹林H的合成路线如图所示。请回答下列问题:
(1)有机物A的名称是 ▲ ,C→D的反应类型为 ▲ 。
(2)F中含有的官能团名称为 ▲ ,G的结构简式为 ▲ 。
(3)由上述反应过程可推断A→B的作用为 ▲ 。
(4)请写出D→F的化学方程式: ▲ 。
(5)芳香族化合物M比A的分子组成多1个,且能与Na反应放出,则M的结构有 ▲ 种(不考虑立体异构),请写出满足下列条件的M的结构简式: ▲ 。
①能与溶液发生显色反应
②核磁共振氢谱显示4组峰,且峰面积之比为
1.C
A.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;离子半径:r(Al3+)B.同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性逐渐减弱;根据金属性越强,最高价氧化物对应水化物的碱性越强,碱性:KOH>Al(OH)3,B正确;
C.据非金属性越强,其简单氢化物稳定性越强,则最简单氢化物的稳定性:H2SD.同一主族随原子序数变大,原子半径变大,第一电离能变小;第一电离能:I1(S)故选C。
2.D
A.O原子核外有8个电子,基态氧原子的核外电子排布式为1s22s22p4或[He]2s22p4,A错误;
B.氯原子的结构示意图为,B错误;
C.O2与O3均为氧的单质,互为同素异形体,C错误;
D.C的质子数为6,则中子数为8的碳原子:C,D正确;
故选D。
3.C
2p轨道上电子的能量大于2s轨道大于1s轨道,则能量高的轨道上的电子数量越多,该原子的能量越高,因此C选项状态下,Be原子的能量最高,故答案选C。
4.B
A.“水瓶”中存在富勒烯(C60)、磷酸盐和水分子,所以是混合物,A错误;
B.水分子中中心原子的价层电子对是4,2个孤电子对,所以空间构型是V型,B正确;
C.C60是由非极性键构成的非极性分子,C错误;
D.富勒烯与石墨是同种元素构成的不同单质互为同素异形体,D错误;
故选B。
5.C
A.根据分析可知,该有机物中一定没有氧元素,A错误;
B.该有机物中C、H原子个数比为7:16,B错误;
C.该有机物分子式为C7H16,主链有5个碳原子的结构有、、、、这5种,C正确;
D.该有机物分子式为C7H16,为饱和烷烃,能发生取代反应但不能发生加成反应,D错误;
故答案选C。
6.C
A.由题给X的结构简式可知,该物质结构中含醚键、酚羟基和酮羰基三种含氧官能团,故A正确;
B.该分子中存在碳碳双键、羰基、苯环决定的平面结构,单键可以旋转,所有碳原子可能共平面,故B正确;
C.该分子结构对称,所以苯环上的一氯代物有3种,故C错误;
D.该物质结构中含酚羟基,能与发生显色反应,故D正确;
选C。
7.D
A.由图可知,TCN-1的分子式为,A错误;
B.由结构可知,分子中不饱和碳环能和氢气加成,1molTCN-1最多可与15mol发生加成反应,B错误;
C.TCN-1中含有羟基,不可以与氢氧化钠发生反应,C错误;
D.手性碳原子是连有四个不同基团的碳原子,该碳原子连接有3个相同的基团,故TCN-1分子中不含有手性碳原子,D正确;
故选D。
8.C
A.对比反应物和产物,可知碳碳三键断开与C6H13-N3发生了加成反应,A正确;
B.N3-C6H13结构不对称,属于极性分子,B正确;
C.反应物中的高分子化合物是混合物,C错误;
D.碳碳三键中C原子杂化方式为sp杂化,碳氧双键中C原子杂化方式为sp2杂化,-CH2-中C原子杂化方式为sp3杂化,D正确;
故选C。
9.A
A.与的结构相似,相对分子质量比大,其分子间的作用力大,物质的熔沸点就越高,与分子内化学键的键长无关,A错误;
B.由图可知,杯酚与形成超分子,而杯酚与不能形成超分子,反映了超分子具有“分子识别”的特性,B正确;
C.、为同一种元素形成的结构不同的单质,互为同素异形体,C正确;
D.杯酚分子中含有饱和碳原子,饱和碳原子与其相连的4个原子形成四面体结构,所有原子不可能位于同一平面内,D正确;
故选A。
10.C
A.Fe的原子序数为26,价电子排布式为:,失去2个电子后,转化为Fe2+,A正确;
B.Na+嵌入越多,导电性越好,根据晶胞结构可判断,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以导电能力普鲁士蓝小于普鲁士白,B正确;
C.普鲁士蓝晶胞一个小立方体中个数、Fe原子个数、个数,所以其原子个数比为1:2:6,化学式为,为价、的化合价为价,该化学式中Fe元素化合价为,与个数比为1:1,C错误;
D.普鲁士白晶胞中1个晶胞含有的Na+为8个,Fe原子个数,个数,化学式可表示为,D正确;
故选C。
11.BC
A.晶体属于离子晶体,故A错误;
B.ClNO各原子均达到8电子稳定结构则,O原子要连两根共价键,N原子要连三根共价键,Cl原子要连一根共价键,结构式为,故B正确;
C. 配位数指的是某个离子周围的异种电荷的离子数,NaCl中Na+周围的Cl-是6个,配位数为6,故C正确;
D.是由极性键构成的极性分子,故D错误;
故选BC。
12.BD
A.根据均摊法,晶胞中有4个Co,4个O,化学式为CoO,A正确;
B.基态Co原子的价电子排布式为,其价电子排布图为 ,有3个未成对电子,B错误;
C.根据图示结构结合几何关系可知,与O原子最近且等距离的O原子有12个,且距离为,C正确;
D.1mol晶胞中含有4molCoO,该氧化物的摩尔体积为,D错误;
故答案选BD。
13.AB
A.已知[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O △H>0,[CuCl4]2-为黄绿色,将盛有2mL0.5mol L-1CuCl2溶液的试管加热,该反应是吸热反应,升高温度,平衡正向移动,[Cu(H2O)4]2+转化为[CuCl4]2-,溶液变成黄绿色,故A错误;
B.将铜丝插入浓硝酸中,铜与浓硝酸发生剧烈反应,有红棕色气体NO2产生,溶液呈绿色,故B错误;
C.向盛有4.0mL0.1mol L-1CuSO4溶液的试管里逐滴滴加氨水至过量,先产生Cu(OH)2蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液,故C正确;
D.用玻璃棒在容器内壁轻轻摩擦可以从容器内壁刮下少量碎屑充当晶核,过饱和溶液可迅速完成结晶过程,析出晶体,故D正确;
故选AB。
14.BD
A.苯环、碳碳双键、酯基都为平面形结构,与苯环、碳碳双键直接相连的原子在同一个平面上,且C—C键可自由旋转,则最多有10个碳原子共面,故A错误;
B.与足量H2加成,苯环变为环,碳碳双键变成单键,产物中含有7个手性碳原子,故B正确;
C.1mol绿原酸含有2mol酚羟基、1mol酯基、1mol羧基,可消耗4molNaOH,故C错误;
D.含有羧基,能发生酯化反应,含有碳碳双键,可发生加成、还原反应,与醇羟基相连的碳原子上有H,能发生消去反应,故D正确;
故选BD。
15.D
A.反应①是苯和乙烯生成乙苯,乙基是饱和的基团,则反应①属于加成反应,故A正确;
B.苯乙烯的结构中,1个苯环可与3个溴分子发生加成反应,1个乙烯基能够与1个溴分子发生加成反应,因此1 mol苯乙烯与溴发生加成反应,最多消耗4 mol Br2,故B正确;
C.苯与KMnO4酸性溶液不反应,但苯乙烯结构中含有碳碳双键,可以使KMnO4酸性溶液褪色,故C正确;
D.苯分子中所有原子是同一平面的,乙烯分子所有原子是同一平面的,则苯乙烯分子中的原子则可能会处于同一平面,则聚苯乙烯分子中的原子也可能处于同一平面,故D错误;
本题答案D。
16.(1) ad d
(2)a b
(3)
(4)sp2 sp3 C-F键的键能大于C-H键的键能
17.(1)球形冷凝管 冷凝回流苯和氯代叔丁烷等物质
(2)洗掉Na2CO3等(或洗掉可溶性无机物) 吸水(或干燥)
(3)80.1℃ c
(4)74.63%
18.(1)4s24p5 F>O>Cl>Br
(2)V形 sp3
(3)10 孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,斥力大
(4)(,,)
19.(1)邻甲基苯酚或2—甲基苯酚 取代反应
(2)酯基、羧基
(3)保护酚羟基不被酸性高锰酸钾溶液氧化
(4)++ CH3COOH
(5)14 、
化学
一.单选题(每小题3分,共30分)
1.《神农本草经》中记载白矾的主要成分为。下列说法错误的是(▲)
A.离子半径: B.碱性:
C.热稳定性: D.第一电离能:
2.三氯蔗糖(C11H15O8Cl3)具有热值极低、安全性好等优点,可供糖尿病患者少量食用,被认为是近乎完美的甜味剂,下列说法正确的是(▲)
A.基态氧原子的核外电子排布式为[Ne]2s22p4
B.氯原子的结构示意图为
C.O2与O3互为同位素
D.中子数为8的碳原子:C
3.下列Be原子轨道表示式的状态中,能量最高的是(▲)
A. B.
C. D.
4.某中德联合研究小组制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是(▲)
A.“水瓶”是纯净物 B.水分子空间构型是V型
C.C60是极性分子 D.富勒烯与石墨是同位素
5.完全燃烧1.00 g某有机化合物,生成3.08 g CO2和1.44gH2O。质谱法测得其相对分子质量为100,下列说法正确的是(▲)
A.该有机物中可能含有氧元素
B.该有机物中C、H原子个数比为7:8
C.该有机物主链有5个碳原子的结构有5种
D.该有机物可以发生取代反应,也可以发生加成反应
6.有机化合物X是一种姜黄素类似物,其结构简式如图所示。下列关于X的说法错误的是(▲)
A.含醚键、酚羟基和酮羰基三种含氧官能团 B.所有碳原子可能共平面
C.苯环上的一氯代物有6种(不包含立体异构) D.能与发生显色反应
7.芴基多孔芳香骨架(PAFs)具有较大的微孔体积、较高的比表面积,使其具有良好的氧化还原活性和电化学性能,PAFs可用TCN-1制备,TCN-1的结构简式如图。下列说法正确的是(▲)
A.TCN-1的分子式为 B.1molTCN-1最多可与18mol发生加成反应
C.TCN-1可以与氢氧化钠发生反应 D.TCN-1分子中不含有手性碳原子
8.“点击化学”是一种简单、高效、可控和快捷的合成方法。已知“点击化学”中的一个经典反应如图所示,该反应具有快速、条件温和、对水分不敏感的特性,使其在固体推进剂中具有广阔的应用前景。下列说法中错误的是(▲)
A.该反应为加成反应
B.N3-C6H13属于极性分子
C.上述反应所涉及的物质均为纯净物
D.上述反应所涉及的物质中,C原子的杂化类型为sp、sp2、sp3
9.利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“”表示)分离和的过程如图2所示。下列说法不正确的是(▲)
A.与结构相似,由于键的键长小于键,所以的熔、沸点低于
B.该流程体现了超分子具有“分子识别”的特征
C.,互为同素异形体
D.杯酚中所有原子不可能位于同一平面
10.某水性钠离子电池电极材料由、、、组成,随着立方晶胞嵌入和嵌出,与含量发生变化,依次为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是(▲)
A.基态Fe原子的价电子排布式为,失去4s电子转化为
B.导电能力普鲁士蓝小于普鲁士白
C.普鲁士蓝中与个数比为1:2
D.普鲁士白的化学式可表示为
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.能与悬浮在大气中的海盐粒子作用,反应为(CINO各原子均达到8电子稳定结构)。下列说法正确的是(▲)
A.晶体属于分子晶体 B.ClNO的结构式为
C.NaCl晶胞中的配位数为6 D.是由极性键构成的非极性分子
12.一种钴的氧化物在纳米储能领域研究广泛,其晶胞结构如图所示(白球为Co,黑球为O),已知该晶胞参数为,阿伏加德罗常数为。下列说法错误的是(▲)
A.该晶体的化学式为CoO
B.基态Co原子有2个未成对电子
C.与O原子最近且等距离的O原子有12个
D.氧化物的摩尔体积
13.下列实验现象与实验操作不匹配的是(▲)
实验操作 实验现象
A 已知[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O △H>0,[CuCl4]2-为黄绿色,将盛有2mL0.5mol L-1CuCl2溶液的试管加热 溶液变为蓝色
B 将绕成螺旋状的铜丝伸入到盛有浓硝酸的试管中 铜丝溶解,溶液变为蓝色,生成红棕色气体
C 向盛有4.0mL0.1mol L-1CuSO4溶液的试管里逐滴滴加氨水至过量 先产生蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液
D 用玻璃棒摩擦装有过饱和醋酸钠溶液的试管内壁 有晶体析出
A.A B.B C.C D.D
14.中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎患者有确切的疗效。其有效成分绿原酸的结构简式如图所示,下列有关绿原酸说法正确的是(▲)
A.所有碳原子均可能共平面
B.与足量H2加成的产物中含有7个手性碳原子
C.1mol绿原酸可消耗5molNaOH
D.能发生酯化、加成、消去、还原反应
15.一种生产聚苯乙烯的流程如下:
下列叙述不正确的是(▲)
A.反应①属于加成反应
B.1 mol苯乙烯最多可与4 mol Br2发生加成
C.鉴别苯与苯乙烯可用KMnO4酸性溶液
D.苯、苯乙烯和聚苯乙烯分子中所有原子不可能都处于同一平面
三、填空题(共50分)
16.(12分)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯()与四氟乙烯()的共聚物()制成。回答下列问题:
(1)基态原子的价电子排布图(轨道表示式)为 ▲ ;下列表示氟原子激发态的电子排布式有 ▲ ,其中能量较高的是 ▲ 。(填标号)
a. B. C. D.
(2)图、、分别表示、、和的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是 ▲ 填标号);第三电离能的变化图是 ▲ (填标号)。
(3)试写出的结构简式 ▲ ;中所含元素电负性由大到小的顺序是 ▲ 。
(4)和分子中的杂化轨道类型分别为 ▲ 和 ▲ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因 ▲ 。
17.(11分)叔丁基苯[ ]是重要的精细化工中间体,实验室可以以苯和氯代叔丁烷[ClC(CH3)3]为原料,在无水AlCl3催化下加热制得。相关物质的物理常数和物理性质如表:
物质 相对分子质量 密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
苯 78 0.88 5.5 80.1 难溶于水,易溶于乙醇
氯代叔丁烷 92.5 1.85 -26 51.6 难溶于水,可溶于苯
叔丁基苯 134 0.87 -58 169 难溶于水,易溶于苯
叔丁基苯的制取原理为:
实验室制取叔丁基苯的装置如图所示(加热和夹持仪器略去)
实验步骤:
在三口烧瓶中加入120 mL的苯和适量无水AlCl3,由恒压滴液漏斗滴加氯代叔丁烷15 mL,控制温度反应一段时间。将反应后的混合物依次用稀盐酸、2% Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静置、过滤,先常压蒸馏,再减压蒸馏收集馏分,得叔丁基苯30 g。
(1)仪器a的名称为 ▲ ,其作用是 ▲ 。
(2)洗涤操作中,水洗的目的是 ▲ ;无水硫酸镁的作用是 ▲ 。
(3)常压蒸馏时,最低控制温度为 ▲ ℃。在蒸馏纯化的过程中,下列说法错误的是 ▲ 。
a.加热一段时间后发现忘加碎瓷片,应在冷却后补加
b.蒸馏烧瓶中液体的量是烧瓶容量的~
c.冷却水的方向是上进下出,保证冷却水快速流动
(4)该实验中叔丁基苯的产率为 ▲ 。(小数点后保留两位数字)
18.(13分)海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题:
(1)写出基态溴原子的价电子排布式 ▲ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为 ▲ (填元素符号)
(2)X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为 ▲ ,中心原子的杂化类型为 ▲
(3)C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上
①1 mol吡啶分子中含有σ键数目是 ▲ NA
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因 ▲
③分子中的大π键可以用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为 ▲
(4)CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
①“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( ▲ , ▲ ,), ▲
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为 ▲ g·cm-3 (列出计算式即可)
19.(14分)阿司匹林是非甾体抗炎药、抗血小板聚集药,具有缓解疼痛、抑制血栓形成等作用。一种长效、缓释阿司匹林H的合成路线如图所示。请回答下列问题:
(1)有机物A的名称是 ▲ ,C→D的反应类型为 ▲ 。
(2)F中含有的官能团名称为 ▲ ,G的结构简式为 ▲ 。
(3)由上述反应过程可推断A→B的作用为 ▲ 。
(4)请写出D→F的化学方程式: ▲ 。
(5)芳香族化合物M比A的分子组成多1个,且能与Na反应放出,则M的结构有 ▲ 种(不考虑立体异构),请写出满足下列条件的M的结构简式: ▲ 。
①能与溶液发生显色反应
②核磁共振氢谱显示4组峰,且峰面积之比为
1.C
A.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;离子半径:r(Al3+)
C.据非金属性越强,其简单氢化物稳定性越强,则最简单氢化物的稳定性:H2S
2.D
A.O原子核外有8个电子,基态氧原子的核外电子排布式为1s22s22p4或[He]2s22p4,A错误;
B.氯原子的结构示意图为,B错误;
C.O2与O3均为氧的单质,互为同素异形体,C错误;
D.C的质子数为6,则中子数为8的碳原子:C,D正确;
故选D。
3.C
2p轨道上电子的能量大于2s轨道大于1s轨道,则能量高的轨道上的电子数量越多,该原子的能量越高,因此C选项状态下,Be原子的能量最高,故答案选C。
4.B
A.“水瓶”中存在富勒烯(C60)、磷酸盐和水分子,所以是混合物,A错误;
B.水分子中中心原子的价层电子对是4,2个孤电子对,所以空间构型是V型,B正确;
C.C60是由非极性键构成的非极性分子,C错误;
D.富勒烯与石墨是同种元素构成的不同单质互为同素异形体,D错误;
故选B。
5.C
A.根据分析可知,该有机物中一定没有氧元素,A错误;
B.该有机物中C、H原子个数比为7:16,B错误;
C.该有机物分子式为C7H16,主链有5个碳原子的结构有、、、、这5种,C正确;
D.该有机物分子式为C7H16,为饱和烷烃,能发生取代反应但不能发生加成反应,D错误;
故答案选C。
6.C
A.由题给X的结构简式可知,该物质结构中含醚键、酚羟基和酮羰基三种含氧官能团,故A正确;
B.该分子中存在碳碳双键、羰基、苯环决定的平面结构,单键可以旋转,所有碳原子可能共平面,故B正确;
C.该分子结构对称,所以苯环上的一氯代物有3种,故C错误;
D.该物质结构中含酚羟基,能与发生显色反应,故D正确;
选C。
7.D
A.由图可知,TCN-1的分子式为,A错误;
B.由结构可知,分子中不饱和碳环能和氢气加成,1molTCN-1最多可与15mol发生加成反应,B错误;
C.TCN-1中含有羟基,不可以与氢氧化钠发生反应,C错误;
D.手性碳原子是连有四个不同基团的碳原子,该碳原子连接有3个相同的基团,故TCN-1分子中不含有手性碳原子,D正确;
故选D。
8.C
A.对比反应物和产物,可知碳碳三键断开与C6H13-N3发生了加成反应,A正确;
B.N3-C6H13结构不对称,属于极性分子,B正确;
C.反应物中的高分子化合物是混合物,C错误;
D.碳碳三键中C原子杂化方式为sp杂化,碳氧双键中C原子杂化方式为sp2杂化,-CH2-中C原子杂化方式为sp3杂化,D正确;
故选C。
9.A
A.与的结构相似,相对分子质量比大,其分子间的作用力大,物质的熔沸点就越高,与分子内化学键的键长无关,A错误;
B.由图可知,杯酚与形成超分子,而杯酚与不能形成超分子,反映了超分子具有“分子识别”的特性,B正确;
C.、为同一种元素形成的结构不同的单质,互为同素异形体,C正确;
D.杯酚分子中含有饱和碳原子,饱和碳原子与其相连的4个原子形成四面体结构,所有原子不可能位于同一平面内,D正确;
故选A。
10.C
A.Fe的原子序数为26,价电子排布式为:,失去2个电子后,转化为Fe2+,A正确;
B.Na+嵌入越多,导电性越好,根据晶胞结构可判断,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以导电能力普鲁士蓝小于普鲁士白,B正确;
C.普鲁士蓝晶胞一个小立方体中个数、Fe原子个数、个数,所以其原子个数比为1:2:6,化学式为,为价、的化合价为价,该化学式中Fe元素化合价为,与个数比为1:1,C错误;
D.普鲁士白晶胞中1个晶胞含有的Na+为8个,Fe原子个数,个数,化学式可表示为,D正确;
故选C。
11.BC
A.晶体属于离子晶体,故A错误;
B.ClNO各原子均达到8电子稳定结构则,O原子要连两根共价键,N原子要连三根共价键,Cl原子要连一根共价键,结构式为,故B正确;
C. 配位数指的是某个离子周围的异种电荷的离子数,NaCl中Na+周围的Cl-是6个,配位数为6,故C正确;
D.是由极性键构成的极性分子,故D错误;
故选BC。
12.BD
A.根据均摊法,晶胞中有4个Co,4个O,化学式为CoO,A正确;
B.基态Co原子的价电子排布式为,其价电子排布图为 ,有3个未成对电子,B错误;
C.根据图示结构结合几何关系可知,与O原子最近且等距离的O原子有12个,且距离为,C正确;
D.1mol晶胞中含有4molCoO,该氧化物的摩尔体积为,D错误;
故答案选BD。
13.AB
A.已知[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O △H>0,[CuCl4]2-为黄绿色,将盛有2mL0.5mol L-1CuCl2溶液的试管加热,该反应是吸热反应,升高温度,平衡正向移动,[Cu(H2O)4]2+转化为[CuCl4]2-,溶液变成黄绿色,故A错误;
B.将铜丝插入浓硝酸中,铜与浓硝酸发生剧烈反应,有红棕色气体NO2产生,溶液呈绿色,故B错误;
C.向盛有4.0mL0.1mol L-1CuSO4溶液的试管里逐滴滴加氨水至过量,先产生Cu(OH)2蓝色沉淀,后沉淀溶解,得到深蓝色透明溶液,故C正确;
D.用玻璃棒在容器内壁轻轻摩擦可以从容器内壁刮下少量碎屑充当晶核,过饱和溶液可迅速完成结晶过程,析出晶体,故D正确;
故选AB。
14.BD
A.苯环、碳碳双键、酯基都为平面形结构,与苯环、碳碳双键直接相连的原子在同一个平面上,且C—C键可自由旋转,则最多有10个碳原子共面,故A错误;
B.与足量H2加成,苯环变为环,碳碳双键变成单键,产物中含有7个手性碳原子,故B正确;
C.1mol绿原酸含有2mol酚羟基、1mol酯基、1mol羧基,可消耗4molNaOH,故C错误;
D.含有羧基,能发生酯化反应,含有碳碳双键,可发生加成、还原反应,与醇羟基相连的碳原子上有H,能发生消去反应,故D正确;
故选BD。
15.D
A.反应①是苯和乙烯生成乙苯,乙基是饱和的基团,则反应①属于加成反应,故A正确;
B.苯乙烯的结构中,1个苯环可与3个溴分子发生加成反应,1个乙烯基能够与1个溴分子发生加成反应,因此1 mol苯乙烯与溴发生加成反应,最多消耗4 mol Br2,故B正确;
C.苯与KMnO4酸性溶液不反应,但苯乙烯结构中含有碳碳双键,可以使KMnO4酸性溶液褪色,故C正确;
D.苯分子中所有原子是同一平面的,乙烯分子所有原子是同一平面的,则苯乙烯分子中的原子则可能会处于同一平面,则聚苯乙烯分子中的原子也可能处于同一平面,故D错误;
本题答案D。
16.(1) ad d
(2)a b
(3)
(4)sp2 sp3 C-F键的键能大于C-H键的键能
17.(1)球形冷凝管 冷凝回流苯和氯代叔丁烷等物质
(2)洗掉Na2CO3等(或洗掉可溶性无机物) 吸水(或干燥)
(3)80.1℃ c
(4)74.63%
18.(1)4s24p5 F>O>Cl>Br
(2)V形 sp3
(3)10 孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,斥力大
(4)(,,)
19.(1)邻甲基苯酚或2—甲基苯酚 取代反应
(2)酯基、羧基
(3)保护酚羟基不被酸性高锰酸钾溶液氧化
(4)++ CH3COOH
(5)14 、
同课章节目录
