化学人教版(2019)必修第一册2.1钠及其化合物(共63张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1钠及其化合物(共63张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 20:26:55 | ||
图片预览










文档简介
(共63张PPT)
第二章 海水中的主要元素--钠和氯
第一节 钠及其化合物
课时1:活泼的金属单质-钠
1、体会金属的共性与特性
2、应用氧化还原反应原理,以金属钠为代表, 从微观角度认识金属的还原性与其原子结构的关系。
3、通过金属钠的实验,
培养观察力;
培养从实验现象分析物质性质的归纳能力;
培养实验探究的初步能力。
地球上的绝大多数金属元素是以化合态存在于自然界中,为什么?
因为金属最外层电子数 ,
容易 电子,
表现出 性,
所以金属一般以化合物的形式存在。
也有以游离态存在于自然界中的,如金等
较少
失去
还原
宏观现象
微观解释
金属在自然界的存在
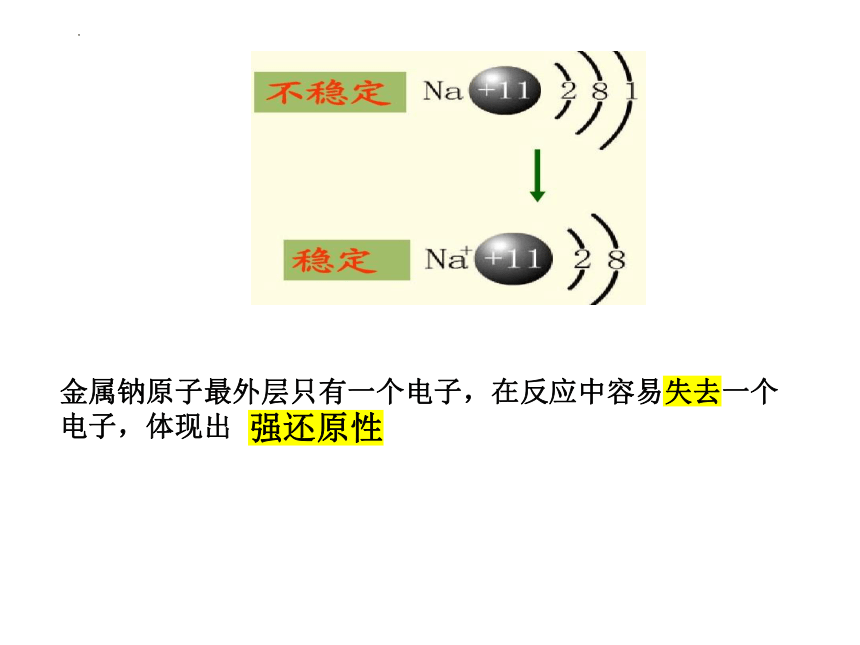
金属有哪些共性?(1) 物理性质有金属光泽、有导电性、有导热性、延展性大多数是固体(水银为液体)、(2)化学性质A、与氧气等非金属反应B、金属与酸的反应排在H前面的金属能置换出酸里的氢C、与盐反应(金属之间的置换反应)排在前面的金属能把排在后面的金属从其盐溶液中置换出来(3)原子结构有什么特点?原子结构与化学性质有什么关联?(以钠单质为例)金属钠原子最外层只有一个电子,在反应中容易失去一个电子,体现出 。
强还原性
1、与O2等非金属单质反应反应
钠单质的强还原性
△
2Na+O2===Na2O2
+1 -1
(淡黄色固体)
4Na+O2=2Na2O
(白色固体)
证明钠的强还原性的现象
切面很快变暗
Na2O2中O元素显-1价
2Na+S==Na2S
Δ
2Na+Cl2===2NaCl
点燃
现象:钠先熔化,剧烈燃烧,产生黄色火焰,生成淡黄色固体。
操作与现象 煤油保存 小刀切割 表面颜色变化 刚切开时 过一会儿
物理性质
化学性质
密度比煤油大,比水小
质地柔软
银白色
强还原性
很快变暗
从实验操作、现象推断钠的性质
加热很快融化
熔点低
能力培养:
(1)实验2-1:
实验仪器识别
广口瓶、镊子、滤纸、小刀、玻璃片
(2)实验2-2:
酒精灯、三脚架、泥三角、坩埚、坩埚钳
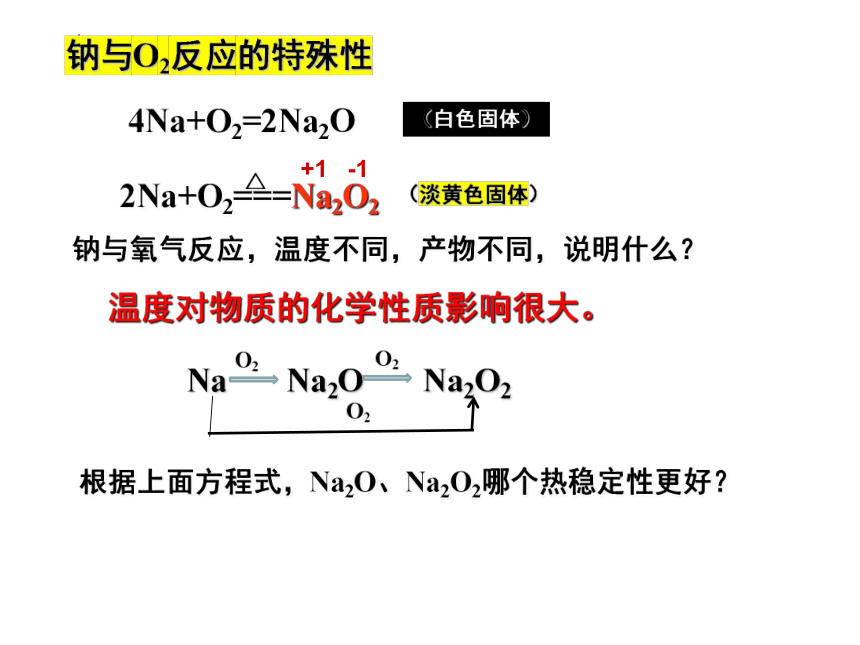
钠与氧气反应,温度不同,产物不同,说明什么?
温度对物质的化学性质影响很大。
根据上面方程式,Na2O、Na2O2哪个热稳定性更好?
Na Na2O Na2O2
O2
O2
O2
钠与O2反应的特殊性
△
2Na+O2===Na2O2
+1 -1
(淡黄色固体)
4Na+O2=2Na2O
(白色固体)
1、下列说法错误的是
A.钠在常温下就容易被氧化
B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃
D.钠在氧气中燃烧比在空气中更剧烈
C
2、取一小块钠在坩埚中加热,看到的现象依次是
①在空气中燃烧,火焰为黄色
②燃烧得到白色固体
③金属钠熔化
④产物是浅黄色的固体物质
A.①②③ B.①②④ C.③①④ D.②③④
C
2、钠与水的反应
预测钠与水反应的产物
反应物 产物 产物验证
还原剂
氧化剂
Na
H2O
Na+
H2
OH-
收集验纯,点燃,产生轻微的爆鸣声
向溶液中滴加几滴酚酞,溶液变红
钠的强还原性
理论分析
实验现象 分析及结论
浮
熔
游
响
红
钠的密度比水小
钠与水反应放热,钠的熔点低
反应产生气体,推动钠游动
钠的还原性强,反应剧烈,产生气体
产物呈碱性
2Na+2H2O=2NaOH+H2↑
从实验操作、现象推断钠的性质
能力培养:
钠与水反应,需严格控制钠的用量!!!
钠的性质小结
性质 相关实验操作和现象
质软 密度比煤油大比水小 熔点低
强还原性
小刀切割
煤油保存、浮在水面上
在水面熔化
切面很快变暗、
与O2反应产物复杂
与冷水反应发出嘶嘶声
物理性质:
银白色、质软(硬度小)、密度比煤油大、有金属光泽的固体。
化学性质:
强还原性,能与非金属单质、水等反应。
1.把一小块钠投入到盛有煤油和水的烧杯中,可以观察的是
A.钠浮在烧杯中的液面上
B.钠沉在烧杯的底部
C.煤油会燃烧起来,产生很浓的黑烟
D.钠在水和煤油的交界面上下浮动,直至反应结束
D
2.将4.6 g金属钠投入到95.6 g水中,得到的溶液溶质的质量分数为( )。
A.4.6% B.7.6% C.8% D.10%
C
知识应用:
金属钠为什么要保存在石蜡油或者煤油中?利用了金属钠的什么性质?
煤油的作用:隔绝空气和水,防止钠变质。
保存原理:金属钠的密度比煤油大,且不与煤油反应。
实验切割下来的残余金属钠该如何处理?
放回原试剂瓶
钠等活泼金属着火如何处理?
不能用水!用干燥的砂土扑灭
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露在空气中,最后生成什么物质?
①
⑤
④
③
②
钠与酸、碱、盐的水溶液反应
先:2Na + 2H+=2Na+ + H2↑
(1)钠与酸溶液的反应规律:
例:钠块投入含有少量HCl的溶液中,请写出相关的离子方程式。
后:2Na+2H2O=2Na++2OH-+H2↑
课堂延伸:
钠与水反应的实质是什么?
钠与水电离出的H+反应
“先酸后水”
(2)钠与碱溶液反应规律
(3)钠与盐溶液反应规律
例:钠投入饱和澄清石灰水中,有什么现象?石灰水的质量分数如何变化?
实质就是钠与水反应
钠先与水反应,生成的NaOH再与盐溶液中的离子反应。
溶液变浑浊,质量分数不变。
例:钠分别投入CuCl2、NH4Cl、NaHCO3溶液中,请写出相关的离子方程式。
钠投入CuCl2溶液中,产生气泡,有蓝色沉淀。
先:2Na+2H2O=2Na++2OH-+H2↑
后:Cu2++2OH- == Cu(OH)2↓
钠投入NH4Cl溶液中,产生有刺激性气味的气体。
先:2Na+2H2O=2Na++2OH-+H2↑
后:NH4++OH- ==NH3↑+H2O
钠投入NaHCO3溶液中,产生气泡。
先:2Na+2H2O=2Na++2OH-+H2↑
后:HCO3-+OH- ==CO32-+H2O
1、将一小块钠投入到下列物质的溶液中,既能放出氢气,又有沉淀析出的是 。
A.BaCl2 B.MgCl2 C.CuCl2.D.Na2CO3
BC
2、下列金属投入到装有稀盐酸的试管中,反应最剧烈的是
A.铜 B.铁 C.钠 D.铝
C
四、钠的工业制法
电解
2NaCl(熔融)===2Na↑+Cl2↑
五、钠的用途
除水剂
制备过氧化钠
化工
原料
冶炼钛等金属
制作高压钠灯
核反应堆
冷却剂
物质
类别
研究内容
代表物
活泼金属
单质
Na
物理性质
化学性质
强还原性
小结:
基于物质分类的认知模型
电和热的良导体
密度比水的小,比煤油的大
银白色固体,有金属光泽
硬度小
熔点低
与O2等非金属反应(化合)
与水反应(置换)
与熔融态盐反应(置换)
......
课后作业:
试写出活泼金属K、Ca、Mg分别与O2、水反应的离子方程式
课时2: 钠的几种化合物之过氧化钠
1、基于物质分类的认知模型的应用
2、基于氧化还原理论的认知模型的应用
思考与讨论
2、氧化钠与水反应和氧化钙与水反应类似,请你写出氧化钠与水反应的化学方程式。
白色固体,淡黄色固体
1、回忆前面做过的实验,描述Na2O和Na2O2的颜色、状态。
物质分类的认知模型的应用:
Na2O、CaO同属于碱性氧化物,性质相似。
物理性质
一、Na2O的性质:碱性氧化物的特征反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2H+ = 2Na+ + H2O
二、Na2O2的性质
Na2O2的可能性质的分析与猜测
类似物质 Na2O Na2O2 H2O2
氧的化合价 -2 -1 -1
物质类别 碱性氧化物 过氧化物 过氧化物
主要性质 与H2O、CO2等反应 绿色氧化剂、
分解放出O2
根据以上分析,
猜测Na2O2可能会 等反应,生成 。
H2O、CO2
O2
【实验2-3】: Na2O2与H2O的反应
实验现象 结论
2Na2O2+2H2O== 4NaOH+O2↑
化学方程式
单线桥
木条复燃
生成O2
pH试纸变蓝
生成碱
试管壁发烫
反应放热
Na2O2与H2O反应探究
2Na2O2+2H2O== 4NaOH+O2↑
按上述离子方程式,加酚酞,有何现象?
实验现象
溶液变红色的原因:
溶液变红,振荡后红色消失!
OH-与酚酞的相互作用
溶液褪色的原因猜测:
(1)OH-被消耗掉了
(2)酚酞被消耗掉了
(3)OH-与酚酞都被消耗掉了
Na2O2与H2O反应探究
Na2O2+2H2O== 2NaOH+H2O2
H2O2有强氧化性,能破坏酚酞。
2H2O2== 2H2O+O2↑
操作 实验现象 结论
溶液又变红
溶液不变红
向褪色后的溶液中再滴加酚酞
溶液褪色的原因验证:
猜测(2)正确
猜测(1)正确
Na2O2与H2O反应的复杂性
Na2O2也有强氧化性。
过氧化物(如Na2O2 )与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收CO2。利用该技术将药板置于潜艇、宇宙飞船、矿井等密闭环境中,供人呼吸应急使用。
其主要方程式(以Na2O2 为例)如下:
2Na2O2+2CO2=2Na2CO3+O2
物质
类别
构成 粒子
化学 性质
用途
课堂小结1:氧化钠和过氧化钠
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
过氧化物
碱性氧化物
Na2O
Na2O2
供氧剂、氧化剂、漂白剂
Na+、O2-
Na+、O22-
结构
性质
用途
1、在Na2O2与H2O反应中,发生氧化反应和还原反应得物质的质量之比是
A.1:1 B.1:2 C.2:1 D.8:53
A
2、下列各组物质相互反应时,改变反应的条件或者反应物的系数之比,生成的产物不变的是
A.Na与氧气 B.澄清石灰水与二氧化碳
C.碳与氧气 D.过氧化钠和水
D
3、向紫色石蕊试液中加入过量的过氧化钠粉末振荡,可观察到的现象是
A.溶液仍为紫色
B.溶液最终变成蓝色
C.最终溶液褪色,而无其他现象
D.有气泡产生,溶液最终变成无色
D
1、过氧化钠的强氧化性
要点深化
2、有关过氧化钠与二氧化碳、水的反应几种关系
1Na2O2--1 e-
(1)电子转移关系
(2)物质的量的关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
② 2Na2O2+2H2O=4NaOH+O2↑
① 2Na2O2+2CO2=2Na2CO3+O2
2CO2/ 2H2O--1O2
2Na2O2--2CO2/ 2H2O--1O2---2 e-
一定量的Na2O2与一定量的CO2和H2O(g)混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完成后,再与H2O发生反应。
(4)固体质量关系
发生反应①时,固体增加的质量等于与CO2等物质的量的CO的质量。
发生反应②时,固体增加的质量等于与H2O等物质的量的H2的质量。
(5)先后顺序关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,气体减小的体积或原混合气体体积的一半等于生成O2的体积。
(3)气体体积关系
俗名:纯碱、苏打 小苏打
课时3: 钠的几种化合物之
碳酸钠、碳酸氢钠
1、由点到面的发散思维的应用:
碳酸钠---正盐代表
碳酸氢钠---酸式盐代表
2、学习正盐与酸式盐的相互转化与鉴别
【实验2-4】 Na2CO3、NaHCO3常规性质
步骤 Na2CO3 NaHCO3
(1)外观
(2)加几滴水, 振荡并测温
(3)向(2)试管中加5mLH2O,振荡
(4)分别向(3)加1~2滴酚酞
性质结论 部分溶解
溶解
③溶解性: Na2CO3 > NaHCO3
溶液变微红色
溶液变红(较深)
④碱性: Na2CO3 > NaHCO3
加水结块变成晶体、
温度上升
部分溶解
温度下降
①Na2CO3加水变成含结晶水的晶体,并放热
白色粉末
白色晶体
②NaHCO3溶解吸热
注意:
碳酸钠水合物--碳酸钠晶体有Na2CO3 H2O、Na2CO3 7H2O、Na2CO3 10H2O三种。
碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末。
1.下列物质长期放在空气中质量不增加的是
A.氢氧化钠固体 B.浓硫酸
C.碳酸钠晶体 D.生石灰
C
物质 现象 结论 化学方程式
Na2CO3
NaHCO3
澄清石灰水变浑浊
热稳定性好’受热不分解
热稳定性差受热易分解生成
CO2、H2O
2NaHCO3= Na2CO3 +H2O + CO2
△
【实验2-5】 Na2CO3、NaHCO3的热稳定性
澄清石灰水无浑浊
要比较Na2CO3、NaHCO3的热稳定性图II中A、B各放什么物质?
现象 备注
Na2CO3 NaHCO3
HCl
Ca(OH)2
CaCl2
Na2CO3、NaHCO3的其它化学性质
向盐溶液中逐滴加入盐酸
先无明显现象,
后产生气泡。
一滴入盐酸就产生气泡
产生白色沉淀
产生白色沉淀
产生白色沉淀
无明显现象
注:可用CaCl2溶液鉴别NaHCO3、Na2CO3溶液,
也可用向NaHCO3、Na2CO3溶液分别滴加盐酸,产生气泡的先后来鉴别这两种盐。
课后思考:分别向Na2CO3、NaHCO3、
【Na2CO3、NaHCO3】、NaOH、Na2CO3溶液中滴入盐酸,产生CO2与加入盐酸体积的关系的图像问题。
1、
Na2CO3和NaHCO3的相互转化
加热、加碱
碳酸氢盐
酸式盐
碳酸盐
正盐
方案一:充分加热
方案二:加适量NaOH溶液
NaHCO3+NaOH==Na2CO3+H2O
△
2NaHCO3== Na2CO3 +H2O + CO2
HCO3-+OH-==CO32-+H2O
溶液转化
思考:方案二有什么缺点?
NaOH的用量难以控制,多了会引入NaOH杂质,少了则转化不完全。
固体转化
举一反三:写出Ca(HCO3)2热解方程式
△
Ca(HCO3)2=== CaCO3 +H2O + CO2
△
CaCO3=== CaO + CO2
2、
碳酸盐
通CO2、加强酸、
加某些盐
碳酸氢盐
正盐
酸式盐
方法二:向碳酸钠溶液加适量强酸溶液
方法一:向碳酸钠溶液中通足量CO2
Na2CO3 +HCl( 适量)==NaHCO3 +NaCl
CO32—+CO2+H2O==2HCO3-
Na2CO3 + CO2+H2O ==2NaHCO3
CO32—+H+==HCO3-
方法三:
向碳酸钠溶液加适量Ca(HCO3)2或Ba(HCO3)2溶液
Na2CO3 +Ca(HCO3)2( 适量)==2NaHCO3 +CaCO3↓
CO32-+Ca2+==CaCO3↓
以上方案哪个最佳?
NaHCO3
Na2CO3
1
固体,加热
④加入适量的酸
2
溶液,加适量NaOH
③通入过量CO2
④加入适量的Ca(HCO3)2
Na2CO3和NaHCO3的相互转化
Na2CO3和NaHCO3的鉴别
取少量试液于试管中,加入盐酸,有无色无味的气体生成,将生成的气体通入澄清的石灰水,有白色沉淀生成。说明含CO32-或HCO3-离子。
CO32-或HCO3-离子的检验
Na2CO3 NaHCO3 性质应用
俗名
色态
溶解性
碱性 鉴别
热稳定性 鉴别和转化
与酸反应 鉴别和转化
与碱反应 转化
与盐反应 鉴别和转化
苏打、纯碱
小苏打
白色粉末
细小白色晶体
稳定
受热易分解
课堂小结:Na2CO3 和NaHCO3
Na2CO3 >NaHCO3
Na2CO3 >NaHCO3
NaHCO3产生CO2的速率更快。
科学史话:侯德榜与侯氏制碱法
主要方程式
△
2NaHCO3== Na2CO3 +H2O + CO2 ↑
NaCl(饱和)+NH3+CO2+H2O== NaHCO3 ↓+NH4Cl
操作要点
向饱和食盐水中
先通入足量的氨气,后通入足量的CO2,
因为氨气极易溶于水,可得到高浓度溶液,且氨水呈碱性,便于后面吸收酸性的CO2气体。
化学原理
利用了在相同条件下,物质溶解度的差异。
定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊颜色的反应(物理变化)。
我们都知道大型晚会或节日时人们喜欢用烟花来庆祝,大家知道为什么烟花会具有那么多的颜色么?
三、焰色反应
实验
仪器:铂丝(无锈铁丝)、酒精灯
药品:稀盐酸(不能用硫酸)、待测溶液
步骤
洗——烧——蘸——烧
注意: A.不是所有金属元素都有焰色反应
B.焰色反应是金属元素的性质
C.焰色反应是物理变化
几种金属的焰色:
应用—— 可用于鉴别
固体中含有哪种金属元素、
溶液中含有哪种金属阳离子
如:焰色呈黄色,则一定含有Na元素,
透过蓝色钴玻璃,呈紫色,则含K元素。
B
1.比较Na2CO3和NaHCO3的性质,下列叙述正确的是( )
A.热稳定性:Na2CO3B.常温时水溶解性:Na2CO3>NaHCO3
C.与同浓度下盐酸反应放出气体快慢: Na2CO3>NaHCO3
D.相同浓度下水溶液的碱性 : Na2CO3随堂练习
2、NaHCO3固体加热分解的差量法计算
例:agNaHCO3固体加热分解一段时间后固体残余bg(a>b),求产生CO2的质量。
△
2NaHCO3== Na2CO3 +H2O + CO2
Δm
168g
106g
62g
44g
分析:NaHCO3固体可能未完全分解,残余固体中可能还有NaHCO3,因此考虑用差量法。由方程式可知,固体质量减轻62g,则生成44gCO2,两者的质量关系比值是不变的。设生成CO2 xg,固体质量差为(a-b)g,据此可列方程求解。
==
3、NaHCO3与Na2O2混合固体充分加热后固体成分分析。
分析:
NaHCO3分解产生固体Na2CO3,等物质的量的气体CO2、H2O。
CO2先与Na2O2反应,得到固体Na2CO3;
H2O后与Na2O2反应,得到固体NaOH;
若Na2O2不足,只有CO2与Na2O2反应,固体只有Na2CO3;
若Na2O2足量,CO2、H2O均与Na2O2反应,固体有Na2CO3、NaOH。
因此,解决本题的关键,首先要明确NaHCO3与Na2O2的量的问题,再根据CO2、H2O的反应先后顺序去分析最终的固体组成。
4、分别向Na2CO3、NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像问题。
(1)向NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图所示。
1HCl+NaHCO3== NaCl +H2O + 1CO2
反应开始即有气泡,且产生CO2的物质的量与消耗HCl的物质的量相等。
4、分别向Na2CO3、NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像问题。
(2)向Na2CO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图所示。
1HCl+NaHCO3== NaCl +H2O + 1CO2
盐酸先将Na2CO3转化为NaHCO3,故开始没有气泡;继续滴加盐酸,则与NaHCO3反应产生CO2,前后2段消耗HCl的量相等;故产生CO2的物质的量与消耗HCl的物质的量位1:2。
1HCl+Na2CO3== 1NaHCO3 +NaCl
前半段耗酸量小于后半段耗酸量
向Na2CO3、NaHCO3混合溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图。
前半段耗酸量大于后半段耗酸量
向NaOH、Na2CO3混合溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图。
第二章 海水中的主要元素--钠和氯
第一节 钠及其化合物
课时1:活泼的金属单质-钠
1、体会金属的共性与特性
2、应用氧化还原反应原理,以金属钠为代表, 从微观角度认识金属的还原性与其原子结构的关系。
3、通过金属钠的实验,
培养观察力;
培养从实验现象分析物质性质的归纳能力;
培养实验探究的初步能力。
地球上的绝大多数金属元素是以化合态存在于自然界中,为什么?
因为金属最外层电子数 ,
容易 电子,
表现出 性,
所以金属一般以化合物的形式存在。
也有以游离态存在于自然界中的,如金等
较少
失去
还原
宏观现象
微观解释
金属在自然界的存在
金属有哪些共性?(1) 物理性质有金属光泽、有导电性、有导热性、延展性大多数是固体(水银为液体)、(2)化学性质A、与氧气等非金属反应B、金属与酸的反应排在H前面的金属能置换出酸里的氢C、与盐反应(金属之间的置换反应)排在前面的金属能把排在后面的金属从其盐溶液中置换出来(3)原子结构有什么特点?原子结构与化学性质有什么关联?(以钠单质为例)金属钠原子最外层只有一个电子,在反应中容易失去一个电子,体现出 。
强还原性
1、与O2等非金属单质反应反应
钠单质的强还原性
△
2Na+O2===Na2O2
+1 -1
(淡黄色固体)
4Na+O2=2Na2O
(白色固体)
证明钠的强还原性的现象
切面很快变暗
Na2O2中O元素显-1价
2Na+S==Na2S
Δ
2Na+Cl2===2NaCl
点燃
现象:钠先熔化,剧烈燃烧,产生黄色火焰,生成淡黄色固体。
操作与现象 煤油保存 小刀切割 表面颜色变化 刚切开时 过一会儿
物理性质
化学性质
密度比煤油大,比水小
质地柔软
银白色
强还原性
很快变暗
从实验操作、现象推断钠的性质
加热很快融化
熔点低
能力培养:
(1)实验2-1:
实验仪器识别
广口瓶、镊子、滤纸、小刀、玻璃片
(2)实验2-2:
酒精灯、三脚架、泥三角、坩埚、坩埚钳
钠与氧气反应,温度不同,产物不同,说明什么?
温度对物质的化学性质影响很大。
根据上面方程式,Na2O、Na2O2哪个热稳定性更好?
Na Na2O Na2O2
O2
O2
O2
钠与O2反应的特殊性
△
2Na+O2===Na2O2
+1 -1
(淡黄色固体)
4Na+O2=2Na2O
(白色固体)
1、下列说法错误的是
A.钠在常温下就容易被氧化
B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃
D.钠在氧气中燃烧比在空气中更剧烈
C
2、取一小块钠在坩埚中加热,看到的现象依次是
①在空气中燃烧,火焰为黄色
②燃烧得到白色固体
③金属钠熔化
④产物是浅黄色的固体物质
A.①②③ B.①②④ C.③①④ D.②③④
C
2、钠与水的反应
预测钠与水反应的产物
反应物 产物 产物验证
还原剂
氧化剂
Na
H2O
Na+
H2
OH-
收集验纯,点燃,产生轻微的爆鸣声
向溶液中滴加几滴酚酞,溶液变红
钠的强还原性
理论分析
实验现象 分析及结论
浮
熔
游
响
红
钠的密度比水小
钠与水反应放热,钠的熔点低
反应产生气体,推动钠游动
钠的还原性强,反应剧烈,产生气体
产物呈碱性
2Na+2H2O=2NaOH+H2↑
从实验操作、现象推断钠的性质
能力培养:
钠与水反应,需严格控制钠的用量!!!
钠的性质小结
性质 相关实验操作和现象
质软 密度比煤油大比水小 熔点低
强还原性
小刀切割
煤油保存、浮在水面上
在水面熔化
切面很快变暗、
与O2反应产物复杂
与冷水反应发出嘶嘶声
物理性质:
银白色、质软(硬度小)、密度比煤油大、有金属光泽的固体。
化学性质:
强还原性,能与非金属单质、水等反应。
1.把一小块钠投入到盛有煤油和水的烧杯中,可以观察的是
A.钠浮在烧杯中的液面上
B.钠沉在烧杯的底部
C.煤油会燃烧起来,产生很浓的黑烟
D.钠在水和煤油的交界面上下浮动,直至反应结束
D
2.将4.6 g金属钠投入到95.6 g水中,得到的溶液溶质的质量分数为( )。
A.4.6% B.7.6% C.8% D.10%
C
知识应用:
金属钠为什么要保存在石蜡油或者煤油中?利用了金属钠的什么性质?
煤油的作用:隔绝空气和水,防止钠变质。
保存原理:金属钠的密度比煤油大,且不与煤油反应。
实验切割下来的残余金属钠该如何处理?
放回原试剂瓶
钠等活泼金属着火如何处理?
不能用水!用干燥的砂土扑灭
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露在空气中,最后生成什么物质?
①
⑤
④
③
②
钠与酸、碱、盐的水溶液反应
先:2Na + 2H+=2Na+ + H2↑
(1)钠与酸溶液的反应规律:
例:钠块投入含有少量HCl的溶液中,请写出相关的离子方程式。
后:2Na+2H2O=2Na++2OH-+H2↑
课堂延伸:
钠与水反应的实质是什么?
钠与水电离出的H+反应
“先酸后水”
(2)钠与碱溶液反应规律
(3)钠与盐溶液反应规律
例:钠投入饱和澄清石灰水中,有什么现象?石灰水的质量分数如何变化?
实质就是钠与水反应
钠先与水反应,生成的NaOH再与盐溶液中的离子反应。
溶液变浑浊,质量分数不变。
例:钠分别投入CuCl2、NH4Cl、NaHCO3溶液中,请写出相关的离子方程式。
钠投入CuCl2溶液中,产生气泡,有蓝色沉淀。
先:2Na+2H2O=2Na++2OH-+H2↑
后:Cu2++2OH- == Cu(OH)2↓
钠投入NH4Cl溶液中,产生有刺激性气味的气体。
先:2Na+2H2O=2Na++2OH-+H2↑
后:NH4++OH- ==NH3↑+H2O
钠投入NaHCO3溶液中,产生气泡。
先:2Na+2H2O=2Na++2OH-+H2↑
后:HCO3-+OH- ==CO32-+H2O
1、将一小块钠投入到下列物质的溶液中,既能放出氢气,又有沉淀析出的是 。
A.BaCl2 B.MgCl2 C.CuCl2.D.Na2CO3
BC
2、下列金属投入到装有稀盐酸的试管中,反应最剧烈的是
A.铜 B.铁 C.钠 D.铝
C
四、钠的工业制法
电解
2NaCl(熔融)===2Na↑+Cl2↑
五、钠的用途
除水剂
制备过氧化钠
化工
原料
冶炼钛等金属
制作高压钠灯
核反应堆
冷却剂
物质
类别
研究内容
代表物
活泼金属
单质
Na
物理性质
化学性质
强还原性
小结:
基于物质分类的认知模型
电和热的良导体
密度比水的小,比煤油的大
银白色固体,有金属光泽
硬度小
熔点低
与O2等非金属反应(化合)
与水反应(置换)
与熔融态盐反应(置换)
......
课后作业:
试写出活泼金属K、Ca、Mg分别与O2、水反应的离子方程式
课时2: 钠的几种化合物之过氧化钠
1、基于物质分类的认知模型的应用
2、基于氧化还原理论的认知模型的应用
思考与讨论
2、氧化钠与水反应和氧化钙与水反应类似,请你写出氧化钠与水反应的化学方程式。
白色固体,淡黄色固体
1、回忆前面做过的实验,描述Na2O和Na2O2的颜色、状态。
物质分类的认知模型的应用:
Na2O、CaO同属于碱性氧化物,性质相似。
物理性质
一、Na2O的性质:碱性氧化物的特征反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2H+ = 2Na+ + H2O
二、Na2O2的性质
Na2O2的可能性质的分析与猜测
类似物质 Na2O Na2O2 H2O2
氧的化合价 -2 -1 -1
物质类别 碱性氧化物 过氧化物 过氧化物
主要性质 与H2O、CO2等反应 绿色氧化剂、
分解放出O2
根据以上分析,
猜测Na2O2可能会 等反应,生成 。
H2O、CO2
O2
【实验2-3】: Na2O2与H2O的反应
实验现象 结论
2Na2O2+2H2O== 4NaOH+O2↑
化学方程式
单线桥
木条复燃
生成O2
pH试纸变蓝
生成碱
试管壁发烫
反应放热
Na2O2与H2O反应探究
2Na2O2+2H2O== 4NaOH+O2↑
按上述离子方程式,加酚酞,有何现象?
实验现象
溶液变红色的原因:
溶液变红,振荡后红色消失!
OH-与酚酞的相互作用
溶液褪色的原因猜测:
(1)OH-被消耗掉了
(2)酚酞被消耗掉了
(3)OH-与酚酞都被消耗掉了
Na2O2与H2O反应探究
Na2O2+2H2O== 2NaOH+H2O2
H2O2有强氧化性,能破坏酚酞。
2H2O2== 2H2O+O2↑
操作 实验现象 结论
溶液又变红
溶液不变红
向褪色后的溶液中再滴加酚酞
溶液褪色的原因验证:
猜测(2)正确
猜测(1)正确
Na2O2与H2O反应的复杂性
Na2O2也有强氧化性。
过氧化物(如Na2O2 )与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收CO2。利用该技术将药板置于潜艇、宇宙飞船、矿井等密闭环境中,供人呼吸应急使用。
其主要方程式(以Na2O2 为例)如下:
2Na2O2+2CO2=2Na2CO3+O2
物质
类别
构成 粒子
化学 性质
用途
课堂小结1:氧化钠和过氧化钠
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
过氧化物
碱性氧化物
Na2O
Na2O2
供氧剂、氧化剂、漂白剂
Na+、O2-
Na+、O22-
结构
性质
用途
1、在Na2O2与H2O反应中,发生氧化反应和还原反应得物质的质量之比是
A.1:1 B.1:2 C.2:1 D.8:53
A
2、下列各组物质相互反应时,改变反应的条件或者反应物的系数之比,生成的产物不变的是
A.Na与氧气 B.澄清石灰水与二氧化碳
C.碳与氧气 D.过氧化钠和水
D
3、向紫色石蕊试液中加入过量的过氧化钠粉末振荡,可观察到的现象是
A.溶液仍为紫色
B.溶液最终变成蓝色
C.最终溶液褪色,而无其他现象
D.有气泡产生,溶液最终变成无色
D
1、过氧化钠的强氧化性
要点深化
2、有关过氧化钠与二氧化碳、水的反应几种关系
1Na2O2--1 e-
(1)电子转移关系
(2)物质的量的关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
② 2Na2O2+2H2O=4NaOH+O2↑
① 2Na2O2+2CO2=2Na2CO3+O2
2CO2/ 2H2O--1O2
2Na2O2--2CO2/ 2H2O--1O2---2 e-
一定量的Na2O2与一定量的CO2和H2O(g)混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完成后,再与H2O发生反应。
(4)固体质量关系
发生反应①时,固体增加的质量等于与CO2等物质的量的CO的质量。
发生反应②时,固体增加的质量等于与H2O等物质的量的H2的质量。
(5)先后顺序关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,气体减小的体积或原混合气体体积的一半等于生成O2的体积。
(3)气体体积关系
俗名:纯碱、苏打 小苏打
课时3: 钠的几种化合物之
碳酸钠、碳酸氢钠
1、由点到面的发散思维的应用:
碳酸钠---正盐代表
碳酸氢钠---酸式盐代表
2、学习正盐与酸式盐的相互转化与鉴别
【实验2-4】 Na2CO3、NaHCO3常规性质
步骤 Na2CO3 NaHCO3
(1)外观
(2)加几滴水, 振荡并测温
(3)向(2)试管中加5mLH2O,振荡
(4)分别向(3)加1~2滴酚酞
性质结论 部分溶解
溶解
③溶解性: Na2CO3 > NaHCO3
溶液变微红色
溶液变红(较深)
④碱性: Na2CO3 > NaHCO3
加水结块变成晶体、
温度上升
部分溶解
温度下降
①Na2CO3加水变成含结晶水的晶体,并放热
白色粉末
白色晶体
②NaHCO3溶解吸热
注意:
碳酸钠水合物--碳酸钠晶体有Na2CO3 H2O、Na2CO3 7H2O、Na2CO3 10H2O三种。
碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末。
1.下列物质长期放在空气中质量不增加的是
A.氢氧化钠固体 B.浓硫酸
C.碳酸钠晶体 D.生石灰
C
物质 现象 结论 化学方程式
Na2CO3
NaHCO3
澄清石灰水变浑浊
热稳定性好’受热不分解
热稳定性差受热易分解生成
CO2、H2O
2NaHCO3= Na2CO3 +H2O + CO2
△
【实验2-5】 Na2CO3、NaHCO3的热稳定性
澄清石灰水无浑浊
要比较Na2CO3、NaHCO3的热稳定性图II中A、B各放什么物质?
现象 备注
Na2CO3 NaHCO3
HCl
Ca(OH)2
CaCl2
Na2CO3、NaHCO3的其它化学性质
向盐溶液中逐滴加入盐酸
先无明显现象,
后产生气泡。
一滴入盐酸就产生气泡
产生白色沉淀
产生白色沉淀
产生白色沉淀
无明显现象
注:可用CaCl2溶液鉴别NaHCO3、Na2CO3溶液,
也可用向NaHCO3、Na2CO3溶液分别滴加盐酸,产生气泡的先后来鉴别这两种盐。
课后思考:分别向Na2CO3、NaHCO3、
【Na2CO3、NaHCO3】、NaOH、Na2CO3溶液中滴入盐酸,产生CO2与加入盐酸体积的关系的图像问题。
1、
Na2CO3和NaHCO3的相互转化
加热、加碱
碳酸氢盐
酸式盐
碳酸盐
正盐
方案一:充分加热
方案二:加适量NaOH溶液
NaHCO3+NaOH==Na2CO3+H2O
△
2NaHCO3== Na2CO3 +H2O + CO2
HCO3-+OH-==CO32-+H2O
溶液转化
思考:方案二有什么缺点?
NaOH的用量难以控制,多了会引入NaOH杂质,少了则转化不完全。
固体转化
举一反三:写出Ca(HCO3)2热解方程式
△
Ca(HCO3)2=== CaCO3 +H2O + CO2
△
CaCO3=== CaO + CO2
2、
碳酸盐
通CO2、加强酸、
加某些盐
碳酸氢盐
正盐
酸式盐
方法二:向碳酸钠溶液加适量强酸溶液
方法一:向碳酸钠溶液中通足量CO2
Na2CO3 +HCl( 适量)==NaHCO3 +NaCl
CO32—+CO2+H2O==2HCO3-
Na2CO3 + CO2+H2O ==2NaHCO3
CO32—+H+==HCO3-
方法三:
向碳酸钠溶液加适量Ca(HCO3)2或Ba(HCO3)2溶液
Na2CO3 +Ca(HCO3)2( 适量)==2NaHCO3 +CaCO3↓
CO32-+Ca2+==CaCO3↓
以上方案哪个最佳?
NaHCO3
Na2CO3
1
固体,加热
④加入适量的酸
2
溶液,加适量NaOH
③通入过量CO2
④加入适量的Ca(HCO3)2
Na2CO3和NaHCO3的相互转化
Na2CO3和NaHCO3的鉴别
取少量试液于试管中,加入盐酸,有无色无味的气体生成,将生成的气体通入澄清的石灰水,有白色沉淀生成。说明含CO32-或HCO3-离子。
CO32-或HCO3-离子的检验
Na2CO3 NaHCO3 性质应用
俗名
色态
溶解性
碱性 鉴别
热稳定性 鉴别和转化
与酸反应 鉴别和转化
与碱反应 转化
与盐反应 鉴别和转化
苏打、纯碱
小苏打
白色粉末
细小白色晶体
稳定
受热易分解
课堂小结:Na2CO3 和NaHCO3
Na2CO3 >NaHCO3
Na2CO3 >NaHCO3
NaHCO3产生CO2的速率更快。
科学史话:侯德榜与侯氏制碱法
主要方程式
△
2NaHCO3== Na2CO3 +H2O + CO2 ↑
NaCl(饱和)+NH3+CO2+H2O== NaHCO3 ↓+NH4Cl
操作要点
向饱和食盐水中
先通入足量的氨气,后通入足量的CO2,
因为氨气极易溶于水,可得到高浓度溶液,且氨水呈碱性,便于后面吸收酸性的CO2气体。
化学原理
利用了在相同条件下,物质溶解度的差异。
定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊颜色的反应(物理变化)。
我们都知道大型晚会或节日时人们喜欢用烟花来庆祝,大家知道为什么烟花会具有那么多的颜色么?
三、焰色反应
实验
仪器:铂丝(无锈铁丝)、酒精灯
药品:稀盐酸(不能用硫酸)、待测溶液
步骤
洗——烧——蘸——烧
注意: A.不是所有金属元素都有焰色反应
B.焰色反应是金属元素的性质
C.焰色反应是物理变化
几种金属的焰色:
应用—— 可用于鉴别
固体中含有哪种金属元素、
溶液中含有哪种金属阳离子
如:焰色呈黄色,则一定含有Na元素,
透过蓝色钴玻璃,呈紫色,则含K元素。
B
1.比较Na2CO3和NaHCO3的性质,下列叙述正确的是( )
A.热稳定性:Na2CO3
C.与同浓度下盐酸反应放出气体快慢: Na2CO3>NaHCO3
D.相同浓度下水溶液的碱性 : Na2CO3
2、NaHCO3固体加热分解的差量法计算
例:agNaHCO3固体加热分解一段时间后固体残余bg(a>b),求产生CO2的质量。
△
2NaHCO3== Na2CO3 +H2O + CO2
Δm
168g
106g
62g
44g
分析:NaHCO3固体可能未完全分解,残余固体中可能还有NaHCO3,因此考虑用差量法。由方程式可知,固体质量减轻62g,则生成44gCO2,两者的质量关系比值是不变的。设生成CO2 xg,固体质量差为(a-b)g,据此可列方程求解。
==
3、NaHCO3与Na2O2混合固体充分加热后固体成分分析。
分析:
NaHCO3分解产生固体Na2CO3,等物质的量的气体CO2、H2O。
CO2先与Na2O2反应,得到固体Na2CO3;
H2O后与Na2O2反应,得到固体NaOH;
若Na2O2不足,只有CO2与Na2O2反应,固体只有Na2CO3;
若Na2O2足量,CO2、H2O均与Na2O2反应,固体有Na2CO3、NaOH。
因此,解决本题的关键,首先要明确NaHCO3与Na2O2的量的问题,再根据CO2、H2O的反应先后顺序去分析最终的固体组成。
4、分别向Na2CO3、NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像问题。
(1)向NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图所示。
1HCl+NaHCO3== NaCl +H2O + 1CO2
反应开始即有气泡,且产生CO2的物质的量与消耗HCl的物质的量相等。
4、分别向Na2CO3、NaHCO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像问题。
(2)向Na2CO3溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图所示。
1HCl+NaHCO3== NaCl +H2O + 1CO2
盐酸先将Na2CO3转化为NaHCO3,故开始没有气泡;继续滴加盐酸,则与NaHCO3反应产生CO2,前后2段消耗HCl的量相等;故产生CO2的物质的量与消耗HCl的物质的量位1:2。
1HCl+Na2CO3== 1NaHCO3 +NaCl
前半段耗酸量小于后半段耗酸量
向Na2CO3、NaHCO3混合溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图。
前半段耗酸量大于后半段耗酸量
向NaOH、Na2CO3混合溶液中滴加盐酸, 产生CO2的量和耗酸量的图像如图。
