高中化学选择性必修2 1.2.2原子结构与元素周期表 课件(共17张PPT)
文档属性
| 名称 | 高中化学选择性必修2 1.2.2原子结构与元素周期表 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
第一章 原子结构与性质
第二节 原子结构与元素的性质
第1课时
原子结构与元素周期表
教学目标
教学目标:
1. 了解周期表的分区、周期和族的划分,并能从原子价电子数目和价电子排布的角度解释
2. 了解典型过渡元素的核外电子排布特征
教学重点:原子价电子数目和价电子排布与元素周期表分区、周期和族的划分
教学难点:元素周期表的分区
新知导入
旧知回顾:元素周期律
(1)含义:元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律。
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
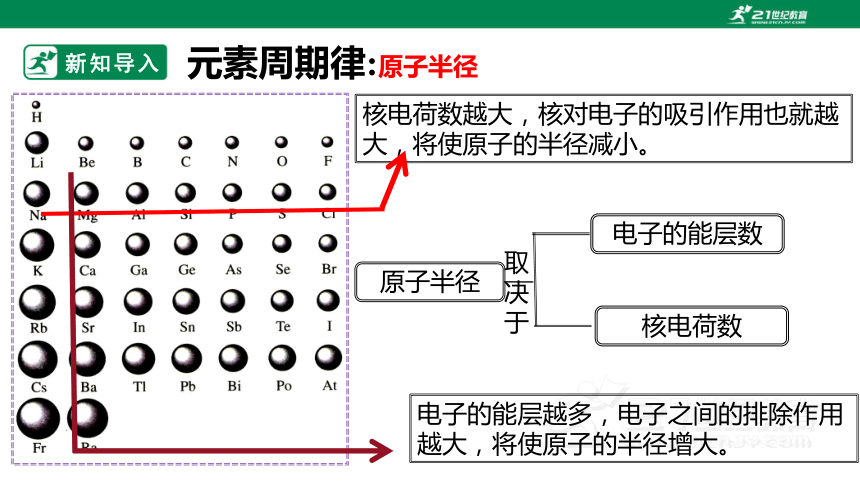
新知导入元素周期律:原子半径原子半径电子的能层数核电荷数取决于核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。电子的能层越多,电子之间的排除作用越大,将使原子的半径增大。新知讲解从左到右从上到下减小增大元素周期律:原子半径大小规律新知讲解
离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子
r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
电子层结构相同的微粒:核电荷数越大,半径越小
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
核电荷数、电子层数均不同的离子可选一种离子参照比较
比较r(K+)与r(Mg2+)可选r(Na+)为参照:r(K+)>r(Na+)>r(Mg2+)
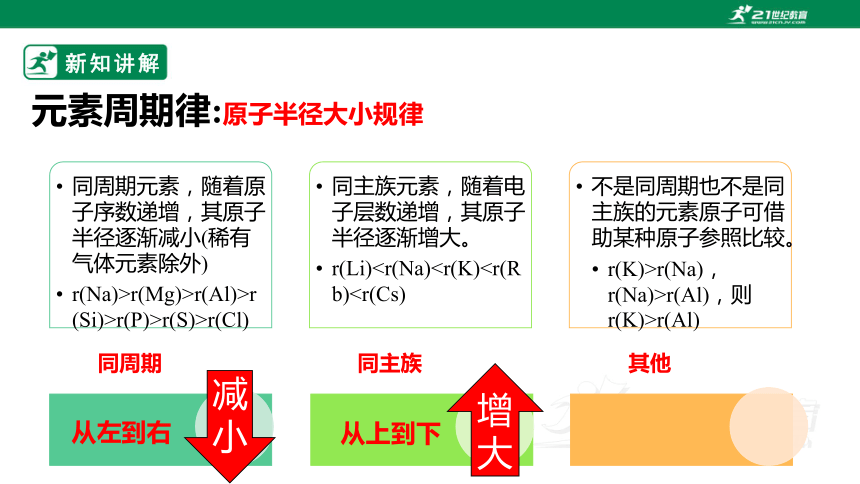
元素周期律:原子半径大小规律
新知讲解
比较下列离子半径大小
(1) r(Cl-) r(Cl),r(Fe) r(Fe2+) r(Fe3+)
(2) r(O2-) r(F-) r(Na+) r(Mg2+) r(Al3+)
(3)r(Li+) r(Na+) r(K+) r(Rb+) r(Cs+),r(O2-) r(S2-) r(Se2-) r(Te2-)
(4) r(K+) r(Na+) r(Mg2+)
元素周期律:原子半径
新知讲解
气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量,
I1表示。
第一电离能
逐级电离能
+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,用I2表示;依次类推。
元素周期律:电离能
新知讲解
对同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大
同一周期;从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子
同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越易失去电子
元素第一电离能变化规律
元素周期律:电离能
新知讲解
【学生活动】下图是钠、镁、铝的逐级电离能,为什么原子的逐级电离能越来越大?这些数据与是钠、镁、铝的化合价有什么联系?
逐级电离能增大原因:同一元素的逐级电离能是逐渐增大的,即I1<I2<I3,这是由于原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,失去第二个电子比失去第一个电子需要更多的能量。
逐级电离能的突变可以判断元素的化合价。
元素周期律:电离能
新知讲解
键合电子:原子中用于形成化学键的电子
电负性:用来描述不同元素的原子对键合电子吸引力的大小
电负性越大的原子,对键合电子的吸引力越大
标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性(稀有气体未计)
元素周期律:电负性
同周期(稀有气体元素除外),自左向右,元素的电负性逐渐增大,元素的非金属性逐渐增强、金属性逐渐减弱
同主族,自上而下,元素的电负性逐渐减小,元素的金属性逐渐增强、非金属性逐渐减弱。
新知讲解
判断元素的金属性和非金属性及其强弱
①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
元素周期律:电负性的应用
课堂练习
×
×
×
×
课堂练习
课堂总结
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
第一章 原子结构与性质
第二节 原子结构与元素的性质
第1课时
原子结构与元素周期表
教学目标
教学目标:
1. 了解周期表的分区、周期和族的划分,并能从原子价电子数目和价电子排布的角度解释
2. 了解典型过渡元素的核外电子排布特征
教学重点:原子价电子数目和价电子排布与元素周期表分区、周期和族的划分
教学难点:元素周期表的分区
新知导入
旧知回顾:元素周期律
(1)含义:元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律。
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
新知导入元素周期律:原子半径原子半径电子的能层数核电荷数取决于核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。电子的能层越多,电子之间的排除作用越大,将使原子的半径增大。新知讲解从左到右从上到下减小增大元素周期律:原子半径大小规律新知讲解
离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子
r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
电子层结构相同的微粒:核电荷数越大,半径越小
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
核电荷数、电子层数均不同的离子可选一种离子参照比较
比较r(K+)与r(Mg2+)可选r(Na+)为参照:r(K+)>r(Na+)>r(Mg2+)
元素周期律:原子半径大小规律
新知讲解
比较下列离子半径大小
(1) r(Cl-) r(Cl),r(Fe) r(Fe2+) r(Fe3+)
(2) r(O2-) r(F-) r(Na+) r(Mg2+) r(Al3+)
(3)r(Li+) r(Na+) r(K+) r(Rb+) r(Cs+),r(O2-) r(S2-) r(Se2-) r(Te2-)
(4) r(K+) r(Na+) r(Mg2+)
元素周期律:原子半径
新知讲解
气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量,
I1表示。
第一电离能
逐级电离能
+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,用I2表示;依次类推。
元素周期律:电离能
新知讲解
对同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大
同一周期;从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子
同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越易失去电子
元素第一电离能变化规律
元素周期律:电离能
新知讲解
【学生活动】下图是钠、镁、铝的逐级电离能,为什么原子的逐级电离能越来越大?这些数据与是钠、镁、铝的化合价有什么联系?
逐级电离能增大原因:同一元素的逐级电离能是逐渐增大的,即I1<I2<I3,这是由于原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,失去第二个电子比失去第一个电子需要更多的能量。
逐级电离能的突变可以判断元素的化合价。
元素周期律:电离能
新知讲解
键合电子:原子中用于形成化学键的电子
电负性:用来描述不同元素的原子对键合电子吸引力的大小
电负性越大的原子,对键合电子的吸引力越大
标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性(稀有气体未计)
元素周期律:电负性
同周期(稀有气体元素除外),自左向右,元素的电负性逐渐增大,元素的非金属性逐渐增强、金属性逐渐减弱
同主族,自上而下,元素的电负性逐渐减小,元素的金属性逐渐增强、非金属性逐渐减弱。
新知讲解
判断元素的金属性和非金属性及其强弱
①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
元素周期律:电负性的应用
课堂练习
×
×
×
×
课堂练习
课堂总结
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
