化学人教版(2019)选择性必修3 1.2.1有机化合物的分离提纯方法(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.2.1有机化合物的分离提纯方法(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:17:41 | ||
图片预览





文档简介
(共24张PPT)
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时 分离、提纯
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤。
2.了解有机化合物分离、提纯的原理和操作,能结合实际情况应用蒸馏、萃取或重结晶的方法进行有机化合物的分离提纯
1. 通过了解天然产物或人工合成的有机化合物的研究过程,培养创新意识。
2、通过苯甲酸重结晶的实验探究,感受科学研究的方法。
知识目标
核心素养
青蒿素结构的测定
科学. 社会. 技术 p21
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青萄素,随后展开了对青蒿素分子结构的测定和相关医学研究。中国科学院上海有机化学研究所和中国中医研究院中药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(一0一0一)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
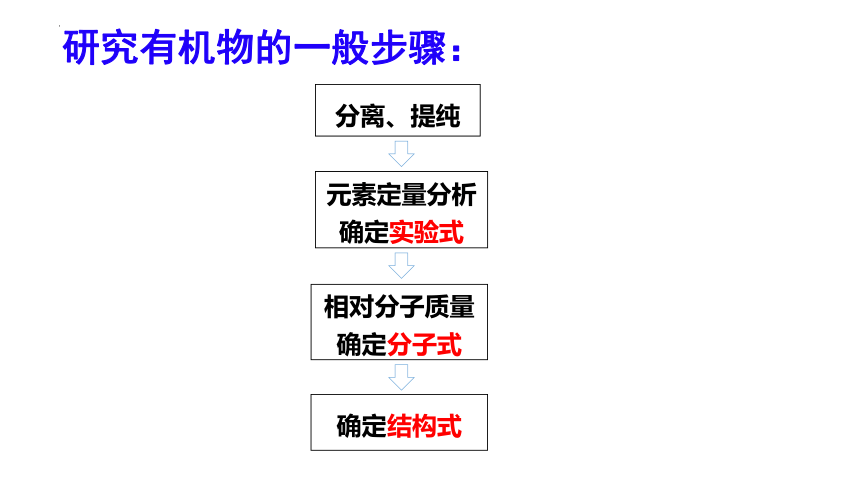
研究有机物的一般步骤
分离、提纯
元素定量分析
确定实验式
相对分子质量
确定分子式
确定结构式
研究有机物的一般步骤:
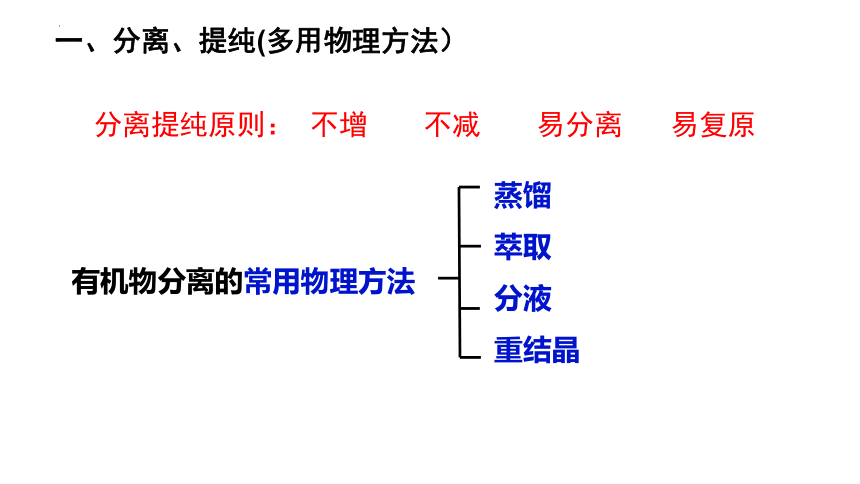
一、分离、提纯(多用物理方法)
分离提纯原则: 不增 不减 易分离 易复原
有机物分离的常用物理方法
蒸馏
萃取
分液
重结晶
适用于液态有机物
分离和提纯沸点差别较大的液态有机化合物的常用方法
①、有机物热稳定性较强;
②、有机物与杂质沸点相差较大。
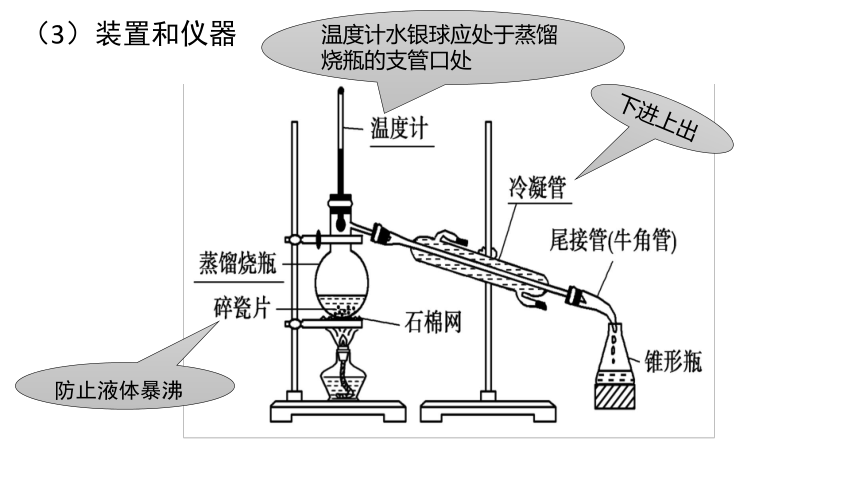
1、蒸馏
(1)原理:
(2)适用条件:
一、分离、提纯
(3)装置和仪器
温度计水银球应处于蒸馏烧瓶的支管口处
下进上出
防止液体暴沸
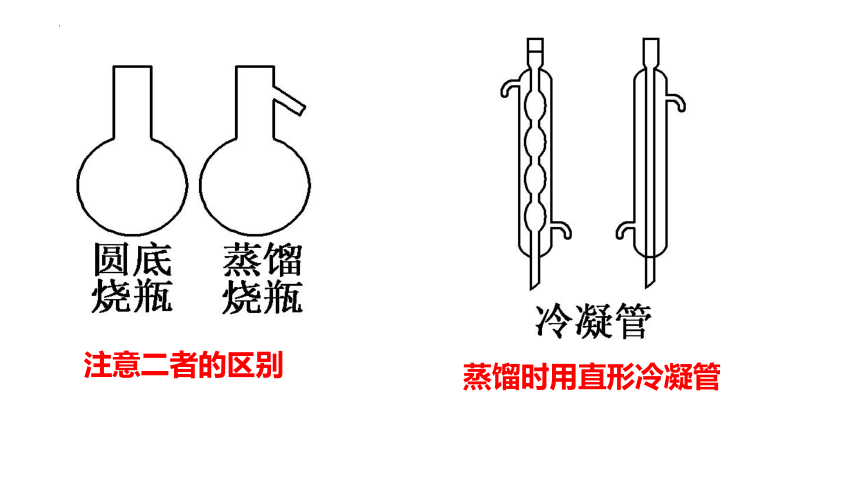
注意二者的区别
蒸馏时用直形冷凝管
视频导学
如何将工业酒精进行分离、提纯?
有些时候为了提高沸点,可以加入一些其他物质
如:乙醇和水的混合物,可以加入氧化钙,提高水的沸点。
练习1:欲用96%的工业酒精制取无水乙醇时,可选用的方法是( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出苯
√
注:检验酒精中是否含有水,选用无水CuSO4,变蓝即有水;
若要除去酒精中的水,加入生石灰CaO,再蒸馏即可。
(1)原理:
液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
(2)装置及仪器:
2、萃取、分液
屠呦呦利用乙醚提炼出抗疟有效成分青蒿素。
水煮西红柿汤
萃取
加入油
有油西红柿汤
(3)萃取剂的选择:
①萃取剂与原溶剂不互溶
②溶质在萃取剂中的溶解度大于原溶剂中的溶解度
③萃取剂与原溶液中的成分不反应
常见的萃取剂:苯、乙醚、二氯甲烷、四氯化碳
(原溶剂是水时不可用乙醇做萃取剂!!!)
视频导学
萃取碘水中的碘单质
振荡→
静置→
分液
注意:1、分液漏斗使用前需检查是否漏水。
2、分液时需打开瓶塞和活塞
3、分液时下层下出;上层上出。
检漏 →加液 →
(4)萃取操作过程:
分液:将两种互不相溶的液体分开的操作
1、下列关于萃取的操作说法正确的( )
A. 从溴水中提取溴,可加入酒精作萃取剂
B. 萃取操作完成后,静置分液,上、下层液体均从下口放出
C. 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层
D. 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应
D
【练习】
[练习2]下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,己烷和水
BD
注:烃类,酯类,卤代烃与水不互溶;
某些醇,酸,醛与水互溶
3. 重结晶
结晶:固体溶质从溶液中析出的过程。
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的物质,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的物质。如氯化钠和硝酸钾的分离。
结晶的两种方法
重结晶:是提纯固体有机化合物常用的方法,利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
关键:选择适当的溶剂。
选择溶剂的条件:
(1)杂质在溶剂中的溶解度很小或很大;
(2)被提纯的有机物在此溶剂中的溶解度受温度的影响较大。
溶解度很大,让它留在滤液里
溶解度很小,让它留在滤渣里
实验探究:重结晶法提纯苯甲酸
2、实验步骤:
过滤得到晶体,再对晶体进行洗涤干燥、称重
1、原理:苯甲酸在水中的溶解度随温度变化较大
【讨论】(1)重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤
不纯固体物质
残渣
(不溶性杂质)
滤液
滤液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
原理:苯甲酸在水中的溶解度随温度变化较大
【讨论】(2)溶解粗苯甲酸时加热的作用是什么 趁热过滤的目的是什么
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用
(4)如何检验提纯后的苯甲酸中氯化钠已被除净
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
加热的作用是加快溶解,使粗苯甲酸充分溶解;除去泥沙,并防止苯甲酸晶体低温析出
①溶解时搅拌,加速溶解;②过滤,引流,防止液体流出;③干燥时用于转移晶体。
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来麻烦。
取最后一次洗涤液少许于试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已除净。
将下列各组混合物与对应的分离方法连线
汽油和柴油 重结晶
溴 水 分液
KNO3和NaCl的混合物 蒸馏
四氯化碳和水 萃取
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时 分离、提纯
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤。
2.了解有机化合物分离、提纯的原理和操作,能结合实际情况应用蒸馏、萃取或重结晶的方法进行有机化合物的分离提纯
1. 通过了解天然产物或人工合成的有机化合物的研究过程,培养创新意识。
2、通过苯甲酸重结晶的实验探究,感受科学研究的方法。
知识目标
核心素养
青蒿素结构的测定
科学. 社会. 技术 p21
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青萄素,随后展开了对青蒿素分子结构的测定和相关医学研究。中国科学院上海有机化学研究所和中国中医研究院中药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(一0一0一)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
研究有机物的一般步骤
分离、提纯
元素定量分析
确定实验式
相对分子质量
确定分子式
确定结构式
研究有机物的一般步骤:
一、分离、提纯(多用物理方法)
分离提纯原则: 不增 不减 易分离 易复原
有机物分离的常用物理方法
蒸馏
萃取
分液
重结晶
适用于液态有机物
分离和提纯沸点差别较大的液态有机化合物的常用方法
①、有机物热稳定性较强;
②、有机物与杂质沸点相差较大。
1、蒸馏
(1)原理:
(2)适用条件:
一、分离、提纯
(3)装置和仪器
温度计水银球应处于蒸馏烧瓶的支管口处
下进上出
防止液体暴沸
注意二者的区别
蒸馏时用直形冷凝管
视频导学
如何将工业酒精进行分离、提纯?
有些时候为了提高沸点,可以加入一些其他物质
如:乙醇和水的混合物,可以加入氧化钙,提高水的沸点。
练习1:欲用96%的工业酒精制取无水乙醇时,可选用的方法是( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出苯
√
注:检验酒精中是否含有水,选用无水CuSO4,变蓝即有水;
若要除去酒精中的水,加入生石灰CaO,再蒸馏即可。
(1)原理:
液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
(2)装置及仪器:
2、萃取、分液
屠呦呦利用乙醚提炼出抗疟有效成分青蒿素。
水煮西红柿汤
萃取
加入油
有油西红柿汤
(3)萃取剂的选择:
①萃取剂与原溶剂不互溶
②溶质在萃取剂中的溶解度大于原溶剂中的溶解度
③萃取剂与原溶液中的成分不反应
常见的萃取剂:苯、乙醚、二氯甲烷、四氯化碳
(原溶剂是水时不可用乙醇做萃取剂!!!)
视频导学
萃取碘水中的碘单质
振荡→
静置→
分液
注意:1、分液漏斗使用前需检查是否漏水。
2、分液时需打开瓶塞和活塞
3、分液时下层下出;上层上出。
检漏 →加液 →
(4)萃取操作过程:
分液:将两种互不相溶的液体分开的操作
1、下列关于萃取的操作说法正确的( )
A. 从溴水中提取溴,可加入酒精作萃取剂
B. 萃取操作完成后,静置分液,上、下层液体均从下口放出
C. 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层
D. 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应
D
【练习】
[练习2]下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,己烷和水
BD
注:烃类,酯类,卤代烃与水不互溶;
某些醇,酸,醛与水互溶
3. 重结晶
结晶:固体溶质从溶液中析出的过程。
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的物质,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的物质。如氯化钠和硝酸钾的分离。
结晶的两种方法
重结晶:是提纯固体有机化合物常用的方法,利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
关键:选择适当的溶剂。
选择溶剂的条件:
(1)杂质在溶剂中的溶解度很小或很大;
(2)被提纯的有机物在此溶剂中的溶解度受温度的影响较大。
溶解度很大,让它留在滤液里
溶解度很小,让它留在滤渣里
实验探究:重结晶法提纯苯甲酸
2、实验步骤:
过滤得到晶体,再对晶体进行洗涤干燥、称重
1、原理:苯甲酸在水中的溶解度随温度变化较大
【讨论】(1)重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤
不纯固体物质
残渣
(不溶性杂质)
滤液
滤液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重
原理:苯甲酸在水中的溶解度随温度变化较大
【讨论】(2)溶解粗苯甲酸时加热的作用是什么 趁热过滤的目的是什么
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用
(4)如何检验提纯后的苯甲酸中氯化钠已被除净
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
加热的作用是加快溶解,使粗苯甲酸充分溶解;除去泥沙,并防止苯甲酸晶体低温析出
①溶解时搅拌,加速溶解;②过滤,引流,防止液体流出;③干燥时用于转移晶体。
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来麻烦。
取最后一次洗涤液少许于试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已除净。
将下列各组混合物与对应的分离方法连线
汽油和柴油 重结晶
溴 水 分液
KNO3和NaCl的混合物 蒸馏
四氯化碳和水 萃取
