化学人教版(2019)必修第一册2.2氯及其化合物(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2氯及其化合物(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 68.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:18:25 | ||
图片预览









文档简介
(共31张PPT)
海水中含盐3%,主要为氯化钠;
还含有氯化镁、硫酸镁等。
氯在自然界中以化合态存在(主要是NaCl)。
浩瀚的海洋 资源的宝库
(1)地球“不缺水”又“缺水”,为什么?
(2)据估算,将海水中的NaCl全部取出铺在
陆地,陆地会升高150米。
(3)人体内的NaCl对于维持人体各个系统平衡所具有的作用。
第二章 海水中的重要元素
第二节 氯及其化合物(1)
(P44)
化学是人类文明、进步的关键
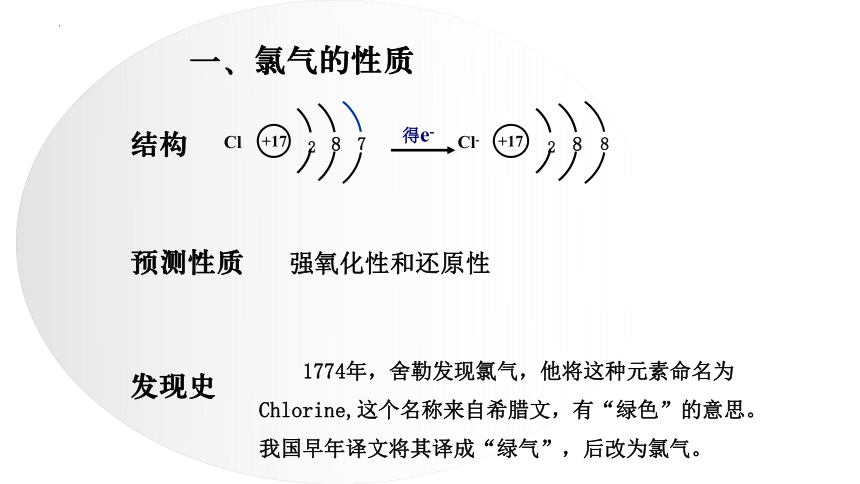
一、氯气的性质
结构
预测性质
发现史
1774年,舍勒发现氯气,他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
+17
Cl
2
8
7
得e-
+17
Cl-
2
8
8
强氧化性和还原性
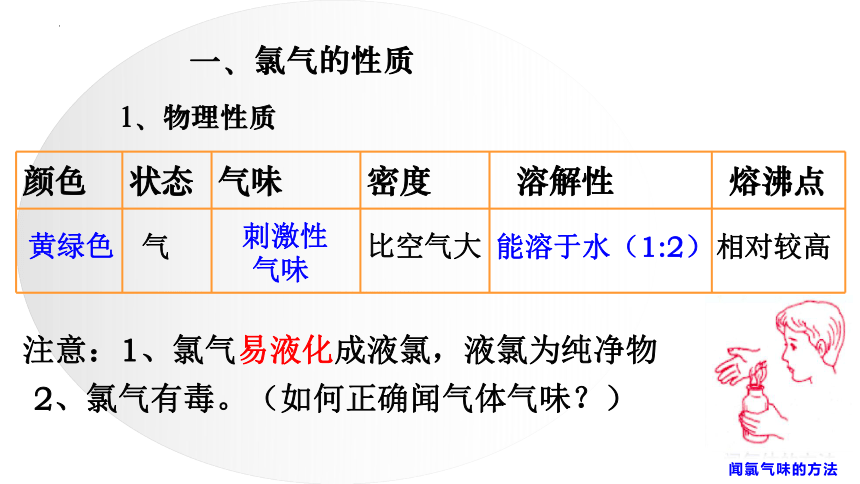
一、氯气的性质
1、物理性质
颜色 状态 气味 密度 溶解性 熔沸点
黄绿色
气
刺激性
气味
比空气大
能溶于水(1:2)
相对较高
注意:1、氯气易液化成液氯,液氯为纯净物
2、氯气有毒。(如何正确闻气体气味?)
2、氯气的化学性质
——较强氧化性
(1)与金属反应
Cu + Cl2 === CuCl2
点燃
(棕黄色)
+2
2Fe + 3Cl2 === 2FeCl3
点燃
结论:(1)氯气在点燃或灼热的条件下,可以与大多数金属反应,
+3
溶于水
蓝绿色溶液
注意:常温下液氯不与铁反应,用钢瓶储运液氯。
稀释变蓝
(棕褐色)
溶于水
黄色溶液
(2)多生成高价金属氯化物。
(3)氯气与大多数金属反应为放热反应。
常温下干燥的氯气也不与铁反应
P45
思考:过量铁呢?
延伸:
Na: Mg: Al:
H2 + Cl2 === 2HCl
点燃
H2 + Cl2 === 2HCl
光照
— HCl的工业制法
燃烧:任何发光、发热的剧烈的化学反应。
现象:安静燃烧,苍白色火焰,瓶口有白雾
(2)与非金属反应
烟——固体小颗粒分散在空气中
雾——液体小液滴分散在空气中
① 氯化氢是一种无色、有刺激性气味的气体。密度比空气大。
② 氯化氢极易溶解于水。(0℃下,1体积的水可溶解500体积的氯化氢)
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
现象:爆炸;
①与氢气反应
③HCl溶于水即形成盐酸,具有酸的通性。
注意:干燥的HCl不显酸性,因无H+电离出来。
HCl + NH3 = NH4Cl
④氯化氢气体遇氨气有白烟生成。
②:与O2、S反应:
Cl2不足(S2Cl2):
Cl2过量(SCl2):
O2:不反应
S
③:与N2、P反应:
Cl2不足(PCl3):
Cl2过量(PCl5):
现象:
点燃的磷在氯气中继续燃烧,
产生白色烟雾。
3Cl2 + 2P = 2PCl3
(白雾)
5Cl2 + 2P = 2PCl5
(白烟)
N2:不反应
P:
S+Cl2=S2Cl2
S+Cl2=SCl2
④:与C、Si反应:
C:很难反应;
Si:
ClF
BrCl
⑤:与同列元素反应(卤素互化物):
(3)与常见还原剂反应
Cl2 + H2S = 2HCl + S
Cl2 + SO32- + H2O= 2Cl- + SO42-+2H+
Cl2 + 2I- = 2Cl-+ I2
Cl2 + 2Fe2+= 2Cl- + 2Fe3+
新制氯水中起氧化性作用的是Cl2
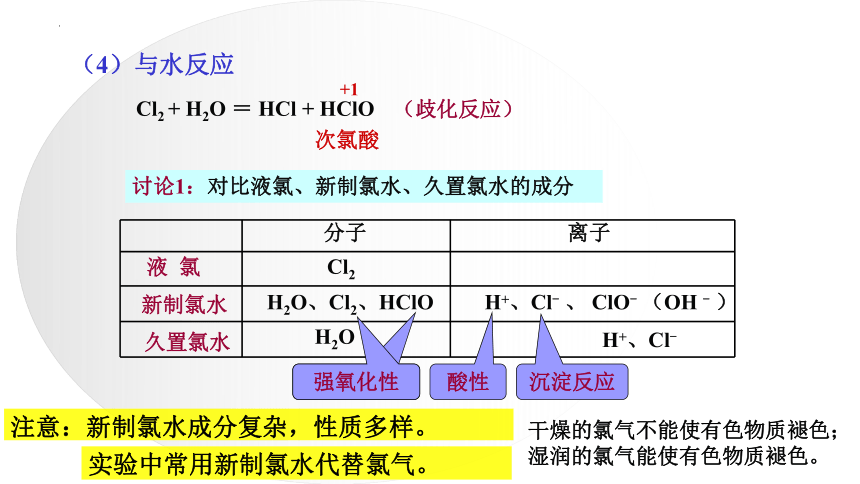
(4)与水反应
Cl2 + H2O = HCl + HClO
+1
(歧化反应)
次氯酸
H2O、Cl2、HClO
H+、Cl- 、 ClO- (OH - )
H2O
H+、Cl-
讨论1:对比液氯、新制氯水、久置氯水的成分
Cl2
新制氯水
分子
离子
久置氯水
液 氯
强氧化性
酸性
沉淀反应
强氧化性
注意:新制氯水成分复杂,性质多样。
实验中常用新制氯水代替氯气。
干燥的氯气不能使有色物质褪色;
湿润的氯气能使有色物质褪色。
A、不稳定(P48)
B、强氧化性(P46)
杀菌、消毒、漂白(永久漂白)
关于HClO
C、酸性:
思考:以下反应能否发生及可能的产物?
HClO+Na2CO3=
NaHCO3+NaClO=
CO2+NaClO=
HClO是不稳定、强氧化性的一元弱酸
酸性:H2CO3 >HClO>HCO3 -
2HClO === 2HCl + O2↑
光照
氯水要放在阴暗处,
并储存在棕色瓶中。
讨论2:将以下物质分别加入到新制的氯水中,有何现象?
①碳酸氢钠溶液 ②硝酸银溶液 ③品红溶液 ④紫色石蕊试液
讨论3:往NaOH溶液中滴加酚酞溶液,再逐滴滴加氯水,
会有什么现象?
实验中酚酞褪色的原因是什么?
②因为氯水中含有的HClO起漂白作用
你是否能设计实验证明哪种猜测是对的呢?
①因为Cl2与碱发生了反应
酚酞变红后褪色
取褪色后的溶液少量滴加几滴NaOH溶液。
若溶液恢复红色,说明是原因①;
若溶液未恢复红色,说明是原因②
讨论4:
将一盛满标况下氯气的烧瓶倒置于水槽中,光照足够长的时间,
进入烧瓶中的液体约占烧瓶总体积的多少?
1/2
(5)与碱反应(自行剖析)
与NaOH:
Cl2+H2O=HCl+HClO
2NaOH+Cl2=NaCl+NaClO+H2O
常用NaOH 吸收多余Cl2
(次氯酸钠)
★次氯酸不稳定,次氯酸盐较稳定。
向次氯酸钠溶液中通入CO2:
2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O
(石灰乳)
漂白粉的制法:
漂白原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
( 酸性:H2CO3>HClO> HCO3 -)
漂白粉 (混合物)
有效成分
注意:
讨论:漂白粉久置空气中失效的原因
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO === 2HCl + O2↑
光照
制取盐酸及其它氯化物
Cl2
制取漂白剂
作消毒剂(自来水)
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
盐酸西布曲明
3、氯气的用途
1、下列叙述中正确的是( )
A、活性炭和氯气加入溶液中都会使有机色质脱色,
若两者同时使用,一定会大大增强脱色效果
B、Cl2有强氧化性,能使染料和有机色素褪色
C、Cl2、Cl与Cl-均属氯元素,它们具有相似的化学性质
D、钢瓶可以贮存液氯,但不能贮存氯水
D
2、检验HCl气体中是否混合氯气,下列方法中 最好采用( )
A、闻气味 B、将气体通入AgNO3溶液
C、将气体通入NaHCO3溶液
D、用湿润蓝色石蕊试纸接触气体
D
练习:
3、某同学用经过氯气消毒的自来水配制下列物质的溶液,
不会引起溶液明显变质的是( )
A、KCl B、NaOH C、AgNO3 D、FeCl2
A
4、如图是一种验证某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红布条颜色无变化;当关闭B时,C中红布条颜色褪去。则D瓶中盛有的液体是
A.浓硫酸 B.浓NaOH溶液
C.四氯化碳 D.饱和NaCl溶液
D
第二章 海水中的重要元素
第二节 氯及其化合物(2)
化学是人类文明、进步的关键
三、氯气的制法
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
注意:
(2) MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替。
2KMnO4+16HCl(浓)=2KCl +2MnCl2+5Cl2↑+8H2O
浓盐酸可用浓H2SO4和NaCl固体代替。
(1) 浓HCl的作用:
(一) 实验室制法
(只能用浓盐酸)
思考:足量 MnO2与含100个HCl分子的浓盐酸反应,可制得多少Cl2分子?
还原剂、酸性
2、制取装置:
气体发生装置:
固体与液体加热制气体
气体收集装置:
向上排空气法收集
尾气处理装置:
氯气有毒,用NaOH溶液吸收。
气体净化装置:
先用饱和食盐水(或水)除去混有的HCl气体,再用浓硫酸除去水蒸气
(或排饱和食盐水法)
发生装置
净化装置
收集装置
尾气处理装置
3、实验步骤
(1)仪器的安装:由下而上,从左到右
(2)检查气密性:
(3)添加药品:先固后液,先下后上
(4)缓缓加热:
思考:如何验满?
(5)结束实验:
制备实验的二意识、三原理、四过程
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、 尾气处理过程
(二)工业制法:电解饱和食盐水(了解)
MnO2
浓盐酸
NaOH溶液
Cl2
气体发生装置
收集装置
尾气处理装置
?
安全瓶
讨论1:实验室用加热二氧化锰和浓盐酸的混合物制取氯气,某同学对发生装置进行仪器组装时,进行如下操作:
a、将烧瓶固定在铁架台上
b、塞紧带分液漏斗和导气管的橡胶塞
c、将酒精灯放在铁架台上
d、根据酒精灯高度调整铁圈位置,并在铁圈上垫上石棉网
(1)其正确操作顺序是 ;
(2)装置连接好后,在实验前还必需进行的操作 ;
(3)氯气有毒,为避免尾气对空气污染,需增加尾气吸收装置。
可供选择的试剂:A、AgNO3溶液,B、石灰水,C、NaOH溶液。
你认为最好选用 ,理由是:
c d a b
检查气密性
C
用AgNO3溶液成本太高,吸收速率较慢; 石灰水中Ca(OH)2量太少,吸收Cl2不完全。
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
③ NaClO+2HCl(浓)=NaCl+Cl2↑+H2O
④K2Cr2O7+14HCl(浓)=2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- = 2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl- = 3Cl2↑+3H2O
ClO-+2H++Cl- = Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- = 2Cr3++3Cl2↑+7H2O
拓展
其他制备Cl2的方法
“84”消毒液与洁厕灵不能混合使用
三、氯离子的检验
试剂:硝酸酸化的硝酸银溶液。
现象:产生不溶于硝酸的白色沉淀。
反应离子方程式为:Ag+ + Cl -=AgCl↓
实验2-9 Ag+ + Cl -=AgCl↓
2Ag+ + CO32-=Ag2CO3↓
Ag2CO3+ 2H+ = 2Ag+ + H2O + CO2↑
讨论:如果氯气泄露该采用什么防御办法?
※ (了解):其他X-(Br-、I-)的检验也用此法:
AgX↓颜色不同,AgBr↓浅黄色 、 AgI↓黄色
补充、氯化氢的实验室制法
1、反应原理:
NaCl(S)+ H2SO4(浓)=== NaHSO4 + HCl↑
微热
NaCl (S) + NaHSO4=== Na2SO4 + HCl↑
△
2NaCl (S) + H2SO4(浓)=== Na2SO4 + 2HCl↑
△
(3) NaCl可用别的金属氯化物代替。
注意:
(2)因为HCl极易溶于水,所以须用浓硫酸和氯化钠固体。
(1)该反应是利用了浓硫酸的高沸点。
高沸点酸 低沸点酸(难挥发性酸 易挥发性酸)
气体发生装置
收集装置
尾气处理装置
NaCl固体
浓硫酸
水
2、制取装置:
(1)收集HCl气体只能用向上排空气法收集。
(2)尾气处理时,连接的倒扣漏斗的作用是防止倒吸。
注意:
2、在实验室里,如没有浓盐酸,怎样制Cl2?
思考:1、还可通过哪些方式防止倒吸?
京沪高速公路淮安路段液氯的泄漏
新华网报道: 某年某月某日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
气味
溶解性
密度
毒性
海水中含盐3%,主要为氯化钠;
还含有氯化镁、硫酸镁等。
氯在自然界中以化合态存在(主要是NaCl)。
浩瀚的海洋 资源的宝库
(1)地球“不缺水”又“缺水”,为什么?
(2)据估算,将海水中的NaCl全部取出铺在
陆地,陆地会升高150米。
(3)人体内的NaCl对于维持人体各个系统平衡所具有的作用。
第二章 海水中的重要元素
第二节 氯及其化合物(1)
(P44)
化学是人类文明、进步的关键
一、氯气的性质
结构
预测性质
发现史
1774年,舍勒发现氯气,他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
+17
Cl
2
8
7
得e-
+17
Cl-
2
8
8
强氧化性和还原性
一、氯气的性质
1、物理性质
颜色 状态 气味 密度 溶解性 熔沸点
黄绿色
气
刺激性
气味
比空气大
能溶于水(1:2)
相对较高
注意:1、氯气易液化成液氯,液氯为纯净物
2、氯气有毒。(如何正确闻气体气味?)
2、氯气的化学性质
——较强氧化性
(1)与金属反应
Cu + Cl2 === CuCl2
点燃
(棕黄色)
+2
2Fe + 3Cl2 === 2FeCl3
点燃
结论:(1)氯气在点燃或灼热的条件下,可以与大多数金属反应,
+3
溶于水
蓝绿色溶液
注意:常温下液氯不与铁反应,用钢瓶储运液氯。
稀释变蓝
(棕褐色)
溶于水
黄色溶液
(2)多生成高价金属氯化物。
(3)氯气与大多数金属反应为放热反应。
常温下干燥的氯气也不与铁反应
P45
思考:过量铁呢?
延伸:
Na: Mg: Al:
H2 + Cl2 === 2HCl
点燃
H2 + Cl2 === 2HCl
光照
— HCl的工业制法
燃烧:任何发光、发热的剧烈的化学反应。
现象:安静燃烧,苍白色火焰,瓶口有白雾
(2)与非金属反应
烟——固体小颗粒分散在空气中
雾——液体小液滴分散在空气中
① 氯化氢是一种无色、有刺激性气味的气体。密度比空气大。
② 氯化氢极易溶解于水。(0℃下,1体积的水可溶解500体积的氯化氢)
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
现象:爆炸;
①与氢气反应
③HCl溶于水即形成盐酸,具有酸的通性。
注意:干燥的HCl不显酸性,因无H+电离出来。
HCl + NH3 = NH4Cl
④氯化氢气体遇氨气有白烟生成。
②:与O2、S反应:
Cl2不足(S2Cl2):
Cl2过量(SCl2):
O2:不反应
S
③:与N2、P反应:
Cl2不足(PCl3):
Cl2过量(PCl5):
现象:
点燃的磷在氯气中继续燃烧,
产生白色烟雾。
3Cl2 + 2P = 2PCl3
(白雾)
5Cl2 + 2P = 2PCl5
(白烟)
N2:不反应
P:
S+Cl2=S2Cl2
S+Cl2=SCl2
④:与C、Si反应:
C:很难反应;
Si:
ClF
BrCl
⑤:与同列元素反应(卤素互化物):
(3)与常见还原剂反应
Cl2 + H2S = 2HCl + S
Cl2 + SO32- + H2O= 2Cl- + SO42-+2H+
Cl2 + 2I- = 2Cl-+ I2
Cl2 + 2Fe2+= 2Cl- + 2Fe3+
新制氯水中起氧化性作用的是Cl2
(4)与水反应
Cl2 + H2O = HCl + HClO
+1
(歧化反应)
次氯酸
H2O、Cl2、HClO
H+、Cl- 、 ClO- (OH - )
H2O
H+、Cl-
讨论1:对比液氯、新制氯水、久置氯水的成分
Cl2
新制氯水
分子
离子
久置氯水
液 氯
强氧化性
酸性
沉淀反应
强氧化性
注意:新制氯水成分复杂,性质多样。
实验中常用新制氯水代替氯气。
干燥的氯气不能使有色物质褪色;
湿润的氯气能使有色物质褪色。
A、不稳定(P48)
B、强氧化性(P46)
杀菌、消毒、漂白(永久漂白)
关于HClO
C、酸性:
思考:以下反应能否发生及可能的产物?
HClO+Na2CO3=
NaHCO3+NaClO=
CO2+NaClO=
HClO是不稳定、强氧化性的一元弱酸
酸性:H2CO3 >HClO>HCO3 -
2HClO === 2HCl + O2↑
光照
氯水要放在阴暗处,
并储存在棕色瓶中。
讨论2:将以下物质分别加入到新制的氯水中,有何现象?
①碳酸氢钠溶液 ②硝酸银溶液 ③品红溶液 ④紫色石蕊试液
讨论3:往NaOH溶液中滴加酚酞溶液,再逐滴滴加氯水,
会有什么现象?
实验中酚酞褪色的原因是什么?
②因为氯水中含有的HClO起漂白作用
你是否能设计实验证明哪种猜测是对的呢?
①因为Cl2与碱发生了反应
酚酞变红后褪色
取褪色后的溶液少量滴加几滴NaOH溶液。
若溶液恢复红色,说明是原因①;
若溶液未恢复红色,说明是原因②
讨论4:
将一盛满标况下氯气的烧瓶倒置于水槽中,光照足够长的时间,
进入烧瓶中的液体约占烧瓶总体积的多少?
1/2
(5)与碱反应(自行剖析)
与NaOH:
Cl2+H2O=HCl+HClO
2NaOH+Cl2=NaCl+NaClO+H2O
常用NaOH 吸收多余Cl2
(次氯酸钠)
★次氯酸不稳定,次氯酸盐较稳定。
向次氯酸钠溶液中通入CO2:
2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O
(石灰乳)
漂白粉的制法:
漂白原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
( 酸性:H2CO3>HClO> HCO3 -)
漂白粉 (混合物)
有效成分
注意:
讨论:漂白粉久置空气中失效的原因
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO === 2HCl + O2↑
光照
制取盐酸及其它氯化物
Cl2
制取漂白剂
作消毒剂(自来水)
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
盐酸西布曲明
3、氯气的用途
1、下列叙述中正确的是( )
A、活性炭和氯气加入溶液中都会使有机色质脱色,
若两者同时使用,一定会大大增强脱色效果
B、Cl2有强氧化性,能使染料和有机色素褪色
C、Cl2、Cl与Cl-均属氯元素,它们具有相似的化学性质
D、钢瓶可以贮存液氯,但不能贮存氯水
D
2、检验HCl气体中是否混合氯气,下列方法中 最好采用( )
A、闻气味 B、将气体通入AgNO3溶液
C、将气体通入NaHCO3溶液
D、用湿润蓝色石蕊试纸接触气体
D
练习:
3、某同学用经过氯气消毒的自来水配制下列物质的溶液,
不会引起溶液明显变质的是( )
A、KCl B、NaOH C、AgNO3 D、FeCl2
A
4、如图是一种验证某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红布条颜色无变化;当关闭B时,C中红布条颜色褪去。则D瓶中盛有的液体是
A.浓硫酸 B.浓NaOH溶液
C.四氯化碳 D.饱和NaCl溶液
D
第二章 海水中的重要元素
第二节 氯及其化合物(2)
化学是人类文明、进步的关键
三、氯气的制法
1、反应原理:
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
△
注意:
(2) MnO2可用 KMnO4、KClO3、NaClO 等强氧化剂代替。
2KMnO4+16HCl(浓)=2KCl +2MnCl2+5Cl2↑+8H2O
浓盐酸可用浓H2SO4和NaCl固体代替。
(1) 浓HCl的作用:
(一) 实验室制法
(只能用浓盐酸)
思考:足量 MnO2与含100个HCl分子的浓盐酸反应,可制得多少Cl2分子?
还原剂、酸性
2、制取装置:
气体发生装置:
固体与液体加热制气体
气体收集装置:
向上排空气法收集
尾气处理装置:
氯气有毒,用NaOH溶液吸收。
气体净化装置:
先用饱和食盐水(或水)除去混有的HCl气体,再用浓硫酸除去水蒸气
(或排饱和食盐水法)
发生装置
净化装置
收集装置
尾气处理装置
3、实验步骤
(1)仪器的安装:由下而上,从左到右
(2)检查气密性:
(3)添加药品:先固后液,先下后上
(4)缓缓加热:
思考:如何验满?
(5)结束实验:
制备实验的二意识、三原理、四过程
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、 尾气处理过程
(二)工业制法:电解饱和食盐水(了解)
MnO2
浓盐酸
NaOH溶液
Cl2
气体发生装置
收集装置
尾气处理装置
?
安全瓶
讨论1:实验室用加热二氧化锰和浓盐酸的混合物制取氯气,某同学对发生装置进行仪器组装时,进行如下操作:
a、将烧瓶固定在铁架台上
b、塞紧带分液漏斗和导气管的橡胶塞
c、将酒精灯放在铁架台上
d、根据酒精灯高度调整铁圈位置,并在铁圈上垫上石棉网
(1)其正确操作顺序是 ;
(2)装置连接好后,在实验前还必需进行的操作 ;
(3)氯气有毒,为避免尾气对空气污染,需增加尾气吸收装置。
可供选择的试剂:A、AgNO3溶液,B、石灰水,C、NaOH溶液。
你认为最好选用 ,理由是:
c d a b
检查气密性
C
用AgNO3溶液成本太高,吸收速率较慢; 石灰水中Ca(OH)2量太少,吸收Cl2不完全。
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
③ NaClO+2HCl(浓)=NaCl+Cl2↑+H2O
④K2Cr2O7+14HCl(浓)=2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- = 2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl- = 3Cl2↑+3H2O
ClO-+2H++Cl- = Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- = 2Cr3++3Cl2↑+7H2O
拓展
其他制备Cl2的方法
“84”消毒液与洁厕灵不能混合使用
三、氯离子的检验
试剂:硝酸酸化的硝酸银溶液。
现象:产生不溶于硝酸的白色沉淀。
反应离子方程式为:Ag+ + Cl -=AgCl↓
实验2-9 Ag+ + Cl -=AgCl↓
2Ag+ + CO32-=Ag2CO3↓
Ag2CO3+ 2H+ = 2Ag+ + H2O + CO2↑
讨论:如果氯气泄露该采用什么防御办法?
※ (了解):其他X-(Br-、I-)的检验也用此法:
AgX↓颜色不同,AgBr↓浅黄色 、 AgI↓黄色
补充、氯化氢的实验室制法
1、反应原理:
NaCl(S)+ H2SO4(浓)=== NaHSO4 + HCl↑
微热
NaCl (S) + NaHSO4=== Na2SO4 + HCl↑
△
2NaCl (S) + H2SO4(浓)=== Na2SO4 + 2HCl↑
△
(3) NaCl可用别的金属氯化物代替。
注意:
(2)因为HCl极易溶于水,所以须用浓硫酸和氯化钠固体。
(1)该反应是利用了浓硫酸的高沸点。
高沸点酸 低沸点酸(难挥发性酸 易挥发性酸)
气体发生装置
收集装置
尾气处理装置
NaCl固体
浓硫酸
水
2、制取装置:
(1)收集HCl气体只能用向上排空气法收集。
(2)尾气处理时,连接的倒扣漏斗的作用是防止倒吸。
注意:
2、在实验室里,如没有浓盐酸,怎样制Cl2?
思考:1、还可通过哪些方式防止倒吸?
京沪高速公路淮安路段液氯的泄漏
新华网报道: 某年某月某日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
气味
溶解性
密度
毒性
