化学人教版(2019)选择性必修1 1.1.1反应热 焓变(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1反应热 焓变(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 36.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 00:00:00 | ||
图片预览






文档简介
(共27张PPT)
第一节 反应热
第1课时 反应热 焓变
第一章 化学反应的热效应
[学习目标]
1.了解反应热、焓变的定义;熟悉中和反应反应热的测定方法。
2.了解化学反应中能量变化的原因;掌握微观角度利用化学键键能数据来计算反应热的方法。
[重点难点]
1.宏观、微观理解反应热。
2.反应热的计算。
问题讨论
1. 化学反应中能量变化的主要形式?
热量的释放或吸收
一、反应热及其测定
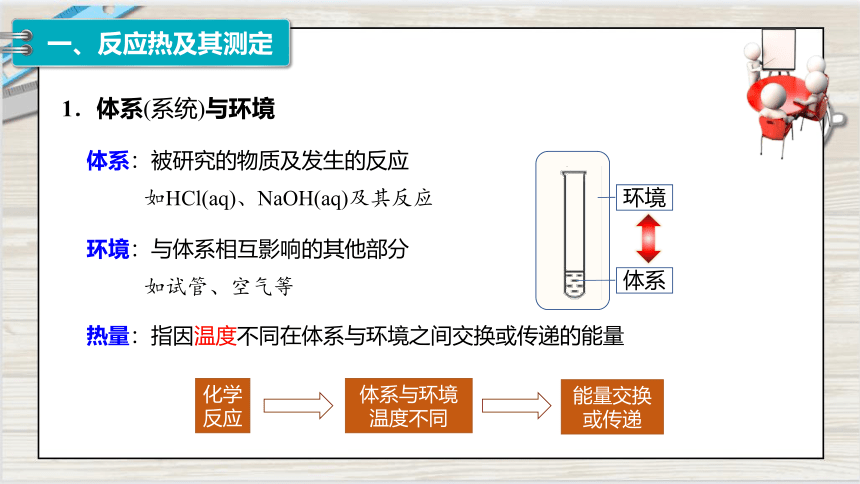
1.体系(系统)与环境
体系:被研究的物质及发生的反应
如HCl(aq)、NaOH(aq)及其反应
环境:与体系相互影响的其他部分
如试管、空气等
热量:指因温度不同在体系与环境之间交换或传递的能量
化学反应
体系与环境
温度不同
能量交换
或传递
体系
环境
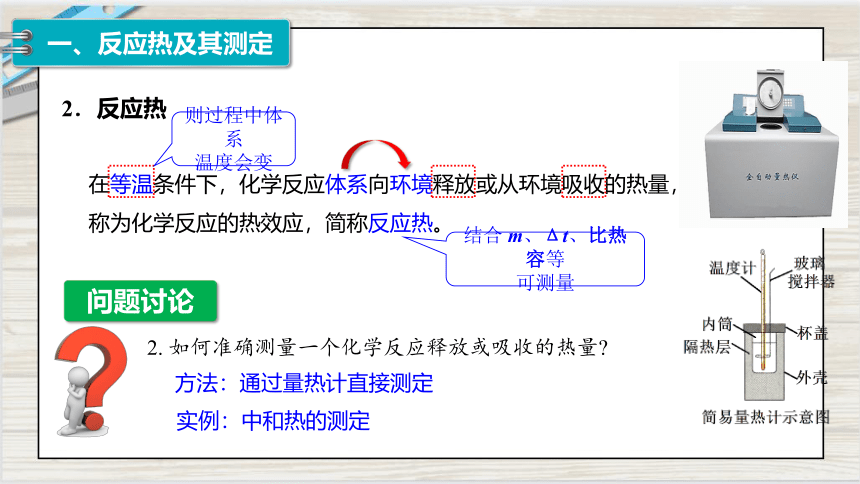
2.反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,
称为化学反应的热效应,简称反应热。
则过程中体系
温度会变
结合 m、Δt、比热容等
可测量
2. 如何准确测量一个化学反应释放或吸收的热量
方法:通过量热计直接测定
实例:中和热的测定
问题讨论
一、反应热及其测定
热容和比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高1 K时所吸收的热量称为该物质的热容。热容用符号c表示,其单位为J·K-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热。比热的单位为kJ·K-1·kg-1。常温下,液态水的比热为4.18 kJ·K-1·kg-1 。
资料卡片
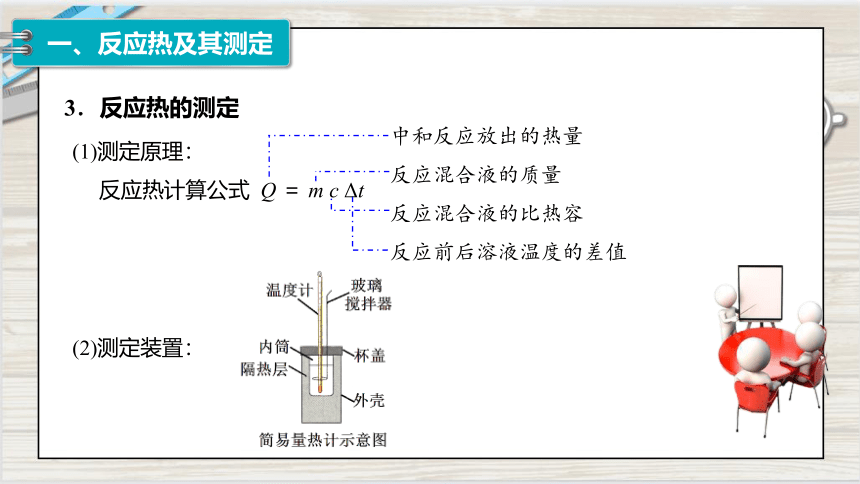
3.反应热的测定
(1)测定原理:
反应热计算公式 Q = m c Δt
中和反应放出的热量
反应混合液的质量
反应混合液的比热容
反应前后溶液温度的差值
(2)测定装置:
一、反应热及其测定
3.反应热的测定
视频导学
一、反应热及其测定
3.反应热的测定
数据处理:
[m(HCl) +m(NaOH)] c(T2-T1)
n(H2O)
Q=
(50 +50)g× 4.18 J/(g·℃)×3℃
0.05 L×0.5 mol/L
=
=50.16 kJ·mol-1
量热计自身吸收热量,实验测量的值会偏小。
一、反应热及其测定
3.反应热的测定
1. 为了提高测定的准确度,应该采取哪些措施?
问题讨论
……
①使用比较精确的温度计读出温度变化;
②需要保温装置,减少与外界发生热交换;
③搅拌器搅拌,保证溶液温度均匀;
一、反应热及其测定
3.反应热的测定
2.为什么采用碱稍过量的方法?
3.能不能用金属搅拌器代替玻璃搅拌器?
4.实验中是否可以更换温度计?
5.能否测完酸后直接测量碱的温度?
6.为什么将溶液迅速倒入内筒后,立即盖上杯盖?
7.能否将NaOH溶液分多次倒入量热计中?
问题讨论
因碱会吸收空气中的CO2,为保证盐酸完全被中和
不能。金属易导热,会造成热损
不能,会存在仪器误差
不能,残留的酸会与碱反应,造成热损。
减少热损
不能
一、反应热及其测定
请完成学案上的导思
大量的实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
量热器保温效果不好
溶液混合不够快速
反应不够充分
测量酸后温度计没冲洗就测量NaOH溶液的温度
误差分析
测得的数据小于57.3 kJ·mol-1,分析产生误差的可能原因是什么?
导思
授课老师可根据需要选择使用
二、反应热与焓变
化学反应中为什么会有反应热?
产生
反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
1.概念
内能:体系内物质的各种能量的总和, 符号U。
受温度、压强和物质的聚集状态等影响。
焓(H):与内能有关的物理量。
等压条件下反应热等于反应的焓变, 用符号ΔH表示。
焓变: ΔH=H生成物-H反应物 单位:kJ/mol或kJ·mol-1。
二、反应热与焓变
焓、焓变与放热反应、吸热反应的关系
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
二、反应热与焓变
2.理解
(1)宏观解释
二、反应热与焓变
2.理解
(2)微观解释(键能)
436 kJ·mol -1
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ·mol -1
键能:25 ℃、101 kPa,气态分子中1 mol化学键解离成气态原子所吸收的能量
二、反应热与焓变
2.理解
(2)微观解释(键能)
如何计算1 mol H2 与 1 mol Cl2生成2 mol HCl的反应热?
ΔH = 反应物的总键能-生成物的总键能
= (436+243) kJ·mol -1-2×431 kJ·mol -1
= ﹣183 kJ·mol -1
二、反应热与焓变
归纳总结
ΔH=H生成物-H反应物
ΔH=反应物的键能总和-生成物的键能总和
放热反应 吸热反应
反应热(ΔH) ΔH<0 ΔH>0
总能量 反应物>生成物 反应物<生成物
键能之和 反应物<生成物 反应物>生成物
二、反应热与焓变
请完成学案上的导思、导练
导思
授课老师可根据需要选择使用
根据图像回答下列问题:
(1)金刚石和石墨谁更稳定?
内能越低越稳定,则石墨更稳定。
(2)ΔH1与ΔH2相比,哪一个较大?
ΔH1较大,因为两者都是放热反应,放热越多,则焓变越小。
导练
授课老师可根据需要选择使用
(2022·邯郸高二检测)反应A2(g)+2BC(g)===2BA(g)+C2(g)过程中体系的能量变化如图所示,下列说法错误的是
A.E1等于拆开1 mol A2(g)中化学键和2 mol BC(g)中化学键所需能量之和
B.该反应的热效应ΔH=E1-E2
C.使用催化剂,该反应的ΔH不变
D.该反应既有极性键和非极性键的断裂又有极性键和非极性键的形成
√
自我测试
1.100 mL 1.0 mol·L-1盐酸与100 mL 1.0 mol·L-1 NaOH溶液在简易量热计装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热,测定实验时,下列说法正确的是
A.用100 mL 1.1 mol·L-1 NaOH溶液进行上述实验,对测得中和反应的反应热数值
无影响
B.用浓硫酸代替盐酸进行上述实验,测得中和反应的反应热数值无影响
C.测定时,用温度计测定NaOH溶液起始温度后可直接测定盐酸的温度
D.实验时,可用环形铜棒做搅拌器
√
自我测试
2.N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 mol N—N吸收193 kJ能量,形成N2(g)中1 mol N≡N放出941 kJ能量。下列说法正确的是
A.N4(g)比N2(g)更稳定
B.N4(g)===2N2(g) ΔH=+724 kJ·mol-1
C.形成1 mol N4(g)中的化学键放出193 kJ的能量
D.1 mol N2(g)完全转化为N4(g),体系的能量增加362 kJ
√
自我测试
3.(2021·福州期中)用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
(1)仪器A的名称___________;碎泡沫塑料的作用是______________________
_______________。
玻璃搅拌器
保温、隔热、减少实验
过程中热量损失
自我测试
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应的反应热,某学生实验记录数据如表:
实验序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.3 20.5 23.4
3 20.5 20.7 23.5
依据该学生的实验数据计算,该实验测得的中和反应的反应热
ΔH=________________(结果保留一位小数)。
-50.2 kJ·mol-1
第一节 反应热
第1课时 反应热 焓变
第一章 化学反应的热效应
[学习目标]
1.了解反应热、焓变的定义;熟悉中和反应反应热的测定方法。
2.了解化学反应中能量变化的原因;掌握微观角度利用化学键键能数据来计算反应热的方法。
[重点难点]
1.宏观、微观理解反应热。
2.反应热的计算。
问题讨论
1. 化学反应中能量变化的主要形式?
热量的释放或吸收
一、反应热及其测定
1.体系(系统)与环境
体系:被研究的物质及发生的反应
如HCl(aq)、NaOH(aq)及其反应
环境:与体系相互影响的其他部分
如试管、空气等
热量:指因温度不同在体系与环境之间交换或传递的能量
化学反应
体系与环境
温度不同
能量交换
或传递
体系
环境
2.反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,
称为化学反应的热效应,简称反应热。
则过程中体系
温度会变
结合 m、Δt、比热容等
可测量
2. 如何准确测量一个化学反应释放或吸收的热量
方法:通过量热计直接测定
实例:中和热的测定
问题讨论
一、反应热及其测定
热容和比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高1 K时所吸收的热量称为该物质的热容。热容用符号c表示,其单位为J·K-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热。比热的单位为kJ·K-1·kg-1。常温下,液态水的比热为4.18 kJ·K-1·kg-1 。
资料卡片
3.反应热的测定
(1)测定原理:
反应热计算公式 Q = m c Δt
中和反应放出的热量
反应混合液的质量
反应混合液的比热容
反应前后溶液温度的差值
(2)测定装置:
一、反应热及其测定
3.反应热的测定
视频导学
一、反应热及其测定
3.反应热的测定
数据处理:
[m(HCl) +m(NaOH)] c(T2-T1)
n(H2O)
Q=
(50 +50)g× 4.18 J/(g·℃)×3℃
0.05 L×0.5 mol/L
=
=50.16 kJ·mol-1
量热计自身吸收热量,实验测量的值会偏小。
一、反应热及其测定
3.反应热的测定
1. 为了提高测定的准确度,应该采取哪些措施?
问题讨论
……
①使用比较精确的温度计读出温度变化;
②需要保温装置,减少与外界发生热交换;
③搅拌器搅拌,保证溶液温度均匀;
一、反应热及其测定
3.反应热的测定
2.为什么采用碱稍过量的方法?
3.能不能用金属搅拌器代替玻璃搅拌器?
4.实验中是否可以更换温度计?
5.能否测完酸后直接测量碱的温度?
6.为什么将溶液迅速倒入内筒后,立即盖上杯盖?
7.能否将NaOH溶液分多次倒入量热计中?
问题讨论
因碱会吸收空气中的CO2,为保证盐酸完全被中和
不能。金属易导热,会造成热损
不能,会存在仪器误差
不能,残留的酸会与碱反应,造成热损。
减少热损
不能
一、反应热及其测定
请完成学案上的导思
大量的实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
量热器保温效果不好
溶液混合不够快速
反应不够充分
测量酸后温度计没冲洗就测量NaOH溶液的温度
误差分析
测得的数据小于57.3 kJ·mol-1,分析产生误差的可能原因是什么?
导思
授课老师可根据需要选择使用
二、反应热与焓变
化学反应中为什么会有反应热?
产生
反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
1.概念
内能:体系内物质的各种能量的总和, 符号U。
受温度、压强和物质的聚集状态等影响。
焓(H):与内能有关的物理量。
等压条件下反应热等于反应的焓变, 用符号ΔH表示。
焓变: ΔH=H生成物-H反应物 单位:kJ/mol或kJ·mol-1。
二、反应热与焓变
焓、焓变与放热反应、吸热反应的关系
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
二、反应热与焓变
2.理解
(1)宏观解释
二、反应热与焓变
2.理解
(2)微观解释(键能)
436 kJ·mol -1
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ·mol -1
键能:25 ℃、101 kPa,气态分子中1 mol化学键解离成气态原子所吸收的能量
二、反应热与焓变
2.理解
(2)微观解释(键能)
如何计算1 mol H2 与 1 mol Cl2生成2 mol HCl的反应热?
ΔH = 反应物的总键能-生成物的总键能
= (436+243) kJ·mol -1-2×431 kJ·mol -1
= ﹣183 kJ·mol -1
二、反应热与焓变
归纳总结
ΔH=H生成物-H反应物
ΔH=反应物的键能总和-生成物的键能总和
放热反应 吸热反应
反应热(ΔH) ΔH<0 ΔH>0
总能量 反应物>生成物 反应物<生成物
键能之和 反应物<生成物 反应物>生成物
二、反应热与焓变
请完成学案上的导思、导练
导思
授课老师可根据需要选择使用
根据图像回答下列问题:
(1)金刚石和石墨谁更稳定?
内能越低越稳定,则石墨更稳定。
(2)ΔH1与ΔH2相比,哪一个较大?
ΔH1较大,因为两者都是放热反应,放热越多,则焓变越小。
导练
授课老师可根据需要选择使用
(2022·邯郸高二检测)反应A2(g)+2BC(g)===2BA(g)+C2(g)过程中体系的能量变化如图所示,下列说法错误的是
A.E1等于拆开1 mol A2(g)中化学键和2 mol BC(g)中化学键所需能量之和
B.该反应的热效应ΔH=E1-E2
C.使用催化剂,该反应的ΔH不变
D.该反应既有极性键和非极性键的断裂又有极性键和非极性键的形成
√
自我测试
1.100 mL 1.0 mol·L-1盐酸与100 mL 1.0 mol·L-1 NaOH溶液在简易量热计装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热,测定实验时,下列说法正确的是
A.用100 mL 1.1 mol·L-1 NaOH溶液进行上述实验,对测得中和反应的反应热数值
无影响
B.用浓硫酸代替盐酸进行上述实验,测得中和反应的反应热数值无影响
C.测定时,用温度计测定NaOH溶液起始温度后可直接测定盐酸的温度
D.实验时,可用环形铜棒做搅拌器
√
自我测试
2.N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 mol N—N吸收193 kJ能量,形成N2(g)中1 mol N≡N放出941 kJ能量。下列说法正确的是
A.N4(g)比N2(g)更稳定
B.N4(g)===2N2(g) ΔH=+724 kJ·mol-1
C.形成1 mol N4(g)中的化学键放出193 kJ的能量
D.1 mol N2(g)完全转化为N4(g),体系的能量增加362 kJ
√
自我测试
3.(2021·福州期中)用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
(1)仪器A的名称___________;碎泡沫塑料的作用是______________________
_______________。
玻璃搅拌器
保温、隔热、减少实验
过程中热量损失
自我测试
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应的反应热,某学生实验记录数据如表:
实验序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.3 20.5 23.4
3 20.5 20.7 23.5
依据该学生的实验数据计算,该实验测得的中和反应的反应热
ΔH=________________(结果保留一位小数)。
-50.2 kJ·mol-1
