第四章第一节原子结构与元素周期表(共18张PPT) 第三课时原子结构与元素的性质课件2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章第一节原子结构与元素周期表(共18张PPT) 第三课时原子结构与元素的性质课件2022-2023学年上学期高一化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第四章、物质结构 元素周期律
第一节、原子结构与元素周期表
化学组 秦文平
第三课时 原子结构与元素的性质
知道碱金属元素、卤族元素的结构和性质,
能从原子结构角度解释同主族元素性质的递变规律。
1
能设计实验方案,探究同主族元素性质的递变规律。
2
学习目标
四、原子结构与元素的性质
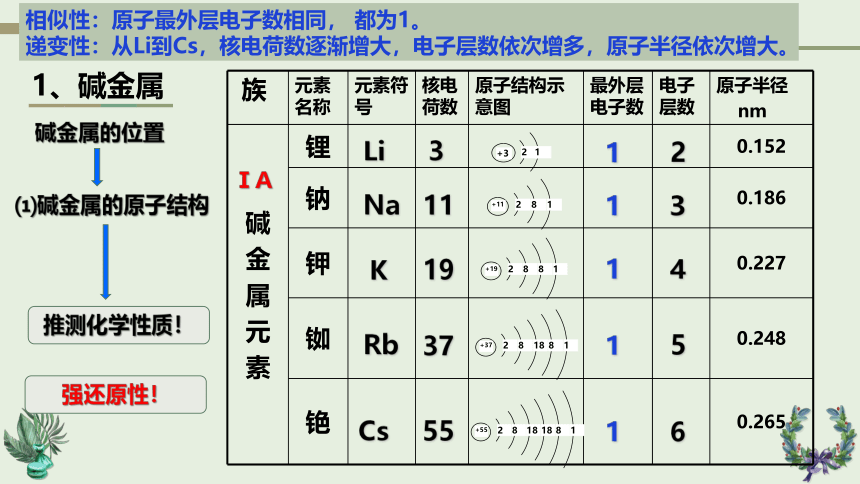
1、碱金属
⑴碱金属的原子结构
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径
nm
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
Na
K
Rb
Li
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
相似性:原子最外层电子数相同, 都为1。
递变性:从Li到Cs,核电荷数逐渐增大,电子层数依次增多,原子半径依次增大。
推测化学性质!
碱金属的位置
ⅠA
强还原性!
钾 钠
与氧气反应
根据实验现象填写下表:
比钠更剧烈,紫色火焰
剧烈燃烧,黄色火焰,生成淡黄色固体
钠在空气中的燃烧
钾在空气中的燃烧
①与O2反应:
(2)碱金属的化学性质
铷、铯等在空气中燃烧生成更复杂的氧化物。
K + O2 = KO2(超氧化钾)
△
4 Li + O2 = 2 Li2O
△
(注意:不是生成过氧化锂)
2Na + O2 = Na2O2
△
结论:从锂到铯,与氧气反应越来越剧烈生成的产物越来越复杂!
钠 钾
与水反应 (绿豆大小)
反应比钠更剧烈,反应放出的热使生成的氢气燃烧,并有轻微爆炸声
浮、熔、游、响、红
钾与水反应
钠与水反应
2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
通式:2R +2H2O = 2ROH + H2↑
②与水反应
浮、熔、游、爆、红
结论:从锂到铯,与水反应越来越剧烈,生成相应的碱及氢气!
结构 性质
相 似 性
递 变 性
相似性:碱金属均能与O2、H2O 等氧化剂反应。
递变性:从Li到Cs,反应越来越剧烈;与氧气反应产物不同。
碱金属的化学性质:
决 定
最外层只有一个电子
从Li→Cs,电子层数增多、原子半径增大
还原性(金属性)逐渐增强,与O2、H2O等反应越来越剧烈。
单质都是强还原剂;都能与O2、Cl2 、 H2O 、酸等反应。
碱金属的原子结构与化学性质的关系:
元素金属性强弱判断依据(记!)
①金属单质与水或酸反应置换出氢气越容易,元素金属性越强。
②最高价氧化物的水化物的碱性越强,元素金属性越强。
③根据金属活动性顺序判断:排在前面的金属元素其金属性比排在后面的强。
④金属阳离子的氧化性越强,则对应金属元素的金属性越弱。
⑤根据物质间的置换反应来判断,金属性(还原性) :还原剂>还原产物
⑥同一主族,从上到下:原子的金属性逐渐增强
⑦同一周期,从左到右:原子的金属性逐渐减弱
碱金属单质 颜色和状态 密度 g·㎝-3 熔点 ℃ 沸点
℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
(3)碱金属的物理性质
物理性质
相
似
性
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
银白色(Cs略带金色光泽)
较小
较小
较低
很好
逐渐增大(K、Na反常)
单质的熔沸点逐渐降低
碱金属常保持于煤油或石蜡油(锂只能储存在石蜡油)中
单质 颜色状态 (常态) 密度 熔点 (℃) 沸点
(℃)
F2 淡黄绿色气体 1.69g/l -219.6 -188.1
Cl2 黄绿色气体 3.214g/l -101 -34.6
Br2 深红棕色液体 3.12g/cm3 -7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
相似性:
递变性:
颜色逐渐加深,
状态:g→l→s,
密度逐渐增大,
熔沸点逐渐升高(与碱金属相反)
(1)卤族元素的物理性质
都是双原子分子,均有色、有毒、易溶于有机溶剂。
在水中的颜色 在有机溶剂(苯、CCl4、汽油)中的颜色
/ /
浅黄绿色 黄绿色
橙色 橙红色
棕黄色 紫色或紫红色
【注意】Br2是唯一一种在常温常压下为液态的非金属单质,易挥发,保存时用“水封”。
I2易升华,密封保存。能使淀粉变蓝。
2、卤族元素
(2)卤族结构
【思考与讨论】根据卤族元素的原子结构,试推测一下F、Cl、Br、I在化学性质上表现的相似性和递变性。
Cl
相似性
最外层7个电子
易得1个电子,具有氧化性
递变性
核电荷数递增
电子层数递增
原子半径依次增大
得到电子能力逐渐减弱,单质的氧化性逐渐减弱
非金属性逐渐减弱
原子结构
化学性质
HF很稳定
H2+F2=2HF
冷暗处爆炸
F2
HCl较稳定
H2+Cl2 = 2HCl
光照或点燃
Cl2
HBr不如HCl稳定
加热至500℃
Br2
HI不稳定
持续加热
I2
生成氢化物的
稳定性
化学方程式
反应条件
单质
生成氢化物的稳定性逐渐减弱
①与氢气的反应
F2 Cl2 Br2 I2
与H2反应难易程度逐渐减弱
H2+I2 2HI
△
H2+Br2 = 2HBr
△
△或光照
卤素的非金属性逐渐减弱
(3)卤素元素的化学性质:
②卤素单质间的置换反应
实验4-1 现象 化学方程式 实验结论
向KBr溶液中加入氯水
向KI溶液中加入氯水
向KI溶液中加入溴水
液体变成橙色
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
氧化性:Cl2>Br2>I2
2Br-+Cl2=2Cl-+Br2
液体变成棕色
液体变成褐色
2I-+Cl2=2Cl-+I2
2I-+Br2=2Br-+I2
(3)卤素元素的化学性质:
还原性:I->Br->Cl-
【实验4-1】
相似性:卤素单质均能与H2等还原剂反应,并能发生置换反应。
卤素元素的化学性质:
递变性:从F2到I2 ………
氧化性逐渐减弱,F2> Cl2 > Br2 > I2
离子的还原性逐渐增强,F - < Cl - < Br - < I -
氢化物的稳定性逐渐减弱:HF> HCl> HBr > HI
最高价氧化物的水化物的酸性逐渐减弱:HClO4> HBrO4 > HIO4
氢化物酸性逐渐增强:HF①与H2化合越容易,非金属性越强
②形成气态氢化物越稳定,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
⑥同一主族,从上到下,非金属性逐渐减弱。
④非金属阴离子还原性越强,其非金属性越弱
⑤非金属单质间的置换反应判断,氧化性:氧化剂>氧化产物
元素非金属性强弱判断依据(记!)
⑦同一周期,从左到右,非金属性逐渐增强;
同一主族元素,
无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
失电子的能力逐渐增强,得电子的能力逐渐减弱
金属性逐渐增强,非金属性逐渐减弱
通过对同主族元素(IA、VIIA)的分析,可得以下结论:
核外电子层数依次增多,原子半径逐渐增大
周期表中金属性最强的元素是?非金属性最强的元素是?
③卤素单质(X2=Cl2 、 Br2 、 I2)与水反应
(3)卤素元素的化学性质:
Cl2+H2O HCl+HClO
X2+H2O HX+HXO
2F2+2H2O = 4HF+O2
结论:从F2到I2 与反应越来越微弱
④卤素单质(X2=Cl2 、 Br2 )与碱溶液反应
(3)卤素元素的化学性质:
Cl2+2NaOH = NaCl+NaClO+H2O
Br2+2NaOH = NaBr+NaBrO+H2O
第四章、物质结构 元素周期律
第一节、原子结构与元素周期表
化学组 秦文平
第三课时 原子结构与元素的性质
知道碱金属元素、卤族元素的结构和性质,
能从原子结构角度解释同主族元素性质的递变规律。
1
能设计实验方案,探究同主族元素性质的递变规律。
2
学习目标
四、原子结构与元素的性质
1、碱金属
⑴碱金属的原子结构
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径
nm
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
+3
2
1
+11
2
8
1
+19
2
8
8
1
+37
2
8
18
8
1
+55
2
8
18
18
8
1
Na
K
Rb
Li
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
相似性:原子最外层电子数相同, 都为1。
递变性:从Li到Cs,核电荷数逐渐增大,电子层数依次增多,原子半径依次增大。
推测化学性质!
碱金属的位置
ⅠA
强还原性!
钾 钠
与氧气反应
根据实验现象填写下表:
比钠更剧烈,紫色火焰
剧烈燃烧,黄色火焰,生成淡黄色固体
钠在空气中的燃烧
钾在空气中的燃烧
①与O2反应:
(2)碱金属的化学性质
铷、铯等在空气中燃烧生成更复杂的氧化物。
K + O2 = KO2(超氧化钾)
△
4 Li + O2 = 2 Li2O
△
(注意:不是生成过氧化锂)
2Na + O2 = Na2O2
△
结论:从锂到铯,与氧气反应越来越剧烈生成的产物越来越复杂!
钠 钾
与水反应 (绿豆大小)
反应比钠更剧烈,反应放出的热使生成的氢气燃烧,并有轻微爆炸声
浮、熔、游、响、红
钾与水反应
钠与水反应
2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
通式:2R +2H2O = 2ROH + H2↑
②与水反应
浮、熔、游、爆、红
结论:从锂到铯,与水反应越来越剧烈,生成相应的碱及氢气!
结构 性质
相 似 性
递 变 性
相似性:碱金属均能与O2、H2O 等氧化剂反应。
递变性:从Li到Cs,反应越来越剧烈;与氧气反应产物不同。
碱金属的化学性质:
决 定
最外层只有一个电子
从Li→Cs,电子层数增多、原子半径增大
还原性(金属性)逐渐增强,与O2、H2O等反应越来越剧烈。
单质都是强还原剂;都能与O2、Cl2 、 H2O 、酸等反应。
碱金属的原子结构与化学性质的关系:
元素金属性强弱判断依据(记!)
①金属单质与水或酸反应置换出氢气越容易,元素金属性越强。
②最高价氧化物的水化物的碱性越强,元素金属性越强。
③根据金属活动性顺序判断:排在前面的金属元素其金属性比排在后面的强。
④金属阳离子的氧化性越强,则对应金属元素的金属性越弱。
⑤根据物质间的置换反应来判断,金属性(还原性) :还原剂>还原产物
⑥同一主族,从上到下:原子的金属性逐渐增强
⑦同一周期,从左到右:原子的金属性逐渐减弱
碱金属单质 颜色和状态 密度 g·㎝-3 熔点 ℃ 沸点
℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
(3)碱金属的物理性质
物理性质
相
似
性
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
银白色(Cs略带金色光泽)
较小
较小
较低
很好
逐渐增大(K、Na反常)
单质的熔沸点逐渐降低
碱金属常保持于煤油或石蜡油(锂只能储存在石蜡油)中
单质 颜色状态 (常态) 密度 熔点 (℃) 沸点
(℃)
F2 淡黄绿色气体 1.69g/l -219.6 -188.1
Cl2 黄绿色气体 3.214g/l -101 -34.6
Br2 深红棕色液体 3.12g/cm3 -7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
相似性:
递变性:
颜色逐渐加深,
状态:g→l→s,
密度逐渐增大,
熔沸点逐渐升高(与碱金属相反)
(1)卤族元素的物理性质
都是双原子分子,均有色、有毒、易溶于有机溶剂。
在水中的颜色 在有机溶剂(苯、CCl4、汽油)中的颜色
/ /
浅黄绿色 黄绿色
橙色 橙红色
棕黄色 紫色或紫红色
【注意】Br2是唯一一种在常温常压下为液态的非金属单质,易挥发,保存时用“水封”。
I2易升华,密封保存。能使淀粉变蓝。
2、卤族元素
(2)卤族结构
【思考与讨论】根据卤族元素的原子结构,试推测一下F、Cl、Br、I在化学性质上表现的相似性和递变性。
Cl
相似性
最外层7个电子
易得1个电子,具有氧化性
递变性
核电荷数递增
电子层数递增
原子半径依次增大
得到电子能力逐渐减弱,单质的氧化性逐渐减弱
非金属性逐渐减弱
原子结构
化学性质
HF很稳定
H2+F2=2HF
冷暗处爆炸
F2
HCl较稳定
H2+Cl2 = 2HCl
光照或点燃
Cl2
HBr不如HCl稳定
加热至500℃
Br2
HI不稳定
持续加热
I2
生成氢化物的
稳定性
化学方程式
反应条件
单质
生成氢化物的稳定性逐渐减弱
①与氢气的反应
F2 Cl2 Br2 I2
与H2反应难易程度逐渐减弱
H2+I2 2HI
△
H2+Br2 = 2HBr
△
△或光照
卤素的非金属性逐渐减弱
(3)卤素元素的化学性质:
②卤素单质间的置换反应
实验4-1 现象 化学方程式 实验结论
向KBr溶液中加入氯水
向KI溶液中加入氯水
向KI溶液中加入溴水
液体变成橙色
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
氧化性:Cl2>Br2>I2
2Br-+Cl2=2Cl-+Br2
液体变成棕色
液体变成褐色
2I-+Cl2=2Cl-+I2
2I-+Br2=2Br-+I2
(3)卤素元素的化学性质:
还原性:I->Br->Cl-
【实验4-1】
相似性:卤素单质均能与H2等还原剂反应,并能发生置换反应。
卤素元素的化学性质:
递变性:从F2到I2 ………
氧化性逐渐减弱,F2> Cl2 > Br2 > I2
离子的还原性逐渐增强,F - < Cl - < Br - < I -
氢化物的稳定性逐渐减弱:HF> HCl> HBr > HI
最高价氧化物的水化物的酸性逐渐减弱:HClO4> HBrO4 > HIO4
氢化物酸性逐渐增强:HF
②形成气态氢化物越稳定,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
⑥同一主族,从上到下,非金属性逐渐减弱。
④非金属阴离子还原性越强,其非金属性越弱
⑤非金属单质间的置换反应判断,氧化性:氧化剂>氧化产物
元素非金属性强弱判断依据(记!)
⑦同一周期,从左到右,非金属性逐渐增强;
同一主族元素,
无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
失电子的能力逐渐增强,得电子的能力逐渐减弱
金属性逐渐增强,非金属性逐渐减弱
通过对同主族元素(IA、VIIA)的分析,可得以下结论:
核外电子层数依次增多,原子半径逐渐增大
周期表中金属性最强的元素是?非金属性最强的元素是?
③卤素单质(X2=Cl2 、 Br2 、 I2)与水反应
(3)卤素元素的化学性质:
Cl2+H2O HCl+HClO
X2+H2O HX+HXO
2F2+2H2O = 4HF+O2
结论:从F2到I2 与反应越来越微弱
④卤素单质(X2=Cl2 、 Br2 )与碱溶液反应
(3)卤素元素的化学性质:
Cl2+2NaOH = NaCl+NaClO+H2O
Br2+2NaOH = NaBr+NaBrO+H2O
