鲁科版(2019)必修第二册 2.1.化学键与物质构成课件(共75张PPT)
文档属性
| 名称 | 鲁科版(2019)必修第二册 2.1.化学键与物质构成课件(共75张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 00:00:00 | ||
图片预览










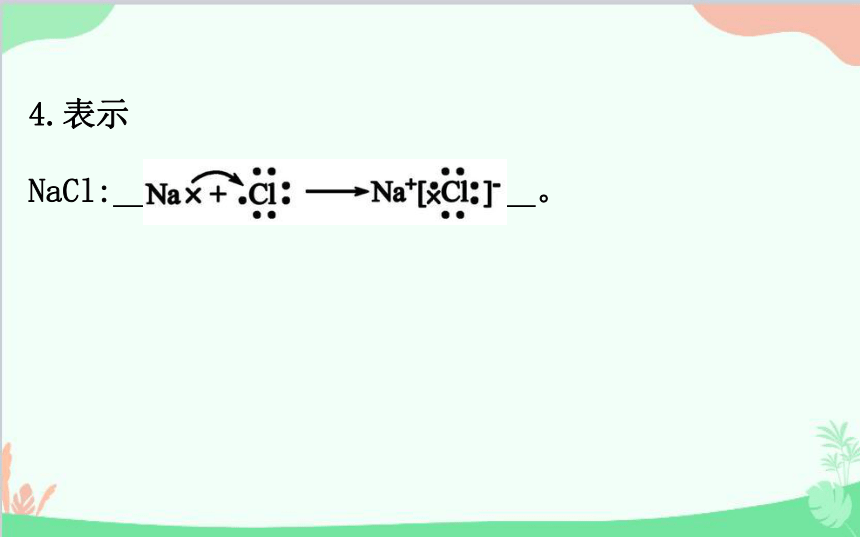

文档简介
(共77张PPT)
第2章 化学键 化学反应规律
第1节 化学键与物质构成
一、化学键
1.化学键:_______________________。
2.化学键与化学反应的关系
化学变化的实质是___________________________。
相邻原子间的强相互作用
旧化学键断裂和新化学键形成
【情境·思考】
同学们一定看过86版的《西游记》吧,那烟雾缭绕、美轮美奂、如入仙境的画面是不是让你记忆特别深刻呢 你知道这种画面是怎么制造出来的吗 原来,这都离不开一种叫干冰的物质。
干冰就是固体二氧化碳,很多舞台为增加效果都使用干冰制造烟雾。请问在干冰变为烟雾的过程中有无化学键的断裂
提示:没有。干冰变为烟雾的过程是物理变化,只是分子间距离变大,分子间不存在化学键。
3.化学键与能量的关系
化学键的断裂与形成伴随着能量的变化,旧化学键断裂
需要_________,新化学键形成会_________。
吸收能量
释放能量
【微思考】
有能量变化的过程是否一定是化学变化
提示:不一定。物质的三态变化伴随着能量的变化,但不是化学变化。
二、离子键
1.形成(以NaCl为例)
2.含义
离子键是指_____________________________________
___。
3.形成原子
形成离子键的原子一般是_________________________
_________。
阴、阳离子之间通过静电作用形成的化学
键
活泼的金属原子和活泼的非
金属原子
4.表示
NaCl: 。
三、共价键
1.形成(以HCl为例)
2.含义
共价键是指_________________________________。
3.形成原子
形成共价键的原子一般是活泼的___________。
4.表示
HCl:_________________。
原子之间通过共用电子形成的化学键
非金属原子
5.共价键类型
(1)极性键:由不同非金属原子形成的共价键,如H—Cl键、N—H键;
(2)非极性键:由相同非金属原子形成的共价键,如H—H键、Cl—Cl键。
6.由共价键形成的分子的空间结构
CO2 H2O NH3 CH4
空间
结构 _____形 ___形 _____
___形 _______
___形
键角 180° 104.5° 107.3° 109°28'
直线
角
三角
锥
正四面
体
【巧判断】
(1)离子键是阴、阳离子间的相互吸引作用。 ( )
提示:×。离子键是阴、阳离子间的静电作用,既包括静电吸引又包括静电排斥。
(2)由电离方程式HCl====H++Cl-可知,HCl分子中存在离子键。 ( )
提示:×。HCl分子中存在的是共价键,HCl溶于水后共价键被破坏,形成离子。
(3)NaOH中含有离子键和共价键。 ( )
提示:√。NaOH中Na+和OH-之间存在的是离子键,OH-中氧和氢原子之间存在的是共价键。
四、离子化合物与共价化合物
根据物质的构成将化合物分为两类:
【做一做】
请分析所给化合物的构成情况和化合物类型
化合物 形成化学
键的微粒 化学键类型 化合物
类型
氯化镁 _________ _______ _____
_______
甲烷 _________
_______ _______ _____
_______
Mg2+、Cl-
离子键
离子
化合物
碳原子、
氢原子
共价键
共价
化合物
【情境·思考】
纯碱和食醋是我们日常生活中常用的调味品,它们的主要成分分别为Na2CO3、CH3COOH,判断它们属于离子化合物还是共价化合物,并指出其中含有的化学键类型。
提示:Na2CO3属于离子化合物,其中含有离子键和共价键;CH3COOH属于共价化合物,其中只含有共价键。
知识点一 离子化合物和共价化合物的类别与性质
【重点释疑】
1.离子化合物
(1)常见类型
①强碱:如NaOH、KOH等。
②绝大多数盐:如NaCl、K2SO4等。
③活泼金属氧化物、氢化物和过氧化物:如K2O、Na2O、MgO、NaH、CaH2、Na2O2等。
(2)性质
①离子化合物中离子键一般比较牢固,破坏它需要很高的能量,所以离子化合物的熔点一般较高,常温下为固体。
②离子化合物在溶于水或受热熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电。
2.共价化合物
(1)常见类型
①非金属氢化物:如NH3、H2S、H2O等。
②非金属氧化物:如CO、CO2、SO2等。
③酸:如H2SO4、HNO3等。
④大多数有机化合物:如CH4、CH3CH2OH等。
(2)性质
对于由分子组成的物质,由于分子间没有化学键,所以作用力比较小,熔沸点、硬度均比较小。
【易错提醒】化学键与物质类别的关系
(1)四个“一定”
①离子化合物中一定含有离子键,可能含有共价键,如NaOH、Na2O2、(NH4)2SO4等。
②含有离子键的物质一定是离子化合物。
③离子化合物中一定含有阴离子和阳离子。
④共价化合物中一定不含离子键,只含共价键。
(2)四个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
③含有共价键的化合物不一定是共价化合物,如NaOH、Na2O2等。
④含有共价键的分子不一定是共价化合物,如H2、O2等单质。
【思考·讨论】
(1)如何检验某化合物属于离子化合物还是共价化合物
提示:离子化合物在溶于水或者熔融时均可以电离出阴、阳离子,而共价化合物在熔融时仍然以分子形式存在,不存在阴、阳离子。
(2)已知HNO3、NaCl、乙醇、蔗糖均可溶于水。
①HNO3、NaCl溶于水时,化学键有无变化
提示:化学键发生断裂。当HNO3、NaCl溶于水时,在水
分子的作用下共价键和离子键发生了断裂,分别电离为
H+和 、Na+和Cl-。
②乙醇、蔗糖溶于水时,化学键有无变化
提示:化学键没有变化。由于乙醇、蔗糖属于非电解质,因此溶于水时不会电离,以分子形式存在于水中,因此化学键没有变化。
【案例示范】
【典例】(2019·泰安高一检测)现有如下几种说法:
①在水中氢、氧原子间均以化学键相结合;②金属和
非金属化合时一定形成离子键;③根据电离方程式
HCl====H++Cl-判断,HCl分子里存在离子键;④ H2分
子和Cl2分子的反应过程是H2、Cl2分子里共价键发生
断裂生成氢原子、氯原子,而后氢原子、氯原子形成离子键的过程。其中正确的说法是 ( )
A.①②④ B.都不正确 C.④ D.①
【解题指南】解答本题需注意以下两点:
(1)化学键是相邻原子间的强烈的相互作用。
(2)化学反应是一个旧键断裂、新键形成的过程。
【解析】选B。水分子内H、O原子之间形成化学键,分子间的H、O原子间不形成化学键,故①不正确;只有活泼金属和活泼非金属化合时才形成离子键,故②不正确;HCl属于共价化合物,分子中没有离子键,故③不正确;化学反应的本质是旧键断裂,新键形成的过程,但HCl中存在共价键而非离子键,故④不正确。
【母题追问】(1)只有非金属元素组成的化合物中能含
有离子键吗
提示:能。如NH4Cl中 、Cl-之间的化学键是离子
键。
(2)HCl溶于水电离时,分子中化学键发生了断裂,说明HCl的电离是化学变化吗
提示:不是。化学变化中既有旧化学键的断裂,也有新化学键形成,而上述过程中仅有旧键的断裂没有新键的形成,因此不属于化学变化。
【规律方法】离子键与共价键的比较
离 子 键 共 价 键
成键实质 阴、阳离子之间的静电作用 形成共用电子
成键元素 一般是活泼金属元素和活泼非金属元素 一般是非金属元素
成键微粒 阴、阳离子 原子
离 子 键 共 价 键
形成过程
举例
离 子 键 共 价 键
存在范围 只存在于离子化合物中 可存在于非金属单质(稀有气体除外)、共价化合物及部分离子化合物中
实例 强碱、大多数盐、活泼金属的氧化物 含氧酸、非金属的氢化物、非金属氧化物、大多数有机化合物
【迁移·应用】
1.(2019·南阳高一检测)下表物质与其所含化学键类型、所属化合物类型完全正确的一组是 ( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
所含化学
键类型 离子键、
共价键 共价键 离子键 离子键、
共价键
所属化合
物类型 离子化合物 共价化
合物 离子化
合物 共价化合物
【解析】选B。A项,MgCl2仅含离子键;C项,HCl仅含共价键,是共价化合物;D项,NaOH含有离子键,是离子化合物。
2.(2018·山东合格考)下列关于化学键的说法正确的是 ( )
A.共价化合物中只存在共价键
B.离子化合物中只存在离子键
C.只含共价键的物质一定是共价化合物
D.只含非金属元素的物质一定不含离子键
【解析】选A。离子化合物中可能含有共价键,如氢氧化钠,B错误;只含共价键的物质可以是单质,如氮气,C错误;氯化铵中含有离子键,D错误。
【补偿训练】
(2019·日照高一检测)下列说法正确的是 ( )
A.P4和NO2都是共价化合物
B.CCl4和NH3分子中都只含有共价键
C.CaO和SiO2都是离子化合物
D.Na2O2是离子化合物,只含有离子键
【解析】选B。P4和NO2分子中都含有共价键,但P4是磷
的单质,A错;CCl4、NH3分子中都只含共价键,B正确;
CaO是离子化合物,SiO2是共价化合物,C错;Na2O2中
是通过共价键形成的,所以Na2O2中既有离子键又有共
价键,D错。
【素养提升】
我国是酒的故乡,也是酒文化的发源地,是世界上酿酒最早的国家之一。
已知酒的主要成分为乙醇,其分子式为C2H6O,分子结构如下所示:
请你判断乙醇属于离子化合物还是共价化合物,46 g乙醇中含有共价键的数目是多少
提示:乙醇属于共价化合物,其中1个乙醇分子中含有8个共价键,因此46 g乙醇中含有8NA个共价键。
知识点二 电子式
【重点释疑】
1.含义:一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
2.电子式的书写
(1)原子的电子式:
元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。例如:
(2)简单阳离子的电子式:
简单阳离子是由金属原子失去电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如Na+、Mg2+、Al3+等。
(3)简单阴离子的电子式:
不但要画出最外层电子数,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。例如:
(4)复杂阴、阳离子的电子式:
复杂阴、阳离子要标明电子,用“[ ]”括上,并在“[ ]”右上角标明电性和电量,例如:
(5)离子化合物的电子式:
(6)共价化合物的电子式:
3.用电子式表示下列物质的形成过程
【易错提醒】用电子式表示离子化合物或离子化合物
的形成过程时,易出现的错误
(1)漏标阴离子的括号,如将S2-的电子式错写为
(2)给阳离子多标电子或中括号,如将Al3+的电子式错写
为
(3)漏标或错标离子的电荷,如将S2-的电子式错写为
(4)将多个相同的离子归在一起,如将K2S的电子式错写
为
【思考·讨论】
(1)氯化钠和氯化氢的电子式NaCl: HCl:
书写是否正确
提示:NaCl属于离子化合物,HCl属于共价化合物,二者的
表示形式颠倒了。
(2)阳离子的电子式均是其离子符号吗
提示:简单阳离子的电子式为其离子符号,复杂阳离子如铵根离子的电子式不能用其离子符号来表示。
【案例示范】
【典例】过氧化氢(H2O2)又叫双氧水,其水溶液可用于
制备工业上的漂白剂、特殊环境里燃料燃烧的助燃
剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化
钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制
氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团
“ ”由2个氧原子共用1对电子形成。
(1)试根据叙述写出二者的电子式。(宏观辨识与微观探析)
(2)已知同种原子形成的共价键叫非极性共价键,不同种原子形成的共价键叫极性共价键,试讨论:H2O、H2O2中化学键有何不同 Na2O、Na2O2中化学键有何不同 (证据推理与模型认知)
(3)分别写出H2O2、Na2O2作供氧剂反应的化学方程式,根据方程式比较H2O2、Na2O2中化学键更稳定的是哪个,主要根据是什么 (科学探究与创新意识)
【解析】(1)H2O2与Na2O2中都含有过氧基“—O—O—”。
题中告知“—O—O—”由2个O共用1对电子形成,又知H
的化合价为+1价,则H与O之间共用1对电子,这样就可以
写出H2O2的电子式。比较H2O2与Na2O2,Na的化合价也是
+1价,但Na与O之间的化学键应是离子键而不是共价键,
则Na2O2是由“ ”与“Na+”构成的。
(2)比较H2O与H2O2的电子式可知,水中有极性共价键,过氧化氢中有极性和非极性共价键;比较Na2O与Na2O2的电子式可知氧化钠中有离子键,过氧化钠中既有离子键又有非极性共价键。
(3)由Na2O2在常温下跟水(或CO2)快速反应生成O2,H2O2的水溶液在催化剂作用下才能较快地反应生成O2,由此可知过氧化氢中化学键较稳定。
答案:
(2)H2O中没有非极性键,H2O2中有非极性键;Na2O中没有共价键,Na2O2中有共价键(或非极性键)
(3)2H2O2 2H2O+O2↑,2Na2O2+2H2O====4NaOH+
O2↑(或2Na2O2+2CO2====2Na2CO3+O2),H2O2中化学键更稳
定;Na2O2在常温下跟水(或CO2)快速反应生成O2,H2O2的水
溶液在催化剂作用下才能较快地反应生成O2
【规律方法】化学键的存在与判断
(1)离子化合物一定含有离子键,含有离子键的化合物一定是离子化合物。离子化合物还可能含共价键(极性键或非极性键)。
(2)共价化合物一定含有共价键,含有共价键的物质不一定是共价化合物,可能是非金属单质或离子化合物,如Cl2、NaOH等。
【迁移·应用】
1.(2018·北京市合格考)下列物质的电子式书写正确的是( )
【解析】选D。A中每个氮原子缺两个电子,错误;B为共价化合物,不能带电荷,错误;C为离子化合物,应该带电荷,错误。
2.下列电子式或用电子式表示化合物形成过程正确的是 ( )世纪金榜导学号
【解析】选D。A项中的正确写法应为 B项
中氯原子最外层电子没写全;C项中生成物中的2个
要分开写在Mg2+的两侧,不能合并写;D项符合
电子式的书写要求。
【课堂回眸】
第2章 化学键 化学反应规律
第1节 化学键与物质构成
一、化学键
1.化学键:_______________________。
2.化学键与化学反应的关系
化学变化的实质是___________________________。
相邻原子间的强相互作用
旧化学键断裂和新化学键形成
【情境·思考】
同学们一定看过86版的《西游记》吧,那烟雾缭绕、美轮美奂、如入仙境的画面是不是让你记忆特别深刻呢 你知道这种画面是怎么制造出来的吗 原来,这都离不开一种叫干冰的物质。
干冰就是固体二氧化碳,很多舞台为增加效果都使用干冰制造烟雾。请问在干冰变为烟雾的过程中有无化学键的断裂
提示:没有。干冰变为烟雾的过程是物理变化,只是分子间距离变大,分子间不存在化学键。
3.化学键与能量的关系
化学键的断裂与形成伴随着能量的变化,旧化学键断裂
需要_________,新化学键形成会_________。
吸收能量
释放能量
【微思考】
有能量变化的过程是否一定是化学变化
提示:不一定。物质的三态变化伴随着能量的变化,但不是化学变化。
二、离子键
1.形成(以NaCl为例)
2.含义
离子键是指_____________________________________
___。
3.形成原子
形成离子键的原子一般是_________________________
_________。
阴、阳离子之间通过静电作用形成的化学
键
活泼的金属原子和活泼的非
金属原子
4.表示
NaCl: 。
三、共价键
1.形成(以HCl为例)
2.含义
共价键是指_________________________________。
3.形成原子
形成共价键的原子一般是活泼的___________。
4.表示
HCl:_________________。
原子之间通过共用电子形成的化学键
非金属原子
5.共价键类型
(1)极性键:由不同非金属原子形成的共价键,如H—Cl键、N—H键;
(2)非极性键:由相同非金属原子形成的共价键,如H—H键、Cl—Cl键。
6.由共价键形成的分子的空间结构
CO2 H2O NH3 CH4
空间
结构 _____形 ___形 _____
___形 _______
___形
键角 180° 104.5° 107.3° 109°28'
直线
角
三角
锥
正四面
体
【巧判断】
(1)离子键是阴、阳离子间的相互吸引作用。 ( )
提示:×。离子键是阴、阳离子间的静电作用,既包括静电吸引又包括静电排斥。
(2)由电离方程式HCl====H++Cl-可知,HCl分子中存在离子键。 ( )
提示:×。HCl分子中存在的是共价键,HCl溶于水后共价键被破坏,形成离子。
(3)NaOH中含有离子键和共价键。 ( )
提示:√。NaOH中Na+和OH-之间存在的是离子键,OH-中氧和氢原子之间存在的是共价键。
四、离子化合物与共价化合物
根据物质的构成将化合物分为两类:
【做一做】
请分析所给化合物的构成情况和化合物类型
化合物 形成化学
键的微粒 化学键类型 化合物
类型
氯化镁 _________ _______ _____
_______
甲烷 _________
_______ _______ _____
_______
Mg2+、Cl-
离子键
离子
化合物
碳原子、
氢原子
共价键
共价
化合物
【情境·思考】
纯碱和食醋是我们日常生活中常用的调味品,它们的主要成分分别为Na2CO3、CH3COOH,判断它们属于离子化合物还是共价化合物,并指出其中含有的化学键类型。
提示:Na2CO3属于离子化合物,其中含有离子键和共价键;CH3COOH属于共价化合物,其中只含有共价键。
知识点一 离子化合物和共价化合物的类别与性质
【重点释疑】
1.离子化合物
(1)常见类型
①强碱:如NaOH、KOH等。
②绝大多数盐:如NaCl、K2SO4等。
③活泼金属氧化物、氢化物和过氧化物:如K2O、Na2O、MgO、NaH、CaH2、Na2O2等。
(2)性质
①离子化合物中离子键一般比较牢固,破坏它需要很高的能量,所以离子化合物的熔点一般较高,常温下为固体。
②离子化合物在溶于水或受热熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电。
2.共价化合物
(1)常见类型
①非金属氢化物:如NH3、H2S、H2O等。
②非金属氧化物:如CO、CO2、SO2等。
③酸:如H2SO4、HNO3等。
④大多数有机化合物:如CH4、CH3CH2OH等。
(2)性质
对于由分子组成的物质,由于分子间没有化学键,所以作用力比较小,熔沸点、硬度均比较小。
【易错提醒】化学键与物质类别的关系
(1)四个“一定”
①离子化合物中一定含有离子键,可能含有共价键,如NaOH、Na2O2、(NH4)2SO4等。
②含有离子键的物质一定是离子化合物。
③离子化合物中一定含有阴离子和阳离子。
④共价化合物中一定不含离子键,只含共价键。
(2)四个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
③含有共价键的化合物不一定是共价化合物,如NaOH、Na2O2等。
④含有共价键的分子不一定是共价化合物,如H2、O2等单质。
【思考·讨论】
(1)如何检验某化合物属于离子化合物还是共价化合物
提示:离子化合物在溶于水或者熔融时均可以电离出阴、阳离子,而共价化合物在熔融时仍然以分子形式存在,不存在阴、阳离子。
(2)已知HNO3、NaCl、乙醇、蔗糖均可溶于水。
①HNO3、NaCl溶于水时,化学键有无变化
提示:化学键发生断裂。当HNO3、NaCl溶于水时,在水
分子的作用下共价键和离子键发生了断裂,分别电离为
H+和 、Na+和Cl-。
②乙醇、蔗糖溶于水时,化学键有无变化
提示:化学键没有变化。由于乙醇、蔗糖属于非电解质,因此溶于水时不会电离,以分子形式存在于水中,因此化学键没有变化。
【案例示范】
【典例】(2019·泰安高一检测)现有如下几种说法:
①在水中氢、氧原子间均以化学键相结合;②金属和
非金属化合时一定形成离子键;③根据电离方程式
HCl====H++Cl-判断,HCl分子里存在离子键;④ H2分
子和Cl2分子的反应过程是H2、Cl2分子里共价键发生
断裂生成氢原子、氯原子,而后氢原子、氯原子形成离子键的过程。其中正确的说法是 ( )
A.①②④ B.都不正确 C.④ D.①
【解题指南】解答本题需注意以下两点:
(1)化学键是相邻原子间的强烈的相互作用。
(2)化学反应是一个旧键断裂、新键形成的过程。
【解析】选B。水分子内H、O原子之间形成化学键,分子间的H、O原子间不形成化学键,故①不正确;只有活泼金属和活泼非金属化合时才形成离子键,故②不正确;HCl属于共价化合物,分子中没有离子键,故③不正确;化学反应的本质是旧键断裂,新键形成的过程,但HCl中存在共价键而非离子键,故④不正确。
【母题追问】(1)只有非金属元素组成的化合物中能含
有离子键吗
提示:能。如NH4Cl中 、Cl-之间的化学键是离子
键。
(2)HCl溶于水电离时,分子中化学键发生了断裂,说明HCl的电离是化学变化吗
提示:不是。化学变化中既有旧化学键的断裂,也有新化学键形成,而上述过程中仅有旧键的断裂没有新键的形成,因此不属于化学变化。
【规律方法】离子键与共价键的比较
离 子 键 共 价 键
成键实质 阴、阳离子之间的静电作用 形成共用电子
成键元素 一般是活泼金属元素和活泼非金属元素 一般是非金属元素
成键微粒 阴、阳离子 原子
离 子 键 共 价 键
形成过程
举例
离 子 键 共 价 键
存在范围 只存在于离子化合物中 可存在于非金属单质(稀有气体除外)、共价化合物及部分离子化合物中
实例 强碱、大多数盐、活泼金属的氧化物 含氧酸、非金属的氢化物、非金属氧化物、大多数有机化合物
【迁移·应用】
1.(2019·南阳高一检测)下表物质与其所含化学键类型、所属化合物类型完全正确的一组是 ( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
所含化学
键类型 离子键、
共价键 共价键 离子键 离子键、
共价键
所属化合
物类型 离子化合物 共价化
合物 离子化
合物 共价化合物
【解析】选B。A项,MgCl2仅含离子键;C项,HCl仅含共价键,是共价化合物;D项,NaOH含有离子键,是离子化合物。
2.(2018·山东合格考)下列关于化学键的说法正确的是 ( )
A.共价化合物中只存在共价键
B.离子化合物中只存在离子键
C.只含共价键的物质一定是共价化合物
D.只含非金属元素的物质一定不含离子键
【解析】选A。离子化合物中可能含有共价键,如氢氧化钠,B错误;只含共价键的物质可以是单质,如氮气,C错误;氯化铵中含有离子键,D错误。
【补偿训练】
(2019·日照高一检测)下列说法正确的是 ( )
A.P4和NO2都是共价化合物
B.CCl4和NH3分子中都只含有共价键
C.CaO和SiO2都是离子化合物
D.Na2O2是离子化合物,只含有离子键
【解析】选B。P4和NO2分子中都含有共价键,但P4是磷
的单质,A错;CCl4、NH3分子中都只含共价键,B正确;
CaO是离子化合物,SiO2是共价化合物,C错;Na2O2中
是通过共价键形成的,所以Na2O2中既有离子键又有共
价键,D错。
【素养提升】
我国是酒的故乡,也是酒文化的发源地,是世界上酿酒最早的国家之一。
已知酒的主要成分为乙醇,其分子式为C2H6O,分子结构如下所示:
请你判断乙醇属于离子化合物还是共价化合物,46 g乙醇中含有共价键的数目是多少
提示:乙醇属于共价化合物,其中1个乙醇分子中含有8个共价键,因此46 g乙醇中含有8NA个共价键。
知识点二 电子式
【重点释疑】
1.含义:一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
2.电子式的书写
(1)原子的电子式:
元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。例如:
(2)简单阳离子的电子式:
简单阳离子是由金属原子失去电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如Na+、Mg2+、Al3+等。
(3)简单阴离子的电子式:
不但要画出最外层电子数,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。例如:
(4)复杂阴、阳离子的电子式:
复杂阴、阳离子要标明电子,用“[ ]”括上,并在“[ ]”右上角标明电性和电量,例如:
(5)离子化合物的电子式:
(6)共价化合物的电子式:
3.用电子式表示下列物质的形成过程
【易错提醒】用电子式表示离子化合物或离子化合物
的形成过程时,易出现的错误
(1)漏标阴离子的括号,如将S2-的电子式错写为
(2)给阳离子多标电子或中括号,如将Al3+的电子式错写
为
(3)漏标或错标离子的电荷,如将S2-的电子式错写为
(4)将多个相同的离子归在一起,如将K2S的电子式错写
为
【思考·讨论】
(1)氯化钠和氯化氢的电子式NaCl: HCl:
书写是否正确
提示:NaCl属于离子化合物,HCl属于共价化合物,二者的
表示形式颠倒了。
(2)阳离子的电子式均是其离子符号吗
提示:简单阳离子的电子式为其离子符号,复杂阳离子如铵根离子的电子式不能用其离子符号来表示。
【案例示范】
【典例】过氧化氢(H2O2)又叫双氧水,其水溶液可用于
制备工业上的漂白剂、特殊环境里燃料燃烧的助燃
剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化
钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制
氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团
“ ”由2个氧原子共用1对电子形成。
(1)试根据叙述写出二者的电子式。(宏观辨识与微观探析)
(2)已知同种原子形成的共价键叫非极性共价键,不同种原子形成的共价键叫极性共价键,试讨论:H2O、H2O2中化学键有何不同 Na2O、Na2O2中化学键有何不同 (证据推理与模型认知)
(3)分别写出H2O2、Na2O2作供氧剂反应的化学方程式,根据方程式比较H2O2、Na2O2中化学键更稳定的是哪个,主要根据是什么 (科学探究与创新意识)
【解析】(1)H2O2与Na2O2中都含有过氧基“—O—O—”。
题中告知“—O—O—”由2个O共用1对电子形成,又知H
的化合价为+1价,则H与O之间共用1对电子,这样就可以
写出H2O2的电子式。比较H2O2与Na2O2,Na的化合价也是
+1价,但Na与O之间的化学键应是离子键而不是共价键,
则Na2O2是由“ ”与“Na+”构成的。
(2)比较H2O与H2O2的电子式可知,水中有极性共价键,过氧化氢中有极性和非极性共价键;比较Na2O与Na2O2的电子式可知氧化钠中有离子键,过氧化钠中既有离子键又有非极性共价键。
(3)由Na2O2在常温下跟水(或CO2)快速反应生成O2,H2O2的水溶液在催化剂作用下才能较快地反应生成O2,由此可知过氧化氢中化学键较稳定。
答案:
(2)H2O中没有非极性键,H2O2中有非极性键;Na2O中没有共价键,Na2O2中有共价键(或非极性键)
(3)2H2O2 2H2O+O2↑,2Na2O2+2H2O====4NaOH+
O2↑(或2Na2O2+2CO2====2Na2CO3+O2),H2O2中化学键更稳
定;Na2O2在常温下跟水(或CO2)快速反应生成O2,H2O2的水
溶液在催化剂作用下才能较快地反应生成O2
【规律方法】化学键的存在与判断
(1)离子化合物一定含有离子键,含有离子键的化合物一定是离子化合物。离子化合物还可能含共价键(极性键或非极性键)。
(2)共价化合物一定含有共价键,含有共价键的物质不一定是共价化合物,可能是非金属单质或离子化合物,如Cl2、NaOH等。
【迁移·应用】
1.(2018·北京市合格考)下列物质的电子式书写正确的是( )
【解析】选D。A中每个氮原子缺两个电子,错误;B为共价化合物,不能带电荷,错误;C为离子化合物,应该带电荷,错误。
2.下列电子式或用电子式表示化合物形成过程正确的是 ( )世纪金榜导学号
【解析】选D。A项中的正确写法应为 B项
中氯原子最外层电子没写全;C项中生成物中的2个
要分开写在Mg2+的两侧,不能合并写;D项符合
电子式的书写要求。
【课堂回眸】
