第1章 第3节 第1课时 电解的原理课件(共29张PPT) 高中化学鲁科版选择性必修1
文档属性
| 名称 | 第1章 第3节 第1课时 电解的原理课件(共29张PPT) 高中化学鲁科版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:34:07 | ||
图片预览





文档简介
(共29张PPT)
电解的原理
第1课时
高中化学 鲁科版选择性必修1
1.从宏观和微观的角度理解电解池中电子的移动,阴、阳离子的移动,阴、阳
两极上的反应及其变化,电流形成的过程和原理。
2.建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解
的产物,会书写电解的电极反应式和总反应式。
1.电解的原理。
2.电解的规律。
[学习目标]
[重点难点]
电解的原理
导学
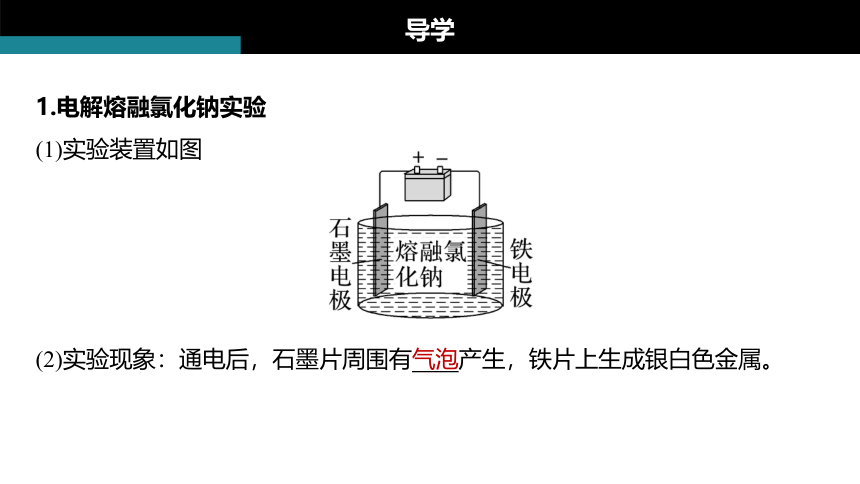
1.电解熔融氯化钠实验
(1)实验装置如图
(2)实验现象:通电后,石墨片周围有气泡产生,铁片上生成银白色金属。
(3)实验分析
①通电前
熔融NaCl中存在的微粒有Na+、Cl-,这些微粒做无规则(或自由)运动。
②通电后
离子移动方向:Na+移向铁电极,Cl-移向石墨电极。
电极上发生的反应:
铁电极:2Na++2e-===2Na,发生还原反应;石墨电极:2Cl--2e-===Cl2↑,发生氧化反应。
(4)实验结论
熔融NaCl在直流电作用下发生了氧化还原反应,分解生成了Na和Cl2。
2.基本概念
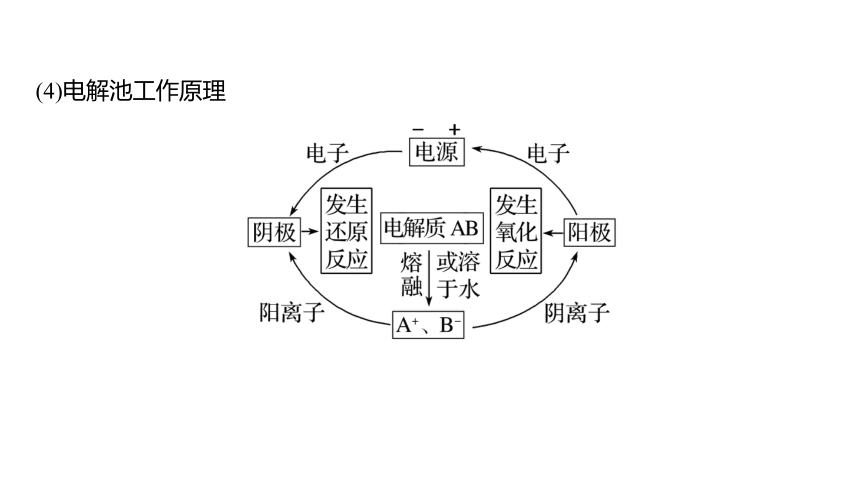
(1)电解:将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池
①定义:将电能转化为化学能的装置。
②构成条件:直流电源、固体电极材料、电解质溶液或熔融电解质。
(3)电极
阳极——发生氧化反应的电极(与电源正极相连);
阴极——发生还原反应的电极(与电源负极相连)。
(4)电解池工作原理
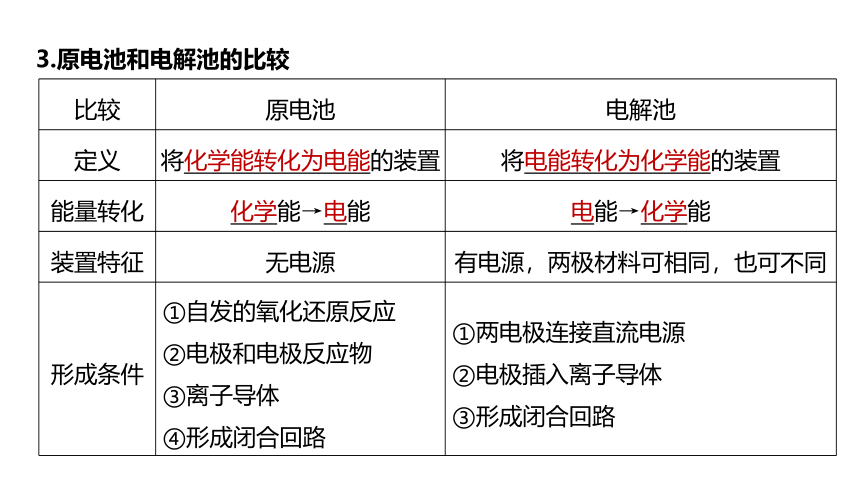
3.原电池和电解池的比较
比较 原电池 电解池
定义 将化学能转化为电能的装置 将电能转化为化学能的装置
能量转化 化学能→电能 电能→化学能
装置特征 无电源 有电源,两极材料可相同,也可不同
形成条件 ①自发的氧化还原反应 ②电极和电极反应物 ③离子导体 ④形成闭合回路 ①两电极连接直流电源
②电极插入离子导体
③形成闭合回路
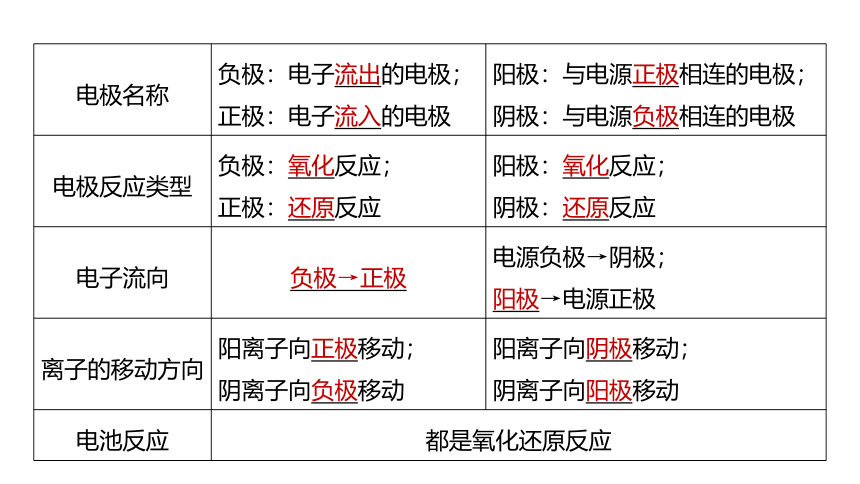
电极名称 负极:电子流出的电极; 正极:电子流入的电极 阳极:与电源正极相连的电极;
阴极:与电源负极相连的电极
电极反应类型 负极:氧化反应; 正极:还原反应 阳极:氧化反应;
阴极:还原反应
电子流向 负极→正极 电源负极→阴极;
阳极→电源正极
离子的移动方向 阳离子向正极移动; 阴离子向负极移动 阳离子向阴极移动;
阴离子向阳极移动
电池反应 都是氧化还原反应
导练
1.判断正误
(1)直流电源跟电解池连接后,电子从电源负极流向电解池阳极( )
(2)原电池的负极和电解池的阳极均发生氧化反应( )
(3)电解池中,阳离子向阴极移动,阴离子向阳极移动( )
(4)电解熔融NaCl,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色( )
×
√
√
×
2.如图所示装置中,属于电解池的是
根据电解池的构成条件进行判断:装置A、B、D中无直流电源,且装置D中不能形成闭合回路,A、B、D不属于电解池。
√
3.如图所示是电解氯化铜溶液的装置,其中c、d均为石墨电极。试回答下列问题:
(1)a电极为______,b电极为______。
(2)c电极为______,电极反应式为__________________,发生了______反应。d电极为______,电极反应式为________________,发生了______反应。
(3)电解过程中,铜离子向____(填“阴”或“阳”,下同)极移动,氯离子向
____极移动。电解总反应式:_____________________。
正极
负极
阳极
2Cl--2e-===Cl2↑
氧化
阴极
Cu2++2e-===Cu
还原
阴
阳
CuCl2 Cu+Cl2↑
电解池中电极反应式的书写
1.电极反应式的书写步骤
导学
注意 铁作阳极,铁失电子生成Fe2+而不是Fe3+。
2.电解池中电极反应式书写的关键点
(1)书写电解池中电极反应式时,强电解质以实际放电的离子表示,弱电解质写成化学式。
(2)电极反应式的书写首先根据题干要求及信息写出反应物和反应产物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。
(3)酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
(4)要确保两极得失电子数目相等,且总反应注明条件“通电”。
导练
1.判断正误
(1)电解池工作时,阳极发生还原反应,失去电子( )
(2)铜作阳极电解盐酸的化学方程式为Cu+2HCl CuCl2+H2↑( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为4OH--4e-===O2↑+2H2O( )
×
√
×
2.按要求书写电极反应式和总反应式。
(1)用惰性电极电解AgNO3溶液
阳极反应式:________________________;
阴极反应式:__________________;
总反应离子方程式:_________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式:___________________;
阴极反应式:_____________________________________;
总反应离子方程式:______________________________________________。
2H2O-4e-===O2↑+4H+
4Ag++4e-===4Ag
2Cl--2e-===Cl2↑
2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
(3)用Fe作电极电解NaCl溶液
阳极反应式:________________;
阴极反应式:__________________________;
总反应化学方程式:____________________________。
(4)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:______________________________;
阴极反应式:__________________;
总反应离子方程式:____________________________。
Fe-2e-===Fe2+
2H2O+2e-===H2↑+2OH-
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
酸、碱、盐溶液的电解规律
1.电极反应规律
(1)阴极:一般情况下,电极本身都不参与电极反应,发生反应的是溶液中的阳离子。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
导学
2.惰性电极电解电解质溶液的四种类型
类型 电极反应特点 电解质溶液 电解质浓度 pH 电解质溶液复原
电解水型 阴极:4H2O+4e-===2H2↑+4OH-; 阳极:4OH--4e-===O2↑+2H2O 强碱(NaOH) 增大 增大 加水
阴极:4H++4e-===2H2↑; 阳极:2H2O-4e-===O2↑+4H+ 含氧酸 (H2SO4) 增大 减小 加水
电解 水型 阴极:4H++4e-===2H2↑; 阳极:4OH--4e-===O2↑+2H2O 活泼金属的含氧酸盐(Na2SO4) 增大 不变 加水
电解电解质型 电解质电离出的阴、阳离子分别在两极放电 无氧酸(HCl) 减小 增大 通入HCl气体
不活泼金属的无氧酸盐(CuCl2) 减小 — 加氯化铜
放H2生碱型 阴极:H2O放H2生成碱; 阳极:电解质阴离子放电 活泼金属的无氧酸盐(NaCl) 生成新电解质 增大 加盐酸
放O2生酸型 阴极:电解质阳离子放电; 阳极:H2O放O2生成酸 不活泼金属的含氧酸盐(CuSO4) 生成新电解质 减小 加氧化铜
特别提醒:电解后溶液复原遵循“出啥加啥”原则。
1.判断正误
(1)用石墨作阳极、铁作阴极分别电解稀硫酸和硫酸钠溶液时,它们阴极和阳极的产物都相同( )
(2)用石墨作电极电解氯化钠和硫酸铜的混合液,阴极和阳极生成的物质始终是铜和氯气( )
(3)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O 4Ag+4H++O2↑( )
(4)电解质溶液的导电过程就是该溶液的电解过程( )
导思
√
×
√
√
2.用下列装置电解不同电解质溶液,结合教材中“电解原理”知识,交流讨论。
(1)写出实验1中阴极和阳极的电极反应式,对比①和②,说明电极材料对电极产物的影响。
提示 ①阴极:Cu2++2e-===Cu;阳极:2Cl--2e-===Cl2↑;②阴极:Cu2++2e-===Cu;阳极:Cu-2e-===Cu2+;电极材料对阴极无影响,若阳极材料是活泼电极,则电极本身放电,溶液中的离子不放电。
(2)判断实验2中阴极和阳极产物,说明判断电极产物要考虑哪些因素?
提示 ③阴极:H2、阳极:O2;④阴极:H2、阳极:O2;判断电极产物要考虑阳极材料和电解质溶液中离子的氧化性或还原性强弱。
(3)实验3中持续电解分两个阶段,分别写出两个阶段的电极反应式和电解总反应式。
分析电解问题的基本方法思路
(1)确定电解池的阴、阳两极,判断阳极是惰性电极还是活泼电极。
(2)分析通电前溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(3)通电后阴离子移向阳极,阳离子移向阴极,判断两极上的放电顺序。
(4)确定电极产物,书写电极反应式(注意遵循原子守恒和电荷守恒)。
(5)分析电解时的相关变化,如两极现象、离子浓度的变化、pH变化等。
电解的原理
第1课时
高中化学 鲁科版选择性必修1
1.从宏观和微观的角度理解电解池中电子的移动,阴、阳离子的移动,阴、阳
两极上的反应及其变化,电流形成的过程和原理。
2.建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解
的产物,会书写电解的电极反应式和总反应式。
1.电解的原理。
2.电解的规律。
[学习目标]
[重点难点]
电解的原理
导学
1.电解熔融氯化钠实验
(1)实验装置如图
(2)实验现象:通电后,石墨片周围有气泡产生,铁片上生成银白色金属。
(3)实验分析
①通电前
熔融NaCl中存在的微粒有Na+、Cl-,这些微粒做无规则(或自由)运动。
②通电后
离子移动方向:Na+移向铁电极,Cl-移向石墨电极。
电极上发生的反应:
铁电极:2Na++2e-===2Na,发生还原反应;石墨电极:2Cl--2e-===Cl2↑,发生氧化反应。
(4)实验结论
熔融NaCl在直流电作用下发生了氧化还原反应,分解生成了Na和Cl2。
2.基本概念
(1)电解:将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池
①定义:将电能转化为化学能的装置。
②构成条件:直流电源、固体电极材料、电解质溶液或熔融电解质。
(3)电极
阳极——发生氧化反应的电极(与电源正极相连);
阴极——发生还原反应的电极(与电源负极相连)。
(4)电解池工作原理
3.原电池和电解池的比较
比较 原电池 电解池
定义 将化学能转化为电能的装置 将电能转化为化学能的装置
能量转化 化学能→电能 电能→化学能
装置特征 无电源 有电源,两极材料可相同,也可不同
形成条件 ①自发的氧化还原反应 ②电极和电极反应物 ③离子导体 ④形成闭合回路 ①两电极连接直流电源
②电极插入离子导体
③形成闭合回路
电极名称 负极:电子流出的电极; 正极:电子流入的电极 阳极:与电源正极相连的电极;
阴极:与电源负极相连的电极
电极反应类型 负极:氧化反应; 正极:还原反应 阳极:氧化反应;
阴极:还原反应
电子流向 负极→正极 电源负极→阴极;
阳极→电源正极
离子的移动方向 阳离子向正极移动; 阴离子向负极移动 阳离子向阴极移动;
阴离子向阳极移动
电池反应 都是氧化还原反应
导练
1.判断正误
(1)直流电源跟电解池连接后,电子从电源负极流向电解池阳极( )
(2)原电池的负极和电解池的阳极均发生氧化反应( )
(3)电解池中,阳离子向阴极移动,阴离子向阳极移动( )
(4)电解熔融NaCl,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色( )
×
√
√
×
2.如图所示装置中,属于电解池的是
根据电解池的构成条件进行判断:装置A、B、D中无直流电源,且装置D中不能形成闭合回路,A、B、D不属于电解池。
√
3.如图所示是电解氯化铜溶液的装置,其中c、d均为石墨电极。试回答下列问题:
(1)a电极为______,b电极为______。
(2)c电极为______,电极反应式为__________________,发生了______反应。d电极为______,电极反应式为________________,发生了______反应。
(3)电解过程中,铜离子向____(填“阴”或“阳”,下同)极移动,氯离子向
____极移动。电解总反应式:_____________________。
正极
负极
阳极
2Cl--2e-===Cl2↑
氧化
阴极
Cu2++2e-===Cu
还原
阴
阳
CuCl2 Cu+Cl2↑
电解池中电极反应式的书写
1.电极反应式的书写步骤
导学
注意 铁作阳极,铁失电子生成Fe2+而不是Fe3+。
2.电解池中电极反应式书写的关键点
(1)书写电解池中电极反应式时,强电解质以实际放电的离子表示,弱电解质写成化学式。
(2)电极反应式的书写首先根据题干要求及信息写出反应物和反应产物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。
(3)酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
(4)要确保两极得失电子数目相等,且总反应注明条件“通电”。
导练
1.判断正误
(1)电解池工作时,阳极发生还原反应,失去电子( )
(2)铜作阳极电解盐酸的化学方程式为Cu+2HCl CuCl2+H2↑( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为4OH--4e-===O2↑+2H2O( )
×
√
×
2.按要求书写电极反应式和总反应式。
(1)用惰性电极电解AgNO3溶液
阳极反应式:________________________;
阴极反应式:__________________;
总反应离子方程式:_________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式:___________________;
阴极反应式:_____________________________________;
总反应离子方程式:______________________________________________。
2H2O-4e-===O2↑+4H+
4Ag++4e-===4Ag
2Cl--2e-===Cl2↑
2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
(3)用Fe作电极电解NaCl溶液
阳极反应式:________________;
阴极反应式:__________________________;
总反应化学方程式:____________________________。
(4)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:______________________________;
阴极反应式:__________________;
总反应离子方程式:____________________________。
Fe-2e-===Fe2+
2H2O+2e-===H2↑+2OH-
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
酸、碱、盐溶液的电解规律
1.电极反应规律
(1)阴极:一般情况下,电极本身都不参与电极反应,发生反应的是溶液中的阳离子。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
导学
2.惰性电极电解电解质溶液的四种类型
类型 电极反应特点 电解质溶液 电解质浓度 pH 电解质溶液复原
电解水型 阴极:4H2O+4e-===2H2↑+4OH-; 阳极:4OH--4e-===O2↑+2H2O 强碱(NaOH) 增大 增大 加水
阴极:4H++4e-===2H2↑; 阳极:2H2O-4e-===O2↑+4H+ 含氧酸 (H2SO4) 增大 减小 加水
电解 水型 阴极:4H++4e-===2H2↑; 阳极:4OH--4e-===O2↑+2H2O 活泼金属的含氧酸盐(Na2SO4) 增大 不变 加水
电解电解质型 电解质电离出的阴、阳离子分别在两极放电 无氧酸(HCl) 减小 增大 通入HCl气体
不活泼金属的无氧酸盐(CuCl2) 减小 — 加氯化铜
放H2生碱型 阴极:H2O放H2生成碱; 阳极:电解质阴离子放电 活泼金属的无氧酸盐(NaCl) 生成新电解质 增大 加盐酸
放O2生酸型 阴极:电解质阳离子放电; 阳极:H2O放O2生成酸 不活泼金属的含氧酸盐(CuSO4) 生成新电解质 减小 加氧化铜
特别提醒:电解后溶液复原遵循“出啥加啥”原则。
1.判断正误
(1)用石墨作阳极、铁作阴极分别电解稀硫酸和硫酸钠溶液时,它们阴极和阳极的产物都相同( )
(2)用石墨作电极电解氯化钠和硫酸铜的混合液,阴极和阳极生成的物质始终是铜和氯气( )
(3)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O 4Ag+4H++O2↑( )
(4)电解质溶液的导电过程就是该溶液的电解过程( )
导思
√
×
√
√
2.用下列装置电解不同电解质溶液,结合教材中“电解原理”知识,交流讨论。
(1)写出实验1中阴极和阳极的电极反应式,对比①和②,说明电极材料对电极产物的影响。
提示 ①阴极:Cu2++2e-===Cu;阳极:2Cl--2e-===Cl2↑;②阴极:Cu2++2e-===Cu;阳极:Cu-2e-===Cu2+;电极材料对阴极无影响,若阳极材料是活泼电极,则电极本身放电,溶液中的离子不放电。
(2)判断实验2中阴极和阳极产物,说明判断电极产物要考虑哪些因素?
提示 ③阴极:H2、阳极:O2;④阴极:H2、阳极:O2;判断电极产物要考虑阳极材料和电解质溶液中离子的氧化性或还原性强弱。
(3)实验3中持续电解分两个阶段,分别写出两个阶段的电极反应式和电解总反应式。
分析电解问题的基本方法思路
(1)确定电解池的阴、阳两极,判断阳极是惰性电极还是活泼电极。
(2)分析通电前溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(3)通电后阴离子移向阳极,阳离子移向阴极,判断两极上的放电顺序。
(4)确定电极产物,书写电极反应式(注意遵循原子守恒和电荷守恒)。
(5)分析电解时的相关变化,如两极现象、离子浓度的变化、pH变化等。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
