人教版(2019)选择性必修二 2.3.2 分子的性质 (共19张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 2.3.2 分子的性质 (共19张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:36:12 | ||
图片预览


文档简介
(共19张PPT)
第三节 分子的性质
(第2课时 手性 范德华力 氢键 溶解性 )
第二章 分子的结构与性质
问题1、什么是手性?
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)。
问题3、什么手性分子?
任务一 手性分子
镜像对称,在三维空间里不能重叠。
问题2、什么是手性异构体?
有手性异构体的分子。
【练习1】下列化合物中属于手性分子子的是( )
A.CCl2F2 B.
C.CH3CH2OH D.
B
【练习2】下列化合物中含有2个“手性”碳原子的是( )
B
问题1.为什么干冰升华需要吸收热量?
概念1.范德华力:分子间的普遍存在的作用力,能使物质凝聚在一起。
问题3.影响范德华力大小的因素有哪些?
①结构相似,相对分子质量越大范德华力越大
②相对分子质量相同或相近,分子极性越大范德华力越强
活动1.比较下列物质范德华力大小:
H2 Cl2 N2 CO Ar CO HCl HBr
<
<
<
<
问题2.为什么干冰易升华而CO2很难分解?
范德华力很弱,约比化学键能小1~2个数量级
任务二 分子间作用力
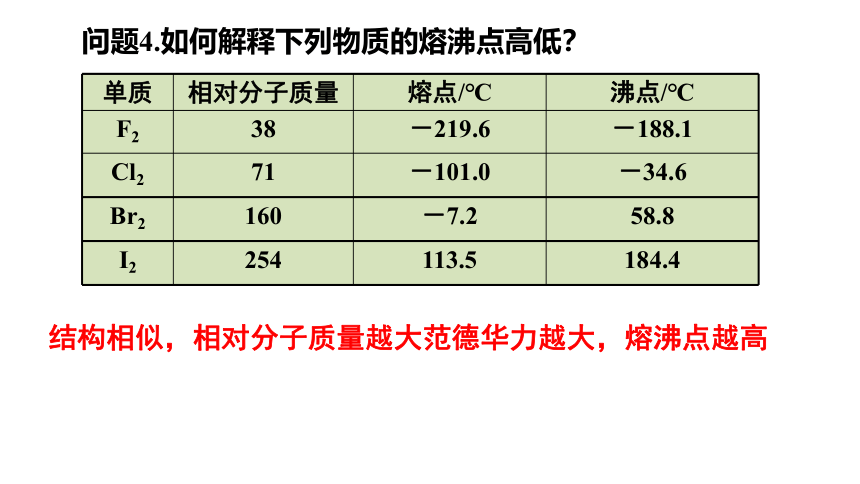
问题4.如何解释下列物质的熔沸点高低?
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
结构相似,相对分子质量越大范德华力越大,熔沸点越高
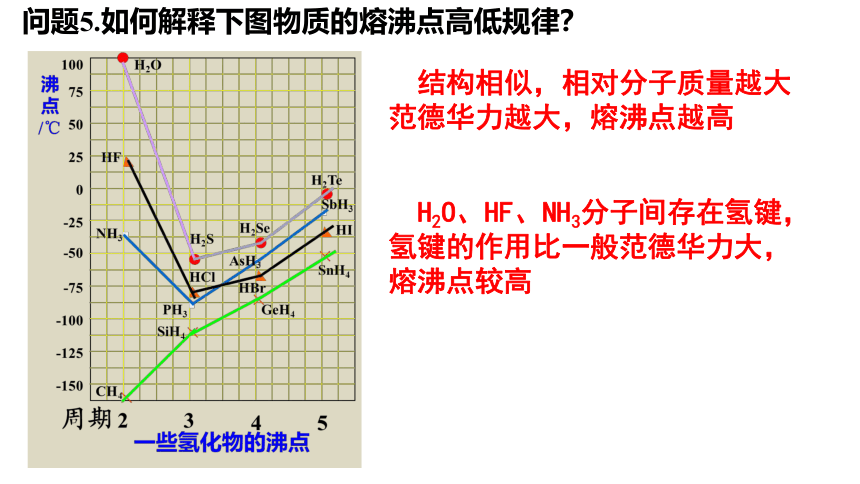
问题5.如何解释下图物质的熔沸点高低规律?
结构相似,相对分子质量越大范德华力越大,熔沸点越高
H2O、HF、NH3分子间存在氢键,氢键的作用比一般范德华力大,熔沸点较高
问题1、什么是氢键
液态水中的氢键
概念2.氢键:一种特殊的分子间作用力
Y —
X —H
如:F 、O、N
...
电负性很大的原子
共价键
氢键
(1)形成条件
①与电负性大且半径小的原子(F、O、N)相连的 H
(2)表示方法
②在附近有电负性大, 半径小的原子(F、O、N)
一般: X-H … Y-
任务三 氢键对其物质性质的影响
由已经与电负性很大的原子形成共价键的氢原子(如水分子中的氢)与另一个电负性很大的原子(如水分子中的氧)之间的作用力。
问题2.哪些物质存在氢键?
(1)含F-H 、O-H、N-H的分子与含F、O、N的分子间存在氢键
如: C2H5OH、CH3COOH、H2O 、HF、NH3 、氨基酸相互之间
问题3.氢键只存在分子间吗?
分子内也可以形成氢键
生物大分子中的氢键
(1)氢键对物质熔沸点影响
分子间氢键使物质熔沸点升高
邻羟基苯甲醛
(熔点:-7℃)
对羟基苯甲醛
(熔点:115~117℃)
分子内形成氢键减少分子间氢键的数目,物质熔沸点降低
问题4.氢键影响物质的哪些性质?
(2)氢键对物质溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时减少了与溶剂的氢键使溶质溶解度减小。
●●●
1、为什么NH3极易溶于水?
2、水与甲醇互溶原因是什么?
水、甲醇互溶
氢键存在增大了溶解性。
【交流讨论】
3、还有哪些因素对物质溶解度有影响
温度、压强、相似相溶(极性、结构)
氢键是一种静电作用,是除范德华力外的另一种分子间作用力;
氢键的大小介于化学键与范德华力间,不属于化学键,但有键长、键能。
问题5.如何比较氢键的强弱?
X—H … Y—
X和Y的电负性越大,吸引电子能力越强,则氢键越强
氢键强弱顺序:F-H…F > O-H…O > O-H…N> N-H…N
X—H … Y—三原子一条直线时氢键作用最强(方向性)
(1)为什么结冰后体积膨胀?
思考讨论
(2)为什么实验测定接近沸点的水蒸气的相对分子质量大于18?
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
接近沸点的水蒸气中存在相当量的水分子因氢键而相互缔合成缔合分子。
(3) F-H…F > O-H…O为什么H2O的熔沸点高于HF?
平均1molH2O能形成2mol氢键而1molHF只能形成1mol氢键。(饱和性)
【小试牛刀】判断下列关于氢键的叙述是否正确?
(1)氢键是一种特殊的化学键,它广泛存在于自然界中。
(2)在氢键A—H…B—中, A、B电负性越大,则键能越大,氢键越强。
(3) A、B原子半径(尤其B原子半径)越小,则氢键A—H…B—就越强。
(4)分子间存在氢键时,使物质具有较高的熔、沸点。
(5)分子内存在氢键时,降低物质的熔、沸点。
(6)氢键的存在可引起物质的溶解度、密度的变化。
×
√
√
√
√
√
【再来一刀】下列说法不正确的是( )
A.HF、HCl、HBr、HI的熔、沸点升高只与范德华力大小有关
B.H2O的熔、沸点高于H2S,是由于水分子之间存在氢键
C.乙醇与水互溶可以用“相似相溶”和氢键来解释
D.邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点低
A
1、下列说法正确的是( )
A.任何分子内都存在共价键
B.范德华力与氢键可同时存在于分子之间
C.甲烷可与水形成氢键
D.乙醇跟水分子之间只存在范德华力
稀有气体为单原子分子,没有共价键
均为分子间作用力
C 元素电负性弱,不符合形成氢键的条件
也存在氢键
B
2、下列有关范德华力的叙述正确的是
A. 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B. 范德华力与化学键的区别是作用力的强弱不同
C. 任何分子间在任意情况下都会产生范德华力
D. 范德华力非常微弱,故破坏范德华力不需要消耗能量
B
分子间的距离足够远,则分子间没有范德华力
3、水分子间因存在氢键的作用而彼此结合形成(H2O)n。
在冰中每个水分子被4个水分子包围形成变形的正四面体,
通过氢键相互连接成庞大的分子晶体。
(1)1 mol冰中有________mol氢键。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为
________________________________________。
(3)已知在相同条件下双氧水的沸点明显高于水的沸点,其原因可能是
_______________________________________________________。
(4)在冰结构中,每个水分子与相邻4个水分子以氢键相连接。在冰中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热51 kJ·mol-1,则冰中氢键的能量是______kJ·mol-1。
2
H2O+H2O H3O++OH-
双氧水分子之间存在更强烈的氢键
20
每个水分子形成的氢键数为4÷2=2
冰: 升华热 = 氢键×2+范德华力
(51 kJ mol-1-11 kJ mol-1) ÷2=20 kJ mol-1
第三节 分子的性质
(第2课时 手性 范德华力 氢键 溶解性 )
第二章 分子的结构与性质
问题1、什么是手性?
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)。
问题3、什么手性分子?
任务一 手性分子
镜像对称,在三维空间里不能重叠。
问题2、什么是手性异构体?
有手性异构体的分子。
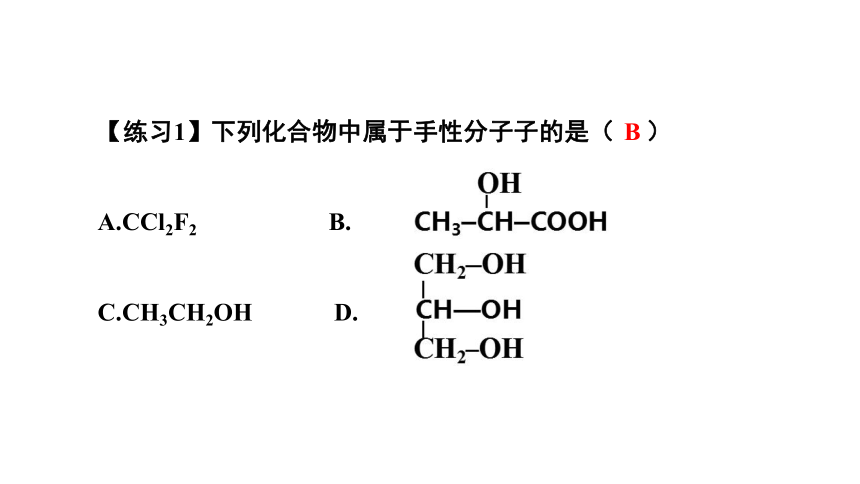
【练习1】下列化合物中属于手性分子子的是( )
A.CCl2F2 B.
C.CH3CH2OH D.
B
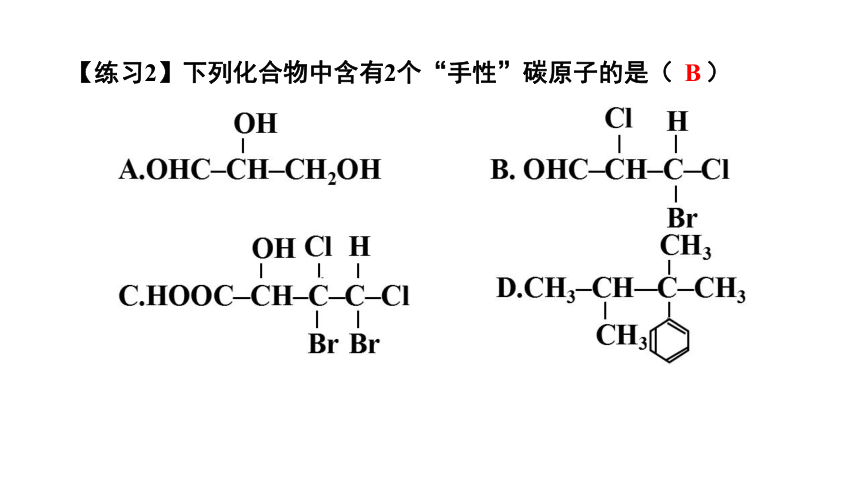
【练习2】下列化合物中含有2个“手性”碳原子的是( )
B
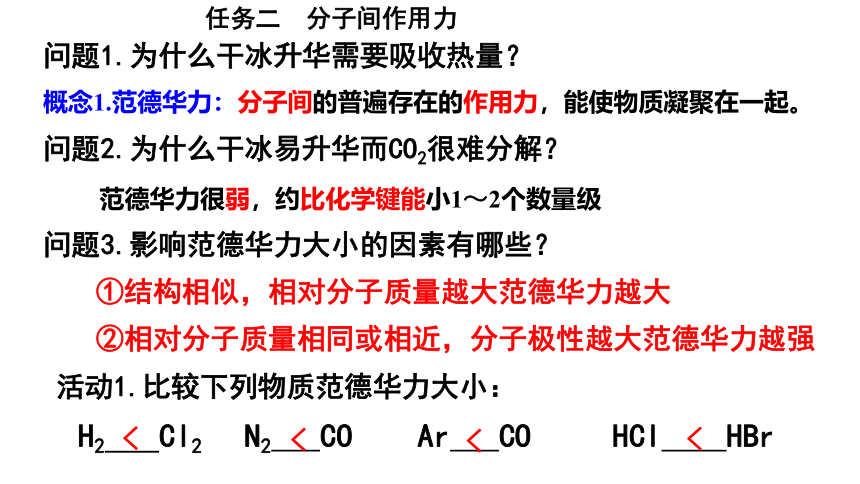
问题1.为什么干冰升华需要吸收热量?
概念1.范德华力:分子间的普遍存在的作用力,能使物质凝聚在一起。
问题3.影响范德华力大小的因素有哪些?
①结构相似,相对分子质量越大范德华力越大
②相对分子质量相同或相近,分子极性越大范德华力越强
活动1.比较下列物质范德华力大小:
H2 Cl2 N2 CO Ar CO HCl HBr
<
<
<
<
问题2.为什么干冰易升华而CO2很难分解?
范德华力很弱,约比化学键能小1~2个数量级
任务二 分子间作用力
问题4.如何解释下列物质的熔沸点高低?
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
结构相似,相对分子质量越大范德华力越大,熔沸点越高
问题5.如何解释下图物质的熔沸点高低规律?
结构相似,相对分子质量越大范德华力越大,熔沸点越高
H2O、HF、NH3分子间存在氢键,氢键的作用比一般范德华力大,熔沸点较高
问题1、什么是氢键
液态水中的氢键
概念2.氢键:一种特殊的分子间作用力
Y —
X —H
如:F 、O、N
...
电负性很大的原子
共价键
氢键
(1)形成条件
①与电负性大且半径小的原子(F、O、N)相连的 H
(2)表示方法
②在附近有电负性大, 半径小的原子(F、O、N)
一般: X-H … Y-
任务三 氢键对其物质性质的影响
由已经与电负性很大的原子形成共价键的氢原子(如水分子中的氢)与另一个电负性很大的原子(如水分子中的氧)之间的作用力。
问题2.哪些物质存在氢键?
(1)含F-H 、O-H、N-H的分子与含F、O、N的分子间存在氢键
如: C2H5OH、CH3COOH、H2O 、HF、NH3 、氨基酸相互之间
问题3.氢键只存在分子间吗?
分子内也可以形成氢键
生物大分子中的氢键
(1)氢键对物质熔沸点影响
分子间氢键使物质熔沸点升高
邻羟基苯甲醛
(熔点:-7℃)
对羟基苯甲醛
(熔点:115~117℃)
分子内形成氢键减少分子间氢键的数目,物质熔沸点降低
问题4.氢键影响物质的哪些性质?
(2)氢键对物质溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时减少了与溶剂的氢键使溶质溶解度减小。
●●●
1、为什么NH3极易溶于水?
2、水与甲醇互溶原因是什么?
水、甲醇互溶
氢键存在增大了溶解性。
【交流讨论】
3、还有哪些因素对物质溶解度有影响
温度、压强、相似相溶(极性、结构)
氢键是一种静电作用,是除范德华力外的另一种分子间作用力;
氢键的大小介于化学键与范德华力间,不属于化学键,但有键长、键能。
问题5.如何比较氢键的强弱?
X—H … Y—
X和Y的电负性越大,吸引电子能力越强,则氢键越强
氢键强弱顺序:F-H…F > O-H…O > O-H…N> N-H…N
X—H … Y—三原子一条直线时氢键作用最强(方向性)
(1)为什么结冰后体积膨胀?
思考讨论
(2)为什么实验测定接近沸点的水蒸气的相对分子质量大于18?
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
接近沸点的水蒸气中存在相当量的水分子因氢键而相互缔合成缔合分子。
(3) F-H…F > O-H…O为什么H2O的熔沸点高于HF?
平均1molH2O能形成2mol氢键而1molHF只能形成1mol氢键。(饱和性)
【小试牛刀】判断下列关于氢键的叙述是否正确?
(1)氢键是一种特殊的化学键,它广泛存在于自然界中。
(2)在氢键A—H…B—中, A、B电负性越大,则键能越大,氢键越强。
(3) A、B原子半径(尤其B原子半径)越小,则氢键A—H…B—就越强。
(4)分子间存在氢键时,使物质具有较高的熔、沸点。
(5)分子内存在氢键时,降低物质的熔、沸点。
(6)氢键的存在可引起物质的溶解度、密度的变化。
×
√
√
√
√
√
【再来一刀】下列说法不正确的是( )
A.HF、HCl、HBr、HI的熔、沸点升高只与范德华力大小有关
B.H2O的熔、沸点高于H2S,是由于水分子之间存在氢键
C.乙醇与水互溶可以用“相似相溶”和氢键来解释
D.邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点低
A
1、下列说法正确的是( )
A.任何分子内都存在共价键
B.范德华力与氢键可同时存在于分子之间
C.甲烷可与水形成氢键
D.乙醇跟水分子之间只存在范德华力
稀有气体为单原子分子,没有共价键
均为分子间作用力
C 元素电负性弱,不符合形成氢键的条件
也存在氢键
B
2、下列有关范德华力的叙述正确的是
A. 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B. 范德华力与化学键的区别是作用力的强弱不同
C. 任何分子间在任意情况下都会产生范德华力
D. 范德华力非常微弱,故破坏范德华力不需要消耗能量
B
分子间的距离足够远,则分子间没有范德华力
3、水分子间因存在氢键的作用而彼此结合形成(H2O)n。
在冰中每个水分子被4个水分子包围形成变形的正四面体,
通过氢键相互连接成庞大的分子晶体。
(1)1 mol冰中有________mol氢键。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为
________________________________________。
(3)已知在相同条件下双氧水的沸点明显高于水的沸点,其原因可能是
_______________________________________________________。
(4)在冰结构中,每个水分子与相邻4个水分子以氢键相连接。在冰中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热51 kJ·mol-1,则冰中氢键的能量是______kJ·mol-1。
2
H2O+H2O H3O++OH-
双氧水分子之间存在更强烈的氢键
20
每个水分子形成的氢键数为4÷2=2
冰: 升华热 = 氢键×2+范德华力
(51 kJ mol-1-11 kJ mol-1) ÷2=20 kJ mol-1
