人教版(2019)选择性必修二 3.4 配合物与超分子(共30张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 3.4 配合物与超分子(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:36:47 | ||
图片预览







文档简介
(共30张PPT)
第三章 晶体结构与性质
第四节 配合物与超分子
人教版选择性必修2
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
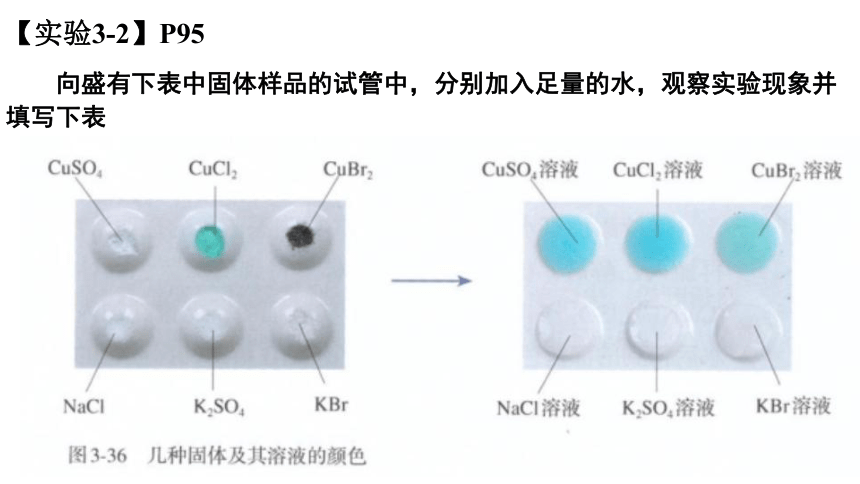
【实验3-2】P95
固体
溶液颜色
无色离子:
①CuSO4
②CuCl2
③CuBr2
④NaCl
⑤K2SO4
⑥KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
【实验3-2】P95
固体
溶液颜色
无色离子:
①CuSO4
②CuCl2
③CuBr2
④NaCl
⑤K2SO4
⑥KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+存在,呈天蓝色
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
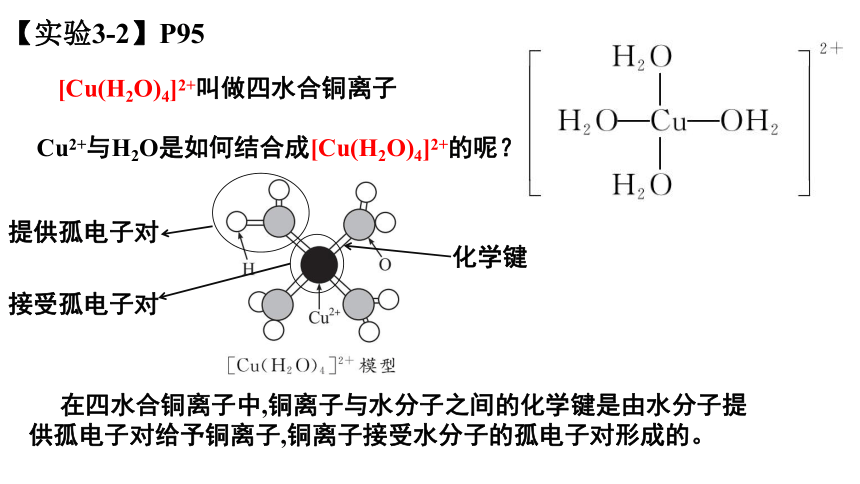
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
[Cu(H2O)4]2+叫做四水合铜离子
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
化学键
提供孤电子对
接受孤电子对
【实验3-2】P95
一、配合物
1.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
配位键是一种特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,
如Ag+形成2个配位键;Cu2+形成4个配位键等。
一、配合物
2.配位化合物
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
一、配合物
(1)中心原子(离子):提供空轨道的金属离子或原子。
一般是过渡金属,必须有空轨道。
(2)配位体:含有孤电子对的分子或离子
NH3 H2O CO Cl- SCN- CN-
(3)配位原子:配位体中具有孤电子对的原子N O P S,
一般是ⅤA Ⅵ A ⅦA的非金属原子
(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,
如:[Fe(SCN)6]3-
一、配合物
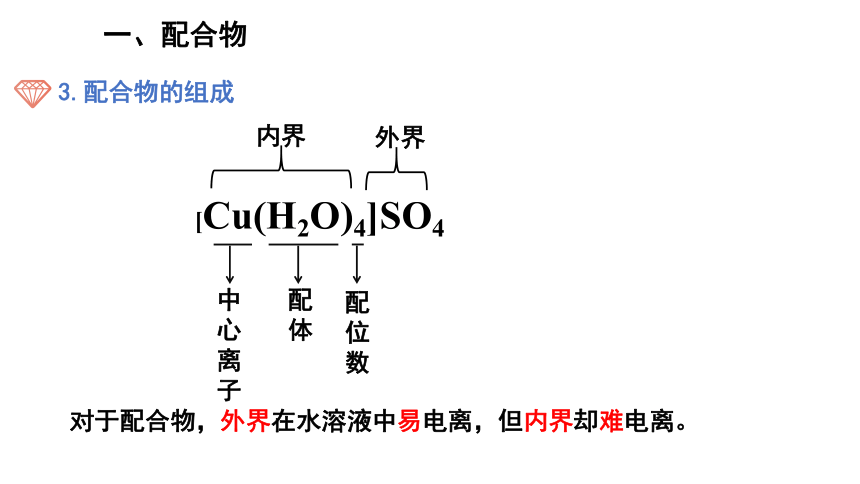
3.配合物的组成
对于配合物,外界在水溶液中易电离,但内界却难电离。
[Cu(H2O)4]SO4
中心离子
配体
配位数
内界
外界
一、配合物
课堂练习
1.0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
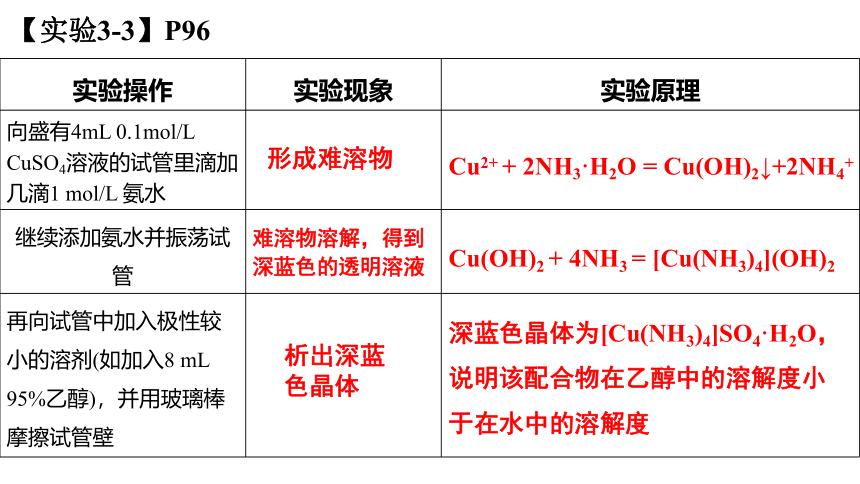
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
【实验3-3】P96
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
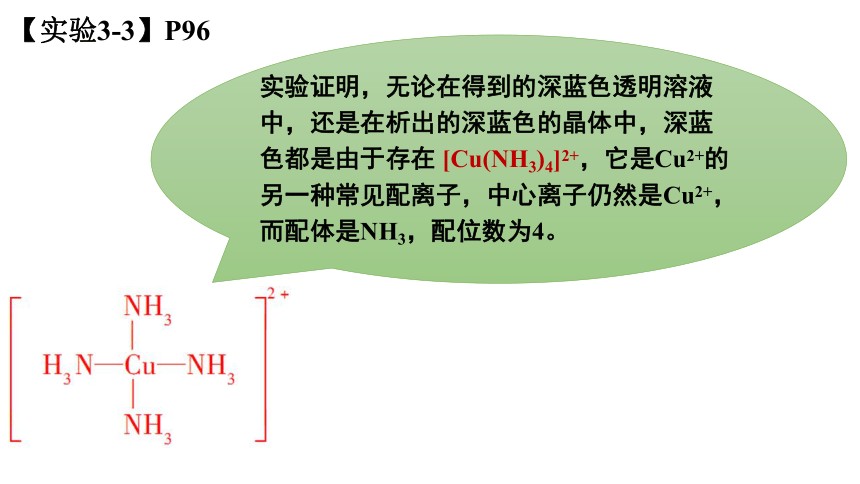
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
【实验3-3】P96
【实验3-4】P97
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
【实验3-5】P97
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
4.配合物的性质
配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。
一、配合物
4.配合物的性质
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
一、配合物
二、超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的
分子聚集体称为超分子
超分子定义中的分子是广义的,包括离子。
2.超分子实例
(1)分离C60和C70
二、超分子
(1)分离C60和C70
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
二、超分子
(2)冠醚识别碱金属离子(如K+)。
二、超分子
3.超分子的重要特征
分子识别
自组装
二、超分子
配合物理论
超分子
配位键
分离或识别分子或离子
实验探究
配合无结构与性质
1.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
答案:B
【课堂练习】
解析:向CuSO4溶液中加入过量氨水发生的反应是CuSO4+2NH3·H2O === Cu(OH)2↓+(NH4)2SO4;
Cu(OH)2+2NH3·H2O+(NH4)2SO4 ===[Cu(NH3)4]SO4+4H2O,故A项不正确,B项正确;由于[Cu(NH3)4]SO4在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
规律总结 准确判断配位键的方法:(1)掌握好配位键的形成条件:①一种原子或离子有空轨道,常见的可提供空轨道的是过渡元素的离子或原子,如Cu2+、Ag+、Fe、Ni等;②另一种原子或离子有孤电子对,常见的含孤电子对的配体有:分子如CO、NH3、H2O等,离子如Cl-、CN-、N等;(2)正确分析原子的最外层电子排布和成键情况。
2.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
答案:B
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
3.(1)下列不属于配合物的是 。
A.[Cu(H2O)4]SO4·H2O
B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O
D.Na[Al(OH)4]
(2)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ;画出配合物离子[Cu(NH3)4]2+中的配位键 。
答案:(1)C (2)Fe3+
4.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
答案:B
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
5.下列微粒中含配位键的是( )
A.①②④⑦⑧
B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧
D.①②③④⑤⑥⑦⑧
答案:C
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
6.(双选)下列组合中,两种配合物中心离子的电荷数和配位数均相同的是( )
A.K[Ag(CN)2]、[Cu(NH3)4]SO4
B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4
C.[Ag(NH3)2]Cl、K[Ag(CN)2]
D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl
答案:BC
解析:A项,两种配合物中心离子的电荷数分别是1+和2+,配位数分别是2和4,不符合题目要求;B项,两种配合物中心离子的电荷数均是2+,配位数均是4,符合题目要求;C项,两种配合物中心离子的电荷数均是1+,配位数均是2,符合题目要求;D项,两种配合物中心离子的电荷数分别是2+和1+,配位数分别是4和2,不符合题目要求。
7.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有 (填字母)。
A.配位键 B.极性共价键
C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间结构,[Cu(NH3)4]2+中的两个NH3分子被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为 。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
答案:(1)AB (2)平面正方形 (3)sp2
解析:[Cu(NH3)4]2+由铜离子与氨分子通过配位键形成,氨分子内部的化学键是极性共价键。根据[Cu(NH3)2Cl2]有两种不同的结构,可知[Cu(NH3)4]2+的空间结构是平面正方形。HOCH2CH=CH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化;CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。
第三章 晶体结构与性质
第四节 配合物与超分子
人教版选择性必修2
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
【实验3-2】P95
固体
溶液颜色
无色离子:
①CuSO4
②CuCl2
③CuBr2
④NaCl
⑤K2SO4
⑥KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
【实验3-2】P95
固体
溶液颜色
无色离子:
①CuSO4
②CuCl2
③CuBr2
④NaCl
⑤K2SO4
⑥KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
水溶液中Cu2+主要以水合离子[Cu(H2O)4]2+存在,呈天蓝色
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
[Cu(H2O)4]2+叫做四水合铜离子
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
化学键
提供孤电子对
接受孤电子对
【实验3-2】P95
一、配合物
1.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。
配位键是一种特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,
如Ag+形成2个配位键;Cu2+形成4个配位键等。
一、配合物
2.配位化合物
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
一、配合物
(1)中心原子(离子):提供空轨道的金属离子或原子。
一般是过渡金属,必须有空轨道。
(2)配位体:含有孤电子对的分子或离子
NH3 H2O CO Cl- SCN- CN-
(3)配位原子:配位体中具有孤电子对的原子N O P S,
一般是ⅤA Ⅵ A ⅦA的非金属原子
(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,
如:[Fe(SCN)6]3-
一、配合物
3.配合物的组成
对于配合物,外界在水溶液中易电离,但内界却难电离。
[Cu(H2O)4]SO4
中心离子
配体
配位数
内界
外界
一、配合物
课堂练习
1.0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
B
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
【实验3-3】P96
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
【实验3-3】P96
【实验3-4】P97
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
【实验3-5】P97
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
4.配合物的性质
配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。
一、配合物
4.配合物的性质
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
一、配合物
二、超分子
1.定义
由两种或两种以上的分子通过分子间相互作用形成的
分子聚集体称为超分子
超分子定义中的分子是广义的,包括离子。
2.超分子实例
(1)分离C60和C70
二、超分子
(1)分离C60和C70
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152)
Na+(204)
K+(276)
Rb+(304)
Cs+(334)
二、超分子
(2)冠醚识别碱金属离子(如K+)。
二、超分子
3.超分子的重要特征
分子识别
自组装
二、超分子
配合物理论
超分子
配位键
分离或识别分子或离子
实验探究
配合无结构与性质
1.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
答案:B
【课堂练习】
解析:向CuSO4溶液中加入过量氨水发生的反应是CuSO4+2NH3·H2O === Cu(OH)2↓+(NH4)2SO4;
Cu(OH)2+2NH3·H2O+(NH4)2SO4 ===[Cu(NH3)4]SO4+4H2O,故A项不正确,B项正确;由于[Cu(NH3)4]SO4在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
规律总结 准确判断配位键的方法:(1)掌握好配位键的形成条件:①一种原子或离子有空轨道,常见的可提供空轨道的是过渡元素的离子或原子,如Cu2+、Ag+、Fe、Ni等;②另一种原子或离子有孤电子对,常见的含孤电子对的配体有:分子如CO、NH3、H2O等,离子如Cl-、CN-、N等;(2)正确分析原子的最外层电子排布和成键情况。
2.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
答案:B
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
3.(1)下列不属于配合物的是 。
A.[Cu(H2O)4]SO4·H2O
B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O
D.Na[Al(OH)4]
(2)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ;画出配合物离子[Cu(NH3)4]2+中的配位键 。
答案:(1)C (2)Fe3+
4.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
答案:B
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
5.下列微粒中含配位键的是( )
A.①②④⑦⑧
B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧
D.①②③④⑤⑥⑦⑧
答案:C
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
6.(双选)下列组合中,两种配合物中心离子的电荷数和配位数均相同的是( )
A.K[Ag(CN)2]、[Cu(NH3)4]SO4
B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4
C.[Ag(NH3)2]Cl、K[Ag(CN)2]
D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl
答案:BC
解析:A项,两种配合物中心离子的电荷数分别是1+和2+,配位数分别是2和4,不符合题目要求;B项,两种配合物中心离子的电荷数均是2+,配位数均是4,符合题目要求;C项,两种配合物中心离子的电荷数均是1+,配位数均是2,符合题目要求;D项,两种配合物中心离子的电荷数分别是2+和1+,配位数分别是4和2,不符合题目要求。
7.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有 (填字母)。
A.配位键 B.极性共价键
C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间结构,[Cu(NH3)4]2+中的两个NH3分子被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为 。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
答案:(1)AB (2)平面正方形 (3)sp2
解析:[Cu(NH3)4]2+由铜离子与氨分子通过配位键形成,氨分子内部的化学键是极性共价键。根据[Cu(NH3)2Cl2]有两种不同的结构,可知[Cu(NH3)4]2+的空间结构是平面正方形。HOCH2CH=CH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化;CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。
