人教版(2019)选择性必修一 1.1.1反应热 焓变(共24张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 1.1.1反应热 焓变(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
反应热 焓变(第一课时)
年 级:高二 学 科:化学(人教版)
1 中和反应热测定
3 微观探析反应热
反应热 焓变
2 宏观认识反应热
问题1:科学上是怎样定义反应热,如何解读定义中的相关概念?
反应热:在等温条件下,化学反应体系向环境释放或者从环境 吸收的热量,称为化学反应的热效应,简称反应热。
【注】化学反应后,使反应后体系的温度恢复到反应前体系的温度。
1 中和反应热测定
以盐酸和NaOH溶液反应为例认识[体系]和[环境]
环境∶与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系与环境之间
存在物质交换或能量交换
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)
1 中和反应热测定
信息:⑴热量的计算公式:Q=cmΔt;
⑵已知水的比热容c=4.18 J/(g·℃),稀水溶液的比热容近似
为c=4.18 J/(g·℃)。
问题2:测定中和反应的反应热时,需要测定哪些数据?
盐酸和NaOH溶液的质量
反应后体系的最高温度
1 中和反应热测定
盐酸和NaOH溶液的起始温度(取平均值)
问题3:影响实验结果的主要因素是什么?作为中和反应反
应热的测定容器,应具备哪些特征?
温度计
保温隔热措施(防止热量散失)
1 中和反应热测定
体系与环境的能量交换
简易量热计
保温、隔热、减少热量损失
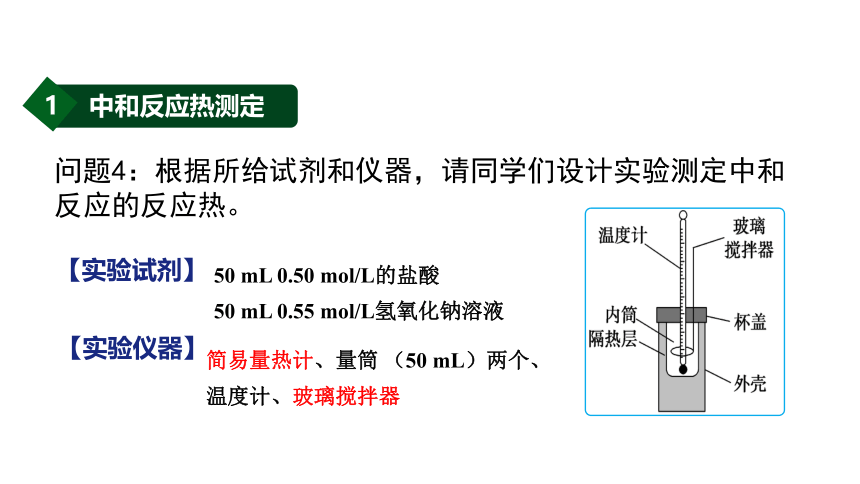
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
【实验试剂】
【实验仪器】
问题4:根据所给试剂和仪器,请同学们设计实验测定中和反应的反应热。
1 中和反应热测定
【数据处理】
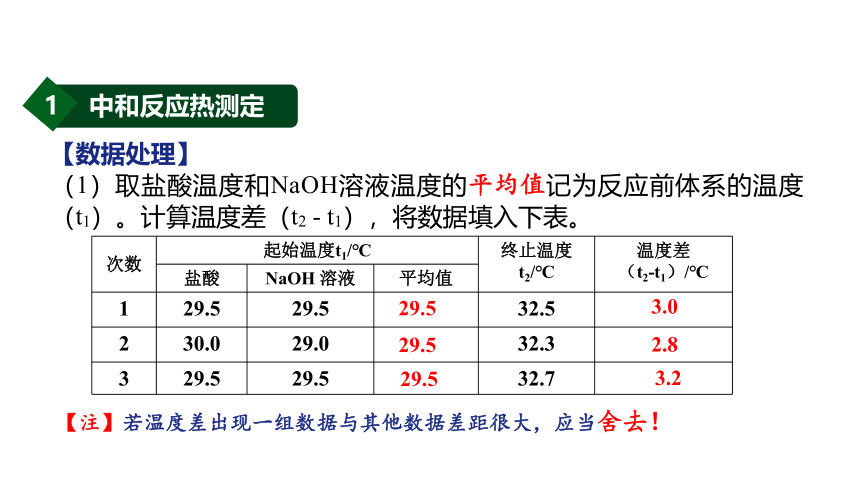
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2 - t1),将数据填入下表。
次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
盐酸 NaOH 溶液 平均值 1 29.5 29.5 32.5
2 30.0 29.0 32.3
3 29.5 29.5 32.7
29.5
29.5
29.5
2.8
3.2
3.0
【注】若温度差出现一组数据与其他数据差距很大,应当舍去!
1 中和反应热测定
【数据处理】
(2)盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1g·cm3,
反应后生成的溶液的比热容 c=4.18 J/(g·℃)。计算该实验
中盐酸和NaOH反应放出的热量。
。
中和热为 。
=1.254 kJ
= — 50.16 kJ/mol
Q=cmΔt =4.18 ×100 Δt =
1 中和反应热测定
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
中和热:在稀溶液中 酸碱中和生成 1mol水的反应热。
1 中和反应热测定
50.16kJ/mol
57.3kJ/mol
VS
测得的数据
资料上的数据
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
酸碱溶液混合不够快,造成热量损失
量热计的保温绝热效果不好
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
1 中和反应热测定
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
【课堂评价一】在25℃和101kPa下,下列组合的稀溶液发生中和反应时,能放出57.3 kJ的热量打“√”。
1 中和反应热测定
等压反应热
(焓变)
体系内能改变
产生反应热
内能(符号为 U): 体系内物质的各种能量的总和,受温度和物质的聚集状态等影响。
焓(符号为 H):是物质所具有的能量, 与内能有关的物理量。
单位:kJ·mol-1
对于一个化学反应,生成物的总焓与反应物的总焓之差称为焓变,符号是△H。
单位:kJ·mol-1
ΔH=生成物总能量(H生) - 反应物总能量(H反)
2 宏观认识反应热
ΔH <0
焓(H)
反应物
生成物
反应进程
ΔH=生成物总能量(H生) - 反应物总能量(H反)
放热反应
[例1]在25℃和101 kPa下,1 molH2与
1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
ΔH 越小,放出热量越多。
2 宏观认识反应热
ΔH >0
焓(H)
反应物
生成物
反应进程
吸热反应
[例2]在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
ΔH越大,吸收热量越多。
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
原子重新组合
吸收 能量
放出 能量
键生成
键断裂
反应物
生成物
化学反应
问题1:请在坐标图上定量表示H2+Cl2=2HCl反应过程中的能量变化
注:涉及哪几个过程?
哪个过程吸收多少能量?
哪个过程释放多少能量?
3 微观探析反应热
H2(g)+Cl2(g)
2 H (g)
△E1=436kJ
2 Cl (g)
△E2=243kJ
2 HCl (g)
焓 H
△E3= kJ
△E3= — 862 kJ
3 微观探析反应热
H2(g)+Cl2(g)
2 H (g)
△E1=436kJ
2 HCl (g)
△E = kJ
△E = -183 kJ
焓 H
2 Cl (g)
△E2=243kJ
△E3= kJ
△E3= — 862 kJ
3 微观探析反应热
3 微观探析反应热
H2(g)+Cl2(g)
2 HCl (g)
△H = -183 kJ/mol
焓 H
问题2:请同学们归纳从微观角度如何计算化学反应的反应热?
ΔH=+反应物总键能 - 生成物总键能
H2(g)+Cl2(g)
2 HCl (g)
△H = -183 kJ/mol
H2(g) + Cl2(g)= 2HCl(g) △H = -183 kJ/mol
问题3:请尝试用方程式表示出H2+Cl2=2HCl反应过程中的能量变化。
焓 H
3 微观探析反应热
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
课堂小结
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=+反应物总键能 - 生成物总键能
课堂小结
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
ΔH=+反应物总键能 - 生成物总键能
课堂小结
反应热 焓变(第一课时)
年 级:高二 学 科:化学(人教版)
1 中和反应热测定
3 微观探析反应热
反应热 焓变
2 宏观认识反应热
问题1:科学上是怎样定义反应热,如何解读定义中的相关概念?
反应热:在等温条件下,化学反应体系向环境释放或者从环境 吸收的热量,称为化学反应的热效应,简称反应热。
【注】化学反应后,使反应后体系的温度恢复到反应前体系的温度。
1 中和反应热测定
以盐酸和NaOH溶液反应为例认识[体系]和[环境]
环境∶与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系与环境之间
存在物质交换或能量交换
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)
1 中和反应热测定
信息:⑴热量的计算公式:Q=cmΔt;
⑵已知水的比热容c=4.18 J/(g·℃),稀水溶液的比热容近似
为c=4.18 J/(g·℃)。
问题2:测定中和反应的反应热时,需要测定哪些数据?
盐酸和NaOH溶液的质量
反应后体系的最高温度
1 中和反应热测定
盐酸和NaOH溶液的起始温度(取平均值)
问题3:影响实验结果的主要因素是什么?作为中和反应反
应热的测定容器,应具备哪些特征?
温度计
保温隔热措施(防止热量散失)
1 中和反应热测定
体系与环境的能量交换
简易量热计
保温、隔热、减少热量损失
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
【实验试剂】
【实验仪器】
问题4:根据所给试剂和仪器,请同学们设计实验测定中和反应的反应热。
1 中和反应热测定
【数据处理】
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2 - t1),将数据填入下表。
次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
盐酸 NaOH 溶液 平均值 1 29.5 29.5 32.5
2 30.0 29.0 32.3
3 29.5 29.5 32.7
29.5
29.5
29.5
2.8
3.2
3.0
【注】若温度差出现一组数据与其他数据差距很大,应当舍去!
1 中和反应热测定
【数据处理】
(2)盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1g·cm3,
反应后生成的溶液的比热容 c=4.18 J/(g·℃)。计算该实验
中盐酸和NaOH反应放出的热量。
。
中和热为 。
=1.254 kJ
= — 50.16 kJ/mol
Q=cmΔt =4.18 ×100 Δt =
1 中和反应热测定
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
中和热:在稀溶液中 酸碱中和生成 1mol水的反应热。
1 中和反应热测定
50.16kJ/mol
57.3kJ/mol
VS
测得的数据
资料上的数据
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
酸碱溶液混合不够快,造成热量损失
量热计的保温绝热效果不好
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
1 中和反应热测定
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
【课堂评价一】在25℃和101kPa下,下列组合的稀溶液发生中和反应时,能放出57.3 kJ的热量打“√”。
1 中和反应热测定
等压反应热
(焓变)
体系内能改变
产生反应热
内能(符号为 U): 体系内物质的各种能量的总和,受温度和物质的聚集状态等影响。
焓(符号为 H):是物质所具有的能量, 与内能有关的物理量。
单位:kJ·mol-1
对于一个化学反应,生成物的总焓与反应物的总焓之差称为焓变,符号是△H。
单位:kJ·mol-1
ΔH=生成物总能量(H生) - 反应物总能量(H反)
2 宏观认识反应热
ΔH <0
焓(H)
反应物
生成物
反应进程
ΔH=生成物总能量(H生) - 反应物总能量(H反)
放热反应
[例1]在25℃和101 kPa下,1 molH2与
1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
ΔH 越小,放出热量越多。
2 宏观认识反应热
ΔH >0
焓(H)
反应物
生成物
反应进程
吸热反应
[例2]在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
ΔH越大,吸收热量越多。
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
原子重新组合
吸收 能量
放出 能量
键生成
键断裂
反应物
生成物
化学反应
问题1:请在坐标图上定量表示H2+Cl2=2HCl反应过程中的能量变化
注:涉及哪几个过程?
哪个过程吸收多少能量?
哪个过程释放多少能量?
3 微观探析反应热
H2(g)+Cl2(g)
2 H (g)
△E1=436kJ
2 Cl (g)
△E2=243kJ
2 HCl (g)
焓 H
△E3= kJ
△E3= — 862 kJ
3 微观探析反应热
H2(g)+Cl2(g)
2 H (g)
△E1=436kJ
2 HCl (g)
△E = kJ
△E = -183 kJ
焓 H
2 Cl (g)
△E2=243kJ
△E3= kJ
△E3= — 862 kJ
3 微观探析反应热
3 微观探析反应热
H2(g)+Cl2(g)
2 HCl (g)
△H = -183 kJ/mol
焓 H
问题2:请同学们归纳从微观角度如何计算化学反应的反应热?
ΔH=+反应物总键能 - 生成物总键能
H2(g)+Cl2(g)
2 HCl (g)
△H = -183 kJ/mol
H2(g) + Cl2(g)= 2HCl(g) △H = -183 kJ/mol
问题3:请尝试用方程式表示出H2+Cl2=2HCl反应过程中的能量变化。
焓 H
3 微观探析反应热
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
课堂小结
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=+反应物总键能 - 生成物总键能
课堂小结
1 中和反应热测定
3 微观探析反应热
2 宏观认识反应热
ΔH=生成物总能量(H生) - 反应物总能量(H反)
ΔH=+反应物总键能 - 生成物总键能
课堂小结
