浙江省化学学考选考试题变化趋势分析(共50张PPT)
文档属性
| 名称 | 浙江省化学学考选考试题变化趋势分析(共50张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-26 15:42:41 | ||
图片预览







文档简介
(共50张PPT)
浙江省化学学考选考试题变化趋势分析
一、试题变化趋势分析
二、学生答题情况及阅卷体会
三、教学及复习备考建议
(一)、考查的知识点及分布稳定,几乎没有变化
一、试题变化趋势分析
(二)、考查能力要求的变化-----综合性加强,能力要求提高
(三)、考查形式的变化--------信息情景型题目在增多,“陌生知识”频出现
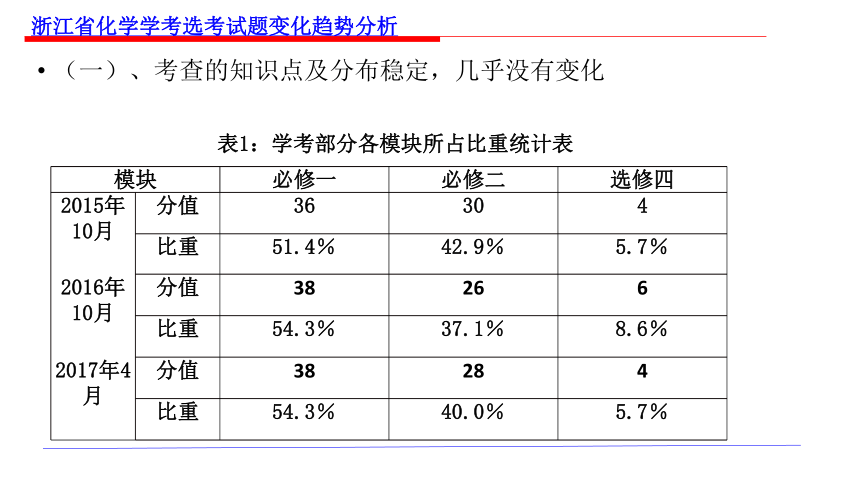
表1:学考部分各模块所占比重统计表
模块 必修一 必修二 选修四
2015年10月 分值 36 30 4
比重 51.4% 42.9% 5.7%
2016年10月 分值 38 26 6
比重 54.3% 37.1% 8.6%
2017年4月 分值 38 28 4
比重 54.3% 40.0% 5.7%
(一)、考查的知识点及分布稳定,几乎没有变化
2015年10月20.某温度时,2NO(g)+O2(g)=2NO2(g)反应到2 s后,NO的浓度减少了0.06 mol·L-1,则以O2表示该时段的化学反应速率是
A.0.03 mol·L-1·s-1 B.0.015 mol·L-1·s-1
C.0.12 mol·L-1·s-1 D.0.06 mol·L-1·s-1
(二)、考查能力要求的变化-----综合性加强,能力要求提高
2016年10月21.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是
A.25℃时,在10~30min内,
R的分解平均速率为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,在50min时,R的分解百分率相等
C.对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速 率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
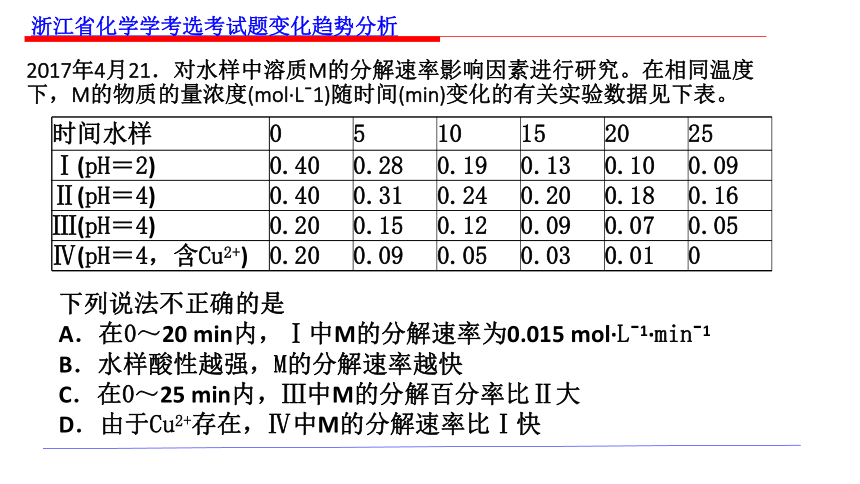
2017年4月21.对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间水样 0 5 10 15 20 25
Ⅰ(pH=2) 0.40 0.28 0.19 0.13 0.10 0.09
Ⅱ(pH=4) 0.40 0.31 0.24 0.20 0.18 0.16
Ⅲ(pH=4) 0.20 0.15 0.12 0.09 0.07 0.05
Ⅳ(pH=4,含Cu2+) 0.20 0.09 0.05 0.03 0.01 0
下列说法不正确的是
A.在0~20 min内,Ⅰ中M的分解速率为0.015 mol·Lˉ1·minˉ1
B.水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快
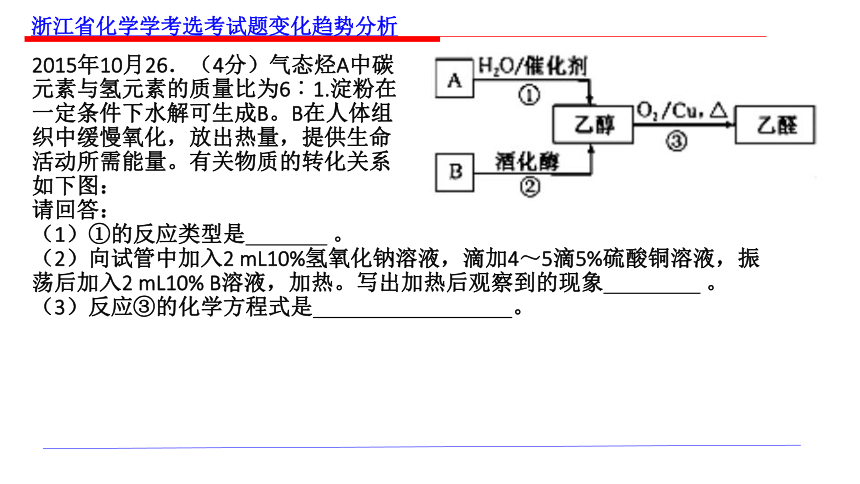
2015年10月26.(4分)气态烃A中碳
元素与氢元素的质量比为6︰1.淀粉在
一定条件下水解可生成B。B在人体组
织中缓慢氧化,放出热量,提供生命
活动所需能量。有关物质的转化关系
如下图:
请回答:
(1)①的反应类型是 。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象 。
(3)反应③的化学方程式是 。
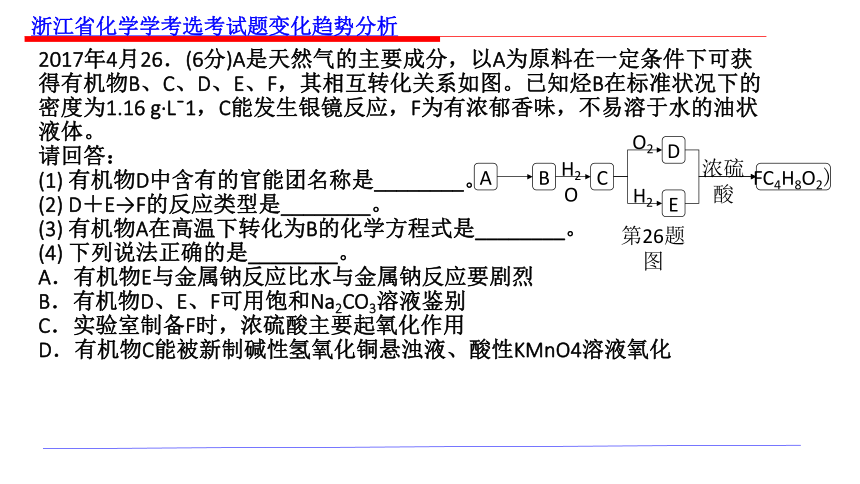
2017年4月26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(1) 有机物D中含有的官能团名称是________。
(2) D+E→F的反应类型是________。
(3) 有机物A在高温下转化为B的化学方程式是________。
(4) 下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
浓硫酸
O2
H2
H2O
A
B
C
D
E
FC4H8O2)
第26题图
(三)、考查形式的变化--------信息情景型题目在增多,“陌生知识”频出现
2016年10月26要求写方程式:CH2=CH2 + CH3COOH CH3COOCH2CH3。
2016年10月27求X的化学式为Cu3 (OH)4 SO4,或者 2 Cu (OH)2 CuSO4 ;
2016年10月30.3NaClO(aq)=2NaCl(aq)+NaClO3(aq) △H=-116 kJ·mol-1
2NaClO3 + O2 2NaClO4 。
2017年4月26 要求写方程式: 2CH4 → C2H2+3H2
2017年4月27 要求写方程式: 2NH3 + 3CuO== N2 + 3H2O + 3Cu。
2017年4月30要求写方程式:
Al2O3(s)+ 3C(s)+ N2(g)===2Al(g) +3CO(g)+ 2AlN(s),ΔH=+1026 kJ·molˉ1
2017年4月31(3)要求写方程式: 2ClO3ˉ +2Clˉ +4H+===2ClO2↑+Cl2↑+2H2O
2017年4月32.试图打破有机推断受苯及其同系物的束缚和约束,出现环醚。
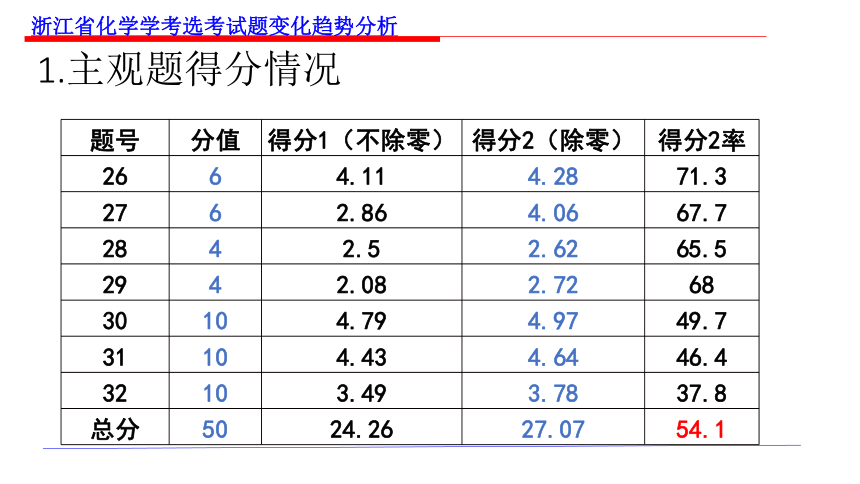
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
1.主观题得分情况
题号 分值 得分1(不除零) 得分2(除零) 得分2率
26 6 4.11 4.28 71.3
27 6 2.86 4.06 67.7
28 4 2.5 2.62 65.5
29 4 2.08 2.72 68
30 10 4.79 4.97 49.7
31 10 4.43 4.64 46.4
32 10 3.49 3.78 37.8
总分 50 24.26 27.07 54.1
得分率分布 0 1 2 3 4 5 6 7 8 9 10
26 3.79 5.6 9.8 16.3 16.69 16 31.79
27 29.39 0.1 19.6 1.4 26.39 1 22
28 4.3 7.8 34.2 40.5 13.19
29 33.5 2.09 35.1 21.5 17.8
30 3.5 8 11.3 12.7 13.3 11.3 10.59 10 8.6 6.89 3.79
31 4.5 7.1 10.3 13.3 15.8 15.8 13.5 9.8 6,4 3.4 0.2
32 7.9 29.39 11.8 12.6 7.19 4.9 5.79 6.19 4.59 7.29 2.5
表3:2017年4月主观题得分值分布情况
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(1) 有机物D中含有的官能团名称是________。
【典型错误】
①物质D判断错:“羧基”写成“羟基”、“醛基”、“碳碳双键”;
②名称写成符号:如—COOH或符号与名称同时出现:—COOH(羧基);③只有“羧”没有“基”;
④错别字:“羧”写成“梭”、“鋑”、“羚”或字典中没有的字
参考答案:羧基
评分标准:判断错或错别字不得分
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(2) D+E→F的反应类型是________。
【典型错误】①审题不清,反应类型写成乙酸和乙醇发生酯化反应的化学方程式;
②“取代反应”或“酯化反应”仅写成“取代”或“酯化”,缺少“反应”两字;
③错别字:“代”写成“化”、“酯”写成“脂”或“酯”字的偏旁“酉”写成“西”;
④反应类型不清楚:写成“水解反应”、“皂化反应”、“加成反应”,甚至写成“化合反应”、“复分解反应”
参考答案:取代反应(或酯化反应)
评分标准:写成方程式或错别字不得分,写多个看第一个
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(3) 有机物A在高温下转化为B的化学方程式是________。
【典型错误】①化学方程式中反应物、产物书写没有用结构简式或者结构简式写错,如:甲烷写成结构式、CH3;乙炔写成C2H2、CHCH;
②自编化学方程式达20多种;
③产物漏写H2或者化学方程式没有配平;
④反应物或生成物中出现“C”或“H2O”;反应物写成C2H4(天然气主要成分未知)或生成物乙炔写成C2H4;
⑤“→”写成“=”代替
参考答案:
评分标准:写等号,不写高温均不扣分,未配平扣1分
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(4) 下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
出现漏选、多选、错选,主要有如下几种:①只选B或D;②选ABD;③选A;④选AB;
参考答案:BD
评分标准:对一个得1分,错选、多选不得分
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(1) X的化学式是________。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
【典型错误】①CuO写成CuO2、Cu2O、FeO、Fe3O4 ——计算错误;
②CuO写成Cu2O2、Cu4O4、(CuO) x ——基础薄弱,主干知识CuO的化学式不清晰;
③CuO写成 Cu(OH)2 ——审题不清(X仅含两种元素)、知识缺乏(Cu(OH)2受热分解未知)。
参考答案:CuO
评分标准:写成(CuO)n给1分,其他不给分
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(2) 固体甲与稀硫酸反应的离子方程式是________。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
参考答案:
评分标准:未配平扣1分,写成化学方程式不得分
【典型错误】①审题不清,离子方程式写成化学方程式;
②反应物Cu2O写成CuO或Fe3O4,并按此写相应的生成物;
③SO42-没有消除——CuSO4在水溶液中完全电离未知;
④写成CuO + 2H+ = Cu2+ + H2O
⑤写成Cu2O + 2H+ = 2Cu2+ + H2O
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(3) 加热条件下氨气被固体X氧化成一种
气体单质,写出该反应的化学方程式____ __。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
参考答案:
评分标准:产物既有Cu也有Cu2O,只要配平,均得2分,未配平扣1分
【典型错误】CuO的还原产物可以Cu或Cu2O,配平正确即可;
①没配平;
②反应物CuO写成Cu2O;
③产物出现NO、HNO3、CuN、CuNH2、Cu(NH2)2、Cu(OH)2、H2等——审题不清(NH3和CuO加热反应生成一种气体单质)
29.(4分)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
(1) 将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]∶n(NH4Cl)为________。
第29题图
0
2.33
V/mL
m/g
100
(2) 另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl—)=________(溶液体积变化忽略不计)。
29题 参考答案 评分标准
(1) 1∶2 1∶2或1/2给2分,0.5或其他给1分
(2) 0.100 mol·Lˉ1 出现0.1,不管单位、有效数字给1分,“三全”给2分
30.【加试题】(10分)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1) 已知:2Al2O3(s)===4Al(g)+3O2(g)
ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g)
ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s)
ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是________,该反应自发进行的条件
________。
【典型错误】热化学方程式或物质状态未写,书写时为配平,焓变值与计算系数未对应,当然还有很大一部分因为粗心将CO写成CO2 甚至于将数字1026写成1062,直接计算成1025,1027等等,这些都是粗心造成的
参考答案:Al2O3(s)+3C(s)+N2(g)===2AlN(s)+3CO(g)
ΔH=1026 kJ·molˉ1
评分标准:配平错,0分;“kJ·molˉ”箭头、等号 不扣分
配平对, H数值错或单位错,或状态有问题,或AlN写成ALN,均1分
参考答案:高温
评分标准:写“高温”“较高温度”“ H>0, S>0,高温”均给分
【典型错误】回答称加热到一定程度,给予足够的热量等等,学生甚至给出了具体的问题如4760C 5000C 27000C
(2) 在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
①下列说法不正确的是________
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
【典型错误】漏选C选项
参考答案:CD
评分标准:漏选给1分,多选、错选不给分
(2) 在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)
【典型错误】运算能力差,表达式中缺少字母,指数错误
参考答案:
评分标准: 均给2分
不化简的计算式、表达式不给分
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
平台在t1之前,斜率正确(大于350℃)给1分;
平台在t1之前,数值介于[0.14,0.15]之间,斜率正确(大于350℃),且不可与350℃线条重合给2分;
30.(3) 据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
___________________________________。
【典型错误】:1)未审清题目:①电极反应式不是电解反应式 ② 碱性不少学生还添了H+
2 ) 书写不规范,不注重细节如OH-的负电荷标成了+
参考答案:CO2+6H2O+8eˉ===6CH4+8OHˉ
评分标准:CO2+6H2O+8eˉ===6CH4+8OHˉ
CO32-+7H2O+8eˉ===6CH4+10OHˉ
HCO-+6H2O+8eˉ===6CH4+9OHˉ
以上答案均给2分
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(1) 仪器A的作用是________;冰水浴冷却的目的是________(写两种)。
【典型错误】①错答成防止产物浓度过高分解,,H2O2挥发,H2O2失活,NaClO2水解;重复答题,防止ClO2蒸发和使ClO2液化。
②答题不指明物质,笼统讲物质分解。
③应该是增大ClO2的溶解度,错答成减小ClO2的溶解度
④不清楚固体、液体、气体溶解度与温度的关系
⑤凝固点、沸点不分,气化、液化、凝固、熔化、升华、凝华分不清。
【典型错误】
将平衡压强和防倒吸混淆在一起,答成平衡压强不得分
参考答案:降低NaClO2的溶解度;增加ClO2的溶解度;减少H2O2的分解;减少ClO2的分解
参考答案:防止倒吸
评分标准:安全瓶也对,写有多个答案时只看第一个
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(2) 空气流速过快或过慢,均降低NaClO2产率,试解释其原因________。
【典型错误】①将过快或过慢弄反②从反应速率去分析,没有从反应的程度去分析
③空气流速过慢ClO2不能及时被移走,浓度过高导致慢ClO2分解(错答率高一些)。
④错答成:过慢ClO2残留在三颈烧瓶中,使产率下降;过慢空气中的氧气氧化ClO2;过慢空气中的CO2与NaOH反应;错误的理解成空气中的氧气和CO2对反应的影响,对产率的影响,过慢H2O2会分解等等
参考答案:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;
空气流速过快时,ClO2不能被充分吸收。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(3) Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①________(用离子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。
参考答案:
【典型错误】没配平;NaClO2不拆,不知道NaClO2是溶于水的;写成归中反应,死记方程式;酸性条件下出OH-
分析:连续反应不会写,不会用减法,也不理解催化剂会参加反应。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。
水浴加热
温度计
出水
进水
H2O2
B
第31题图2
【典型错误】
H2O(g)、H2O2、O2、NaClO2、ClO2等等。
参考答案:减压
评分标准:只看第一个答案
参考答案:H2O
评分标准:蒸馏水,水都可,水蒸气不给分
【典型错误】防倒吸;平衡气压;吸收尾气(O2、ClO2)冷凝回流、分离提纯、避免空气中气体的干扰等等。总之,考生不清楚该装置的目的是降低水的沸点,以防止H2O2的分解。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(5) 抽滤法分离NaClO2过程中,下列操作不正确的是
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
参考答案:C
评分标准:多选、错选均不给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(1) A→B的反应类型是________。
【典型错误】总体得分率较高,常见的错误为反应类型为化合,加成,消去,还原,氧化,缩合或多写类型等
参考答案:取代反应
评分标准:1分,反应不写不扣分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(2) 下列说法不正确的是________。
A.化合物A的官能团是硝基
B.化合物B可发生消去反应
C.化合物E能发生加成反应
D.哌替啶的分子式是C15H21NO2
【典型错误】多选C或D较多
参考答案:A
评分标准:1分,写a也给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(3) 写出B+C→D的化学反应方程式________。
【典型错误】①反应物或产物写成分子式或结构简式,书写不当,
②方程式未配平,如产物NH3,NaOH,NH4Cl,HCl漏写或系数不符
参考答案:羧基
评分标准:反应条件不要求,完全正确3分三个大分子结构简式正确,遗漏小分子2分三个大分子可以键线式,可以混合结构简式
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(4) 设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选)________。
【典型错误】① 审题不清 以苯为反应起始物
② 结构简式或书写错误
③ 反应条件不当,如物质写成Br Cl NaCl 模糊化为“一定条件”等
参考答案:
评分标准:两步产物均正确,但均无条件给1分,第一步条件写光照或高温给分第二步条件写NaNH2与HCN也给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(5) 写出同时符合下列条件的C的所有同分异构体的结构简式________。
①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
【典型错误】同分异构体书写主要是不全,重复或饱和度错误
参考答案:
评分标准:3分,多于3个看前3个,
对1个给1分
28.(4分)FeSO4受热分解的化学方程式为:
请回答:
(1) 将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
(2) 设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)________。
品红溶液褪色答成:品红溶液变色、品红溶液褪色又复原、品红溶液变红、品红溶液变蓝、BaCl2溶液变浑浊
过滤答成:加HCl溶解过滤、溶解过滤、蒸发浓缩冷却结晶、溶解、分离、倾析、定容、打捞、捞出来、弄出来、分离出来、收取、拿取、制取、取出、倒出、蒸发、取样
实验方案设计,我将学生错误答案归为8大类:
第一类,审题不清,方法错误
1.用物理方法:①磁铁法、②溶解性判断法:加水溶解,若有不溶性红色固体即为Fe2O3,
2.固体直接加判断法:取固体,滴加KSCN溶液,若溶液显血红色即为Fe2O3 。
第二类,审题不清,方向错误
①检验SO2,②检验SO3 ③检验Fe④检验FeO⑤检验 Fe3O4,⑥只检验Fe3+
第三类,知识错误型:把固体溶解于NaOH溶液中,再进行丁达尔实验,若有丁达尔效应,则说明产物中有Fe3+ ;
第四类,方案不严谨
①用硝酸溶解,滴加KSCN溶液,检验Fe3+ 的存在,,②先用盐酸溶解,再加酸性高锰酸钾溶液,检查Fe2+
第五类,叙述不完整
①缺少溶解;②缺少结论;③只说方法,没有现象和结论。
第六类,细节错误
①┅┅,滴加KSCN溶液,出现血红色沉淀,┅┅
②┅┅,滴加KSCN溶液,出现红褐色沉淀,┅┅
③┅┅,滴加KSCN溶液,出现砖红色沉淀,┅┅
④┅┅,滴加KSCN溶液,溶液变蓝,┅┅
第七类,画蛇添足型
┅┅,滴加酸性高锰酸钾溶液,若溶液不褪色,则无Fe2+,即无FeO。
第八类,调侃作恶型
①漫画
②调侃型:拿起来吃,口味还行,那就是硫酸亚铁了,对了,牙齿上可能会有点颜色:设计方案很麻烦,拿给化学老师看一看:阅卷辛苦了,给点分吧!
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
2.核心知识网络化
1. 双基和能力两手抓
三、教学及复习备考建议
3.解题方法技巧化
重要有机物之间的相互转化关系
CH=CH
CH2Br
CH2Br
CH2OH
CH2OH
CHO
CHO
COOH
COOH
[ OC—CO-OH2C-CH2O]n
CH2=CH2
O=C
O=C
CH2
CH2
O
O
2.核心知识网络化
烃
R—H
卤代烃
R—X
醇类
R—OH
醛类
R—CHO
羧酸
R—COOH
酯类
RCOOR`
卤代
消去
取代
水解
氧化
加氢
酯化
水解
氧化
2.核心知识网络化
3.解题方法技巧化
2016年10月24.已知还原性:SO32- >I―。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A.当a ≥ b时,发生的离子反应为SO32- + Cl2 + H2O = SO42- + 2H+ + 2Cl―
B.当5a = 4b时,发生的离子反应为
4SO32- + 2I―+ 5Cl2 + 4H2O = 4SO42- + I2 + 8H+ + 10Cl―
C.当a≤b≤ 时,反应中转移电子的物质的量n (e―)为a mol ≤ n(e―) ≤3a mol
D.当a < b <
时,溶液中SO42-、I―与Cl―的物质的量之比为a :(3a—2b) :2b
2015年10月25.已知氧化性Br2>Fe3+。向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是
A.离子的还原性强弱:Fe2+>Br->Cl-
B.当a≥2b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl-
C.当a=b时,反应后的离子浓度:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
D.当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
﹒
Cl2 /mol
1/2
3/2
①
②
③
第①阶段:Cl2与FeBr2物质的量小于等于1:2时,氯气的量不足,只氧化Fe2+,所以发生的离子反应为:2Fe2++Cl2═2Fe3++2Cl-
第②阶段:Cl2与FeBr2物质的量介于1:2与3:2之间时,Fe2+被完全氧化,Br-部分被氧化,离子方程式有多种可能,当a=b时,可以确定加入的氯气过量,氯气把Fe2+完全氧化成Fe3+,还有部分剩余,剩余的氯气可继续与Br-发生反应,刚好把一半Br-氧化,发生的离子反应是:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- ,
第③阶段:Cl2与FeBr2物质的量大于等于3:2之间时,氯气足量,Fe2+、Br-与足量Cl2反应,Br-、Fe2+都被完全氧化,发生的离子反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
下列各组混合物中,无论以何种比例混合,取1摩使之充分燃烧,耗氧量为定值的是
A 、CH4、C2H4O2
B 、C2H6O、C3H6
C、C3H4、C3H6O
D、 CH3CH2CH2OH、CH3COOH
谢谢!
浙江省化学学考选考试题变化趋势分析
一、试题变化趋势分析
二、学生答题情况及阅卷体会
三、教学及复习备考建议
(一)、考查的知识点及分布稳定,几乎没有变化
一、试题变化趋势分析
(二)、考查能力要求的变化-----综合性加强,能力要求提高
(三)、考查形式的变化--------信息情景型题目在增多,“陌生知识”频出现
表1:学考部分各模块所占比重统计表
模块 必修一 必修二 选修四
2015年10月 分值 36 30 4
比重 51.4% 42.9% 5.7%
2016年10月 分值 38 26 6
比重 54.3% 37.1% 8.6%
2017年4月 分值 38 28 4
比重 54.3% 40.0% 5.7%
(一)、考查的知识点及分布稳定,几乎没有变化
2015年10月20.某温度时,2NO(g)+O2(g)=2NO2(g)反应到2 s后,NO的浓度减少了0.06 mol·L-1,则以O2表示该时段的化学反应速率是
A.0.03 mol·L-1·s-1 B.0.015 mol·L-1·s-1
C.0.12 mol·L-1·s-1 D.0.06 mol·L-1·s-1
(二)、考查能力要求的变化-----综合性加强,能力要求提高
2016年10月21.为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是
A.25℃时,在10~30min内,
R的分解平均速率为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,在50min时,R的分解百分率相等
C.对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速 率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
2017年4月21.对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间水样 0 5 10 15 20 25
Ⅰ(pH=2) 0.40 0.28 0.19 0.13 0.10 0.09
Ⅱ(pH=4) 0.40 0.31 0.24 0.20 0.18 0.16
Ⅲ(pH=4) 0.20 0.15 0.12 0.09 0.07 0.05
Ⅳ(pH=4,含Cu2+) 0.20 0.09 0.05 0.03 0.01 0
下列说法不正确的是
A.在0~20 min内,Ⅰ中M的分解速率为0.015 mol·Lˉ1·minˉ1
B.水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快
2015年10月26.(4分)气态烃A中碳
元素与氢元素的质量比为6︰1.淀粉在
一定条件下水解可生成B。B在人体组
织中缓慢氧化,放出热量,提供生命
活动所需能量。有关物质的转化关系
如下图:
请回答:
(1)①的反应类型是 。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象 。
(3)反应③的化学方程式是 。
2017年4月26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(1) 有机物D中含有的官能团名称是________。
(2) D+E→F的反应类型是________。
(3) 有机物A在高温下转化为B的化学方程式是________。
(4) 下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
浓硫酸
O2
H2
H2O
A
B
C
D
E
FC4H8O2)
第26题图
(三)、考查形式的变化--------信息情景型题目在增多,“陌生知识”频出现
2016年10月26要求写方程式:CH2=CH2 + CH3COOH CH3COOCH2CH3。
2016年10月27求X的化学式为Cu3 (OH)4 SO4,或者 2 Cu (OH)2 CuSO4 ;
2016年10月30.3NaClO(aq)=2NaCl(aq)+NaClO3(aq) △H=-116 kJ·mol-1
2NaClO3 + O2 2NaClO4 。
2017年4月26 要求写方程式: 2CH4 → C2H2+3H2
2017年4月27 要求写方程式: 2NH3 + 3CuO== N2 + 3H2O + 3Cu。
2017年4月30要求写方程式:
Al2O3(s)+ 3C(s)+ N2(g)===2Al(g) +3CO(g)+ 2AlN(s),ΔH=+1026 kJ·molˉ1
2017年4月31(3)要求写方程式: 2ClO3ˉ +2Clˉ +4H+===2ClO2↑+Cl2↑+2H2O
2017年4月32.试图打破有机推断受苯及其同系物的束缚和约束,出现环醚。
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
1.主观题得分情况
题号 分值 得分1(不除零) 得分2(除零) 得分2率
26 6 4.11 4.28 71.3
27 6 2.86 4.06 67.7
28 4 2.5 2.62 65.5
29 4 2.08 2.72 68
30 10 4.79 4.97 49.7
31 10 4.43 4.64 46.4
32 10 3.49 3.78 37.8
总分 50 24.26 27.07 54.1
得分率分布 0 1 2 3 4 5 6 7 8 9 10
26 3.79 5.6 9.8 16.3 16.69 16 31.79
27 29.39 0.1 19.6 1.4 26.39 1 22
28 4.3 7.8 34.2 40.5 13.19
29 33.5 2.09 35.1 21.5 17.8
30 3.5 8 11.3 12.7 13.3 11.3 10.59 10 8.6 6.89 3.79
31 4.5 7.1 10.3 13.3 15.8 15.8 13.5 9.8 6,4 3.4 0.2
32 7.9 29.39 11.8 12.6 7.19 4.9 5.79 6.19 4.59 7.29 2.5
表3:2017年4月主观题得分值分布情况
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(1) 有机物D中含有的官能团名称是________。
【典型错误】
①物质D判断错:“羧基”写成“羟基”、“醛基”、“碳碳双键”;
②名称写成符号:如—COOH或符号与名称同时出现:—COOH(羧基);③只有“羧”没有“基”;
④错别字:“羧”写成“梭”、“鋑”、“羚”或字典中没有的字
参考答案:羧基
评分标准:判断错或错别字不得分
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(2) D+E→F的反应类型是________。
【典型错误】①审题不清,反应类型写成乙酸和乙醇发生酯化反应的化学方程式;
②“取代反应”或“酯化反应”仅写成“取代”或“酯化”,缺少“反应”两字;
③错别字:“代”写成“化”、“酯”写成“脂”或“酯”字的偏旁“酉”写成“西”;
④反应类型不清楚:写成“水解反应”、“皂化反应”、“加成反应”,甚至写成“化合反应”、“复分解反应”
参考答案:取代反应(或酯化反应)
评分标准:写成方程式或错别字不得分,写多个看第一个
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(3) 有机物A在高温下转化为B的化学方程式是________。
【典型错误】①化学方程式中反应物、产物书写没有用结构简式或者结构简式写错,如:甲烷写成结构式、CH3;乙炔写成C2H2、CHCH;
②自编化学方程式达20多种;
③产物漏写H2或者化学方程式没有配平;
④反应物或生成物中出现“C”或“H2O”;反应物写成C2H4(天然气主要成分未知)或生成物乙炔写成C2H4;
⑤“→”写成“=”代替
参考答案:
评分标准:写等号,不写高温均不扣分,未配平扣1分
26.(6分)A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g·Lˉ1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(4) 下列说法正确的是________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
出现漏选、多选、错选,主要有如下几种:①只选B或D;②选ABD;③选A;④选AB;
参考答案:BD
评分标准:对一个得1分,错选、多选不得分
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(1) X的化学式是________。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
【典型错误】①CuO写成CuO2、Cu2O、FeO、Fe3O4 ——计算错误;
②CuO写成Cu2O2、Cu4O4、(CuO) x ——基础薄弱,主干知识CuO的化学式不清晰;
③CuO写成 Cu(OH)2 ——审题不清(X仅含两种元素)、知识缺乏(Cu(OH)2受热分解未知)。
参考答案:CuO
评分标准:写成(CuO)n给1分,其他不给分
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(2) 固体甲与稀硫酸反应的离子方程式是________。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
参考答案:
评分标准:未配平扣1分,写成化学方程式不得分
【典型错误】①审题不清,离子方程式写成化学方程式;
②反应物Cu2O写成CuO或Fe3O4,并按此写相应的生成物;
③SO42-没有消除——CuSO4在水溶液中完全电离未知;
④写成CuO + 2H+ = Cu2+ + H2O
⑤写成Cu2O + 2H+ = 2Cu2+ + H2O
27.(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(3) 加热条件下氨气被固体X氧化成一种
气体单质,写出该反应的化学方程式____ __。
隔绝空气
高温
稀硫酸
稀NaOH溶液
加热
固体甲
(28.8 g)
溶液
固体乙(12.8 g)
沉淀
固体(16.0 g)
(蓝色)
(蓝色)
(黑色)
(紫红色)
气体
(能使带火星木条复燃)
X
(32.0 g)
第27题图
参考答案:
评分标准:产物既有Cu也有Cu2O,只要配平,均得2分,未配平扣1分
【典型错误】CuO的还原产物可以Cu或Cu2O,配平正确即可;
①没配平;
②反应物CuO写成Cu2O;
③产物出现NO、HNO3、CuN、CuNH2、Cu(NH2)2、Cu(OH)2、H2等——审题不清(NH3和CuO加热反应生成一种气体单质)
29.(4分)分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
(1) 将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]∶n(NH4Cl)为________。
第29题图
0
2.33
V/mL
m/g
100
(2) 另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl—)=________(溶液体积变化忽略不计)。
29题 参考答案 评分标准
(1) 1∶2 1∶2或1/2给2分,0.5或其他给1分
(2) 0.100 mol·Lˉ1 出现0.1,不管单位、有效数字给1分,“三全”给2分
30.【加试题】(10分)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1) 已知:2Al2O3(s)===4Al(g)+3O2(g)
ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g)
ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s)
ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是________,该反应自发进行的条件
________。
【典型错误】热化学方程式或物质状态未写,书写时为配平,焓变值与计算系数未对应,当然还有很大一部分因为粗心将CO写成CO2 甚至于将数字1026写成1062,直接计算成1025,1027等等,这些都是粗心造成的
参考答案:Al2O3(s)+3C(s)+N2(g)===2AlN(s)+3CO(g)
ΔH=1026 kJ·molˉ1
评分标准:配平错,0分;“kJ·molˉ”箭头、等号 不扣分
配平对, H数值错或单位错,或状态有问题,或AlN写成ALN,均1分
参考答案:高温
评分标准:写“高温”“较高温度”“ H>0, S>0,高温”均给分
【典型错误】回答称加热到一定程度,给予足够的热量等等,学生甚至给出了具体的问题如4760C 5000C 27000C
(2) 在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
①下列说法不正确的是________
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
【典型错误】漏选C选项
参考答案:CD
评分标准:漏选给1分,多选、错选不给分
(2) 在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)
【典型错误】运算能力差,表达式中缺少字母,指数错误
参考答案:
评分标准: 均给2分
不化简的计算式、表达式不给分
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
平台在t1之前,斜率正确(大于350℃)给1分;
平台在t1之前,数值介于[0.14,0.15]之间,斜率正确(大于350℃),且不可与350℃线条重合给2分;
30.(3) 据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
___________________________________。
【典型错误】:1)未审清题目:①电极反应式不是电解反应式 ② 碱性不少学生还添了H+
2 ) 书写不规范,不注重细节如OH-的负电荷标成了+
参考答案:CO2+6H2O+8eˉ===6CH4+8OHˉ
评分标准:CO2+6H2O+8eˉ===6CH4+8OHˉ
CO32-+7H2O+8eˉ===6CH4+10OHˉ
HCO-+6H2O+8eˉ===6CH4+9OHˉ
以上答案均给2分
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(1) 仪器A的作用是________;冰水浴冷却的目的是________(写两种)。
【典型错误】①错答成防止产物浓度过高分解,,H2O2挥发,H2O2失活,NaClO2水解;重复答题,防止ClO2蒸发和使ClO2液化。
②答题不指明物质,笼统讲物质分解。
③应该是增大ClO2的溶解度,错答成减小ClO2的溶解度
④不清楚固体、液体、气体溶解度与温度的关系
⑤凝固点、沸点不分,气化、液化、凝固、熔化、升华、凝华分不清。
【典型错误】
将平衡压强和防倒吸混淆在一起,答成平衡压强不得分
参考答案:降低NaClO2的溶解度;增加ClO2的溶解度;减少H2O2的分解;减少ClO2的分解
参考答案:防止倒吸
评分标准:安全瓶也对,写有多个答案时只看第一个
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(2) 空气流速过快或过慢,均降低NaClO2产率,试解释其原因________。
【典型错误】①将过快或过慢弄反②从反应速率去分析,没有从反应的程度去分析
③空气流速过慢ClO2不能及时被移走,浓度过高导致慢ClO2分解(错答率高一些)。
④错答成:过慢ClO2残留在三颈烧瓶中,使产率下降;过慢空气中的氧气氧化ClO2;过慢空气中的CO2与NaOH反应;错误的理解成空气中的氧气和CO2对反应的影响,对产率的影响,过慢H2O2会分解等等
参考答案:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;
空气流速过快时,ClO2不能被充分吸收。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
空气
A
冰水浴
H2O2
NaClO3(s)+H2SO4
NaOH+H2O2
尾气吸收
第31题图1
请回答:
(3) Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①________(用离子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。
参考答案:
【典型错误】没配平;NaClO2不拆,不知道NaClO2是溶于水的;写成归中反应,死记方程式;酸性条件下出OH-
分析:连续反应不会写,不会用减法,也不理解催化剂会参加反应。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。
水浴加热
温度计
出水
进水
H2O2
B
第31题图2
【典型错误】
H2O(g)、H2O2、O2、NaClO2、ClO2等等。
参考答案:减压
评分标准:只看第一个答案
参考答案:H2O
评分标准:蒸馏水,水都可,水蒸气不给分
【典型错误】防倒吸;平衡气压;吸收尾气(O2、ClO2)冷凝回流、分离提纯、避免空气中气体的干扰等等。总之,考生不清楚该装置的目的是降低水的沸点,以防止H2O2的分解。
31.【加试题】(10分)ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
(5) 抽滤法分离NaClO2过程中,下列操作不正确的是
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
参考答案:C
评分标准:多选、错选均不给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(1) A→B的反应类型是________。
【典型错误】总体得分率较高,常见的错误为反应类型为化合,加成,消去,还原,氧化,缩合或多写类型等
参考答案:取代反应
评分标准:1分,反应不写不扣分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(2) 下列说法不正确的是________。
A.化合物A的官能团是硝基
B.化合物B可发生消去反应
C.化合物E能发生加成反应
D.哌替啶的分子式是C15H21NO2
【典型错误】多选C或D较多
参考答案:A
评分标准:1分,写a也给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(3) 写出B+C→D的化学反应方程式________。
【典型错误】①反应物或产物写成分子式或结构简式,书写不当,
②方程式未配平,如产物NH3,NaOH,NH4Cl,HCl漏写或系数不符
参考答案:羧基
评分标准:反应条件不要求,完全正确3分三个大分子结构简式正确,遗漏小分子2分三个大分子可以键线式,可以混合结构简式
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(4) 设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选)________。
【典型错误】① 审题不清 以苯为反应起始物
② 结构简式或书写错误
③ 反应条件不当,如物质写成Br Cl NaCl 模糊化为“一定条件”等
参考答案:
评分标准:两步产物均正确,但均无条件给1分,第一步条件写光照或高温给分第二步条件写NaNH2与HCN也给分
32.【加试题】(10分)某研究小组按下列路线合成镇痛药哌替啶:
请回答:
(5) 写出同时符合下列条件的C的所有同分异构体的结构简式________。
①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
【典型错误】同分异构体书写主要是不全,重复或饱和度错误
参考答案:
评分标准:3分,多于3个看前3个,
对1个给1分
28.(4分)FeSO4受热分解的化学方程式为:
请回答:
(1) 将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
(2) 设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)________。
品红溶液褪色答成:品红溶液变色、品红溶液褪色又复原、品红溶液变红、品红溶液变蓝、BaCl2溶液变浑浊
过滤答成:加HCl溶解过滤、溶解过滤、蒸发浓缩冷却结晶、溶解、分离、倾析、定容、打捞、捞出来、弄出来、分离出来、收取、拿取、制取、取出、倒出、蒸发、取样
实验方案设计,我将学生错误答案归为8大类:
第一类,审题不清,方法错误
1.用物理方法:①磁铁法、②溶解性判断法:加水溶解,若有不溶性红色固体即为Fe2O3,
2.固体直接加判断法:取固体,滴加KSCN溶液,若溶液显血红色即为Fe2O3 。
第二类,审题不清,方向错误
①检验SO2,②检验SO3 ③检验Fe④检验FeO⑤检验 Fe3O4,⑥只检验Fe3+
第三类,知识错误型:把固体溶解于NaOH溶液中,再进行丁达尔实验,若有丁达尔效应,则说明产物中有Fe3+ ;
第四类,方案不严谨
①用硝酸溶解,滴加KSCN溶液,检验Fe3+ 的存在,,②先用盐酸溶解,再加酸性高锰酸钾溶液,检查Fe2+
第五类,叙述不完整
①缺少溶解;②缺少结论;③只说方法,没有现象和结论。
第六类,细节错误
①┅┅,滴加KSCN溶液,出现血红色沉淀,┅┅
②┅┅,滴加KSCN溶液,出现红褐色沉淀,┅┅
③┅┅,滴加KSCN溶液,出现砖红色沉淀,┅┅
④┅┅,滴加KSCN溶液,溶液变蓝,┅┅
第七类,画蛇添足型
┅┅,滴加酸性高锰酸钾溶液,若溶液不褪色,则无Fe2+,即无FeO。
第八类,调侃作恶型
①漫画
②调侃型:拿起来吃,口味还行,那就是硫酸亚铁了,对了,牙齿上可能会有点颜色:设计方案很麻烦,拿给化学老师看一看:阅卷辛苦了,给点分吧!
1.主观题得分情况
二、学生答题情况及阅卷体会
2.主观题中学生出现的错误及原因分析
3.阅卷体会
2.核心知识网络化
1. 双基和能力两手抓
三、教学及复习备考建议
3.解题方法技巧化
重要有机物之间的相互转化关系
CH=CH
CH2Br
CH2Br
CH2OH
CH2OH
CHO
CHO
COOH
COOH
[ OC—CO-OH2C-CH2O]n
CH2=CH2
O=C
O=C
CH2
CH2
O
O
2.核心知识网络化
烃
R—H
卤代烃
R—X
醇类
R—OH
醛类
R—CHO
羧酸
R—COOH
酯类
RCOOR`
卤代
消去
取代
水解
氧化
加氢
酯化
水解
氧化
2.核心知识网络化
3.解题方法技巧化
2016年10月24.已知还原性:SO32- >I―。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A.当a ≥ b时,发生的离子反应为SO32- + Cl2 + H2O = SO42- + 2H+ + 2Cl―
B.当5a = 4b时,发生的离子反应为
4SO32- + 2I―+ 5Cl2 + 4H2O = 4SO42- + I2 + 8H+ + 10Cl―
C.当a≤b≤ 时,反应中转移电子的物质的量n (e―)为a mol ≤ n(e―) ≤3a mol
D.当a < b <
时,溶液中SO42-、I―与Cl―的物质的量之比为a :(3a—2b) :2b
2015年10月25.已知氧化性Br2>Fe3+。向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应。下列说法不正确的是
A.离子的还原性强弱:Fe2+>Br->Cl-
B.当a≥2b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl-
C.当a=b时,反应后的离子浓度:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
D.当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
﹒
Cl2 /mol
1/2
3/2
①
②
③
第①阶段:Cl2与FeBr2物质的量小于等于1:2时,氯气的量不足,只氧化Fe2+,所以发生的离子反应为:2Fe2++Cl2═2Fe3++2Cl-
第②阶段:Cl2与FeBr2物质的量介于1:2与3:2之间时,Fe2+被完全氧化,Br-部分被氧化,离子方程式有多种可能,当a=b时,可以确定加入的氯气过量,氯气把Fe2+完全氧化成Fe3+,还有部分剩余,剩余的氯气可继续与Br-发生反应,刚好把一半Br-氧化,发生的离子反应是:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- ,
第③阶段:Cl2与FeBr2物质的量大于等于3:2之间时,氯气足量,Fe2+、Br-与足量Cl2反应,Br-、Fe2+都被完全氧化,发生的离子反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
下列各组混合物中,无论以何种比例混合,取1摩使之充分燃烧,耗氧量为定值的是
A 、CH4、C2H4O2
B 、C2H6O、C3H6
C、C3H4、C3H6O
D、 CH3CH2CH2OH、CH3COOH
谢谢!
同课章节目录
