【授课用】2014高考江西卷化学试题解析与点评
文档属性
| 名称 | 【授课用】2014高考江西卷化学试题解析与点评 |

|
|
| 格式 | zip | ||
| 文件大小 | 983.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-08-21 07:34:25 | ||
图片预览











文档简介
课件43张PPT。江西临川一中 翁永龙2014年高考全国新课标I理综卷
化学试题解析及点评一、整体分析: 2014年高考化学试卷给人整体印象是:考点新颖,贴近生活。试题基本遵循“稳中求变、立足基础、突出能力、锐意求新”的命题指导思想,全卷设计合理、梯度适中,覆盖面广。本套试题没有出现偏、难、怪的试题,体现了新课程理念。
与2013年相比较,计算量减少,试题难度整体有所降低,主要题型也极为相似,避免了大起大落。题目在条件给出及设问环节有所创新。试题源于教材,在命题形式上继续突出新课标标要求,回归基础。以考查高中基础知识为主线,在基础中考查能力。许多类型的题目学生平时都反复练过,基本功扎实的学生容易获得高分。部分题目初看都是考生熟悉的题干,但深入解题后又会发现与过去已做过的题目有所不同,容易掉进出题人的陷阱。整套试卷给学生有一种平和的感觉, 具有如下特点:
2、突出对综合运用能力的考查,注重知识迁移
化学有很多题型都可以通过图表呈现信息,如化学反应速率、化学平衡、电解原理、溶解度与溶解平衡等。考生必须对信息进行分析加工, 提取所需要的信息。例如第11、26、27题便是如此,第28题根据乙烯的平衡转化率与温度、压强的关系变化的曲线图象,考查平衡常数、压强大小的比较、提高转化率的措施。3、重视化学基本方法运用,淡化特殊技巧
该试卷回避了过难、过繁的题目,解题思路不依靠特殊技巧,只要掌握基本方法,就能找到解题思路,例如第11、27题这种命题形式使考生从死记繁多化学反应的备考方法中解脱出来,更有利于学生思维的发展。1、注重对化学基础知识、主干知识的考查,保持试题稳定性 ??? 试题考查了几乎高中化学所有核心内容和主干知识, 试题虽然在解答思路和思维层次上要求较高,但均源于课本, 即高起点低落点。体现了“源于教材,高于教材,理在书内,题在书外”的高考命题原则。7.下列化合物中同分异构体数目最少的是( )
A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯【答案】A
【解析】A.戊烷只有正、异、新三种同分异构体;B. 5个碳原子的碳架有3种,可知戊基有8种,故戊醇有8种;C.由3种碳架引入C=C,可知戊烯共有5种结构;D.乙酸乙酯有6种同分异构体(属于酯的4种:甲酸1—丙醇酯、甲酸2—丙醇酯、乙酸乙酯、丙酸甲酯;属于酸的两种:丁酸、2—甲基丙酸)。所以最少的是戊烷,故选A。
考查点:同分异构体的种类。
难易程度:容易 二、逐题分析8.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )【答案】C
【解析】A. 盐的水解是吸热反应,碳酸钠水解生成NaOH,加热可促进水解,油脂在NaOH 溶液中水解生成可溶性的高级脂肪酸钠和甘油,将油污洗去。而非碳酸钠直接与油污反应,A 错;B.漂白粉在空气中久置变质,是因为有效成分次氯酸钙与空气中的二氧化碳和水反应,生成不稳定的次氯酸,光照分解生成HCl和O2而失效,B错 ;C .由于铵根离子和碳酸根离子发生双水解反应,产生的氨气部分逸出,使氮元素流失而降低肥效,C 正确;D. FeCl3溶液用于铜质印刷线路板制作是因为:2FeCl3+Cu=2FeCl2+CuCl2,将多余的铜反应腐蚀掉,D 错。
考查点:盐类的水解及其应用,化学与STSE问题。
难易程度:容易9.已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,
H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢;H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)【答案】A
【解析】根据反应机理可知I- 是2H2O2=2H2O+O2 ↑的催化剂, 且化反应速率的快慢主要由慢反应决定, 所以I- 浓度越大,则整个反应速率越快,A正确;IO-为中间产物,不是催化剂,B错;98KJ·mol-1是该反应的△H,活化能不能确定,C 错误;由于水是纯液体,不能用来表示反应速率,且H2O2和O2的化学计量数不同,两者的反应速率也不同,D错。
考查点:以催化剂降低反应的活化能同时改变化学反应路径为
载体,考查影响化学反应速率的因素。
难易程度:中等难度。10.X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的
最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层
结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z【答案】D
【解析】由于Y+与Z-的电子层结构相同,所以两种元素位于相邻周期,且Y+位于IA, Z-位于VIIA,则Y是Na,Z是F ;X2-位于VIA, 则X是S。故原子最外层电子数F>S>Na,A错;单质沸点:金属Na最高,F2最低, B错; S2-有3 个电子层, Na+和 F-只有2 个电子层,所以S2-半径最大;当核外电子排布相同时,核电荷数越大,离子半径越小,则S2->F->Na+,C错;原子序数大小是:S>Na>F,D正确 。
考查点:元素的推断, 元素的位置、结构、性质之间的关系。
难易程度:中等难度。11.溴酸银(AgBrO3)溶解度随温度变化曲线
如图所示,下列说法错误的是( )
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
【答案】 A
【解析】 由溶解度随温度变化曲线可知:温度升高, 溶解度增大, 说明溶解平衡右移,故AgBrO3的溶解是吸热过程, A 错;温度升高,AgBrO3溶解在水中的微粒运动速率加快,使其溶解速率加快,B正确; 60 ℃ 时,溴酸银溶解度约为0.6g,则c(AgBrO3) ≈ 0.6g ÷ 236g/mol ÷0.1L ≈ 0.0025
mol/L ,Ksp=c(Ag+)×C(BrO3-)≈0.025×0.025≈6×10-4, C 正确;由于硝酸钾的溶解度随温度变化影响很大,而溴酸银溶解度随温度变化不大,故硝酸钾中含有少量溴酸银,可用重结晶的方法提纯, D正确。
考查点:通过溴酸银的溶解度曲线图,考查溶解平衡、Ksp计算、物质
的分离和提纯等。
难易程度:较难。12.下列有关仪器的使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出
多余液体。【答案】B
【解析】容量瓶为精密的计量仪器,不能放入烘箱中烘干,否则计量
不准,A 错;滴定管在水洗后装液前都要润洗,否则由于内壁粘有水,相当于把溶液稀释了,从而引起实验误差,B 正确;酸碱中和滴
定中,锥形瓶不能用待测液润洗,否则会使得待测液的物质的量增多,造成测定结果偏高,C 错;用容量瓶配制溶液时,若加水超过刻
度线, 会导致所配溶液浓度偏小, 即使用滴管吸出多余液体, 浓度仍然
偏小,需重新配制,D 错。
考查点:常见仪器的正确使用和实验操作。
难易程度:容易。13.利用右图所示装置进行下列实验,能得出相应实验结论的是( )【答案】B
【解析】由于稀硫酸与Na2S反应生成的H2S气体进入③中,与硝酸银反应生成Ag2S沉淀,不能证明AgCl与Ag2S溶解度的相对大小,A 错;浓硫酸使蔗糖脱水炭化,体现了浓硫酸的脱水性,产生的碳再被浓硫酸氧化,生成CO2和SO2气体,体现了浓硫酸的氧化性,产生的SO2进入③中使溴水褪色,生成H2SO4和HBr。通过蔗糖变黑、溴水褪色可以得出浓硫酸具有脱水性、氧化性, B 正确;稀盐酸与Na2SO3反应生成SO2, SO2的水溶液呈酸性,在酸性条件下SO2被NO3-氧化SO42-,从而生成BaSO4沉淀,若③中无氧化性物质,则无沉淀生成,如SO2与BaCl2溶液就不会反应,无白色沉淀生成,C 错;由于浓硝酸具有挥发性,使产生的CO2中含有硝酸,进入③中与Na2SiO3反应,影响碳酸与硅酸酸性的比较,D错。
考查点:以实验的形式,考查元素、化合物的重要性质及相互转化的关系。
难易程度:较难。
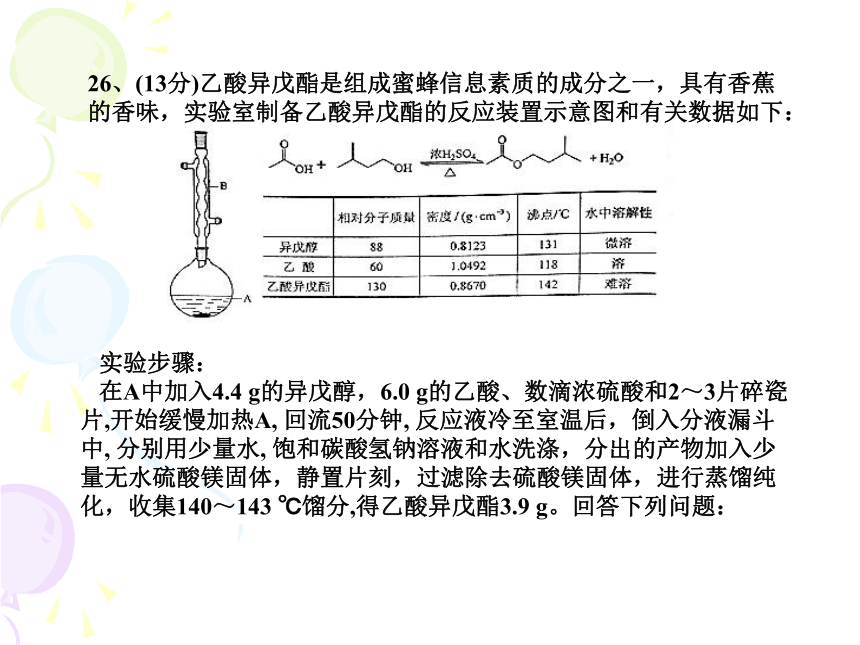
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A, 回流50分钟, 反应液冷至室温后,倒入分液漏斗中, 分别用少量水, 饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:26、(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:(1)装置B的名称是 ;
(2)在洗涤操作中,第一次水洗的主要目的是 ;
第二次 水洗的主要目的是: 。【解析】
(1)由装置示意图可知仪器B是球形冷凝管。
(2)反应后产物中除了生成的乙酸异戊酯以外, 还含有硫酸以及挥发出来的乙酸、异戊醇。第一次水洗的主要目的是除去可溶于水的杂质,即大部分的醋酸和硫酸,再用饱和碳酸氢钠溶液洗涤,可除去余下的醋酸和硫酸,使之转化为醋酸钠和硫酸钠,同时减小乙酸异戊酯的溶解,再次水洗的主要目的是除去过量的碳酸氢钠和少许的醋酸钠、硫酸钠。(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层
后 (填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是 ;
(5)实验中加入少量无水硫酸镁的目的是 ; 【解析】
(3)乙酸异戊酯密度比水小,且不溶于水,酯在上层,水在下层,
分离时应先将下层的水层从分液漏斗下口放出,再将上层的
乙酸异戊酯从上口倒出,所以选d ;
(4)该反应为可逆反应,增大反应物乙酸的量可使平衡正向移动,
从而提高乙醇的转化率;
(5) 加入少量的无水硫酸镁的目的是吸收酯表面的少量水分,进
行干燥;(6)在蒸馏操作中,仪器选择及安装都正确的是 (填标号)【解析】
(6)在蒸馏操作中,温度计的水银球应放在蒸馏烧瓶支管口附近的位
置,排除a、d,而c 中使用的是球形冷凝管,容易使冷凝的液体
产品滞留在冷凝管, 不能全部收集到锥形瓶中,因此 b正确。(7)本实验的产率是 ;
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或低)原因是 。 【解析】
(7)n(乙酸)=6.0g÷60g/moL=0.1 moL, n(异戊醇)=4.4g÷88g/moL
=0.05 moL,由于二者按1:1 进行反应, 所以乙酸过量, 应按异戊醇计算。m ( 乙酸异戊酯)=0.05 moL x130g/moL=6.5g,所以产率为3.9g/6.5g×100%=60%,D 正确;
(8)根据题目提供的数据,若从130℃开始收集馏分,此时的蒸气中会含有少量的未反应的异戊醇,导致产率偏高。
考查点:考查仪器的识别与安装、物质的制取、混合物的分离、
产率的计算等知识。
难易程度:中等难度。【答案】
(1)球形冷凝管
(2)洗掉大部分浓硫酸和醋酸;洗掉碳酸氢钠。
(3)d。
(4)提高异戊醇的转化率
(5)干燥
(6)b
(7)c
(8)高,会收集到少量未反应的异戊醇。27、(15分)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,
回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银,从而可用
于化学镀银。
①H3PO2中,磷元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量
之比为4︰1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填正盐或酸式盐),其溶液显 性
(填弱酸性、中性或者弱碱性) 【解析】
(1)由于 H3PO2是一元中强酸,不是强酸,所以是可逆电离且只发生一步电离:H3PO2 H++H2PO2- (2) ①根据化合物中各元素化合价代数和为0,H是+1价,O是-2价,可得出P为+1价。② Ag+是氧化剂, H3PO2是还原剂, 二者按4︰1反应, 4Ag+ 4Ag共降低4价,则H3PO2升高4价,P元素变为+5价,故生成H3PO4。 ③由于H3PO2是一元酸, 则NaH2PO2是正盐, 属强碱弱酸盐, 水解显碱性。(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3
气体和Ba(H2PO2),后者再与H2SO4反应,写出白磷与Ba(OH)2
溶液反应的化学方程式 。【解析】
(3)该反应的反应物与产物都给出,P4发生歧化反应,由得失
电子相等进行配平可得:
2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2(4)H3PO2也可用电渗析法制备。四室电渗析法工作原理如图
所示(阳膜和阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 。
②分析产品室可得到H3PO2的原因 。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室
的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜 ,
从而合并了阳极室与产品室,其缺点是产品中混有 杂质,
该杂质 产生的原因是 。【解析】
(4)①阳极发生氧化反应,H2O中OH-失电子可知:2H2O-4e-=4H++O2↑或 4OH--4e-=2H2O+O2↑。②由于阳极室OH-放电,使H+浓度增大,H+通过阳膜进入产品室,而原料室中的H2PO2-通过阴膜进入产品室,两者反应生成H3PO2。③由于H3PO2具有还原性,电解时H3PO2在阳极放电被氧化生成H3PO4杂质。
考查点:弱电解质的电离、元素的化合价、化学方程式的书写、
物质的制取、电解原理的应用等知识。
难易程度:较难。 【答案】
(1)H3PO2 H++H2PO2-
(2)①+1 ②H3PO4 ③正盐 碱性
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-=4H++O2↑(或4OH--4e-=2H2O+O2 ↑)
②阳极室 H+通过阳膜扩散进入产品室,原料室中的H2PO2-通过
阴膜进入产品室,二者反应生成H3PO2。
③H3PO4或PO43- H3PO2 或H2PO2-具有还原性,电解时被
氧化生成H3PO428、(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法
或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯
(C2H5OSO3H)。再水解生成乙醇。 写出相应的反应的化学
方程式 。 【解析】
(1)乙烯与硫酸发生加成反应生成硫酸氢乙酯,硫酸氢乙酯再
通过水解进行取代反应得到乙醇。化学方程式为:
CH2=CH2+H2SO4== C2H5OSO3H
C2H5OSO3H+H2O == CH3CH2OH+H2SO4 (2)已知:甲醇脱水反应
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9KJ·mol-1
甲醇制烯烃反应
②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1 KJ·mol-1
乙醇异构化反应
③ CH3CH2OH(g) = CH3OCH3(g)? △H3= + 50.7 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的
? △H= KJ·mol-1。与间接水合法相比,气相直接
水合法的优点是 。【解析】
(2)由盖斯定律, ①- ②- ③,整理可得C2H4 (g)+H2O(g)=
C2H5OH(g) △H= △H1—△H2-△H3=— 45.5KJ·mol-1;比较
两种流程, 可看出气相直接水合法反应步骤少, 产率高,同时减少
污染物的排放;不用硫酸作反应物,减少对设备的腐蚀。①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是
:
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,
反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯
的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当
改变反应温度和压强外,还可以采取的措施有 、 。(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强
的关系(其中n(H2O)︰n(C2H4)=1︰1)【解析】
(3) ①A点乙烯的平衡转化率是20%。令反应前乙烯和水均为
n mol,根据反应:C2H4+H2O = C2H5OH,由差量法可表达
出乙醇的分压 ,同理可表达出乙烯和水
的分压 ,从而得出 Mpa-1
②通过反应C2H4 (g)+H2O(g)=C2H5OH(g),可以看出压强越大,
乙烯的转化率越高,从300℃ 时乙烯的转化率大小可得出:
P1﹤P2﹤P3﹤P4 。
③ 增大另一种反应物H2O蒸气的浓度,或减小生成物乙醇的
浓度,即及时分离出生成的乙醇,均可使平衡右移动,从而
提高乙烯的转化率。
考查点:物质制取方案的设计与比较、(热)化学方程式的书写、
影响化学平衡移动的因素、化学平衡常数的计算。
难易程度:中等难度。【答案】
(1)CH2=CH2+H2SO4 == C2H5OSO3H;
C2H5OSO3H+H2O == CH3CH2OH+H2SO4
(2)-45.5 减少污染,减少对设备的腐蚀。
(3) ①0.07 Mpa-1
② P1﹤P2﹤P3﹤P4;反应分子数减少,相同温度下,压强
升高乙烯转化率升高。
③增大n(H2O)︰n(C2H4)的比值,及时把生成的乙醇液化分离。36、〔化学—选修2:化学与技术〕(15分)
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔 Ca5F(PO4)3 、
Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致
情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。 图(b)是
热法磷酸生产过 程中由磷灰石制单质磷的流程。部分物质的相关性质如下:回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石
使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程
式为: 。现有1t 折合含有P2O5约30% 的磷灰石,
最多可制得85℅的商品磷酸 吨。【解析】(1)根据图示可知,含磷的肥料有两种:磷矿粉肥和
磷肥,共占:4% + 96%×85%×80%=69%
(2)湿法生产磷酸属于复分解反应,符合强酸制弱酸。根据原子
守恒可得:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF
根据P原子守恒:P2O5→2 H3PO4
142 196
0.3t 85%x
则:85%x×142=196×0.3t,x=0.49t(3)如图(b)所示,热法磷酸生产的第一步是将SiO2、过量焦炭与磷
灰石混合,高温反应生成白磷。炉渣的主要成分是 (填化学式),
冷凝塔1的主要沉积物是 ,冷凝塔2的主要沉积物是 。
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾
气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除
去 (均填化学式) 【解析】
(3) SiO2、过量焦炭与磷灰石混合,高温反应除生成白磷外,
还生成炉渣硅酸钙(CaSiO3);根据有关物质的熔沸点可知:
冷凝塔1的温度为 70℃,此时白磷蒸汽冷凝为液体;冷凝塔2
的温度为18℃,此时白磷液体固化变为固体。
(4)因为使用了过量的焦炭,所以尾气中含有大量的CO ,还
含有 SiF4 ;通过呈碱性的纯碱溶液时,酸性的H2S、HF以及
易水解的SiF4被吸收;再通过氧化性的次氯酸钠溶液,还原
性的PH3被吸收。【解析】
(5)虽然热法磷酸工艺复杂,能耗高,但用白磷可制得高纯度
的磷酸,杂质少。
考查点:磷矿石的主要用途、反应原理及有关计算。
难易程度:中等难度。(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 。【答案】
(1)69
(2)Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑ 0.49t
(3)CaSiO3,,液体白磷;固体白磷。
(4)CO、SiF4 H2S、HF、SiF4 PH3
(5)产品纯度高(或产品浓度大)37、〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素
组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,
可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,Fe3+的电子排布式为 。
可用硫氰化钾检验Fe3+ ,形成的配合物颜色为 。 【解析】
(1)从外观无法区分三者,但用X光照射时会发现,晶体会对
X射线发生衍射,而非晶体不会,准晶体介于两者之间。因
此通过有无衍射现象即可区分。
(2)基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,可知有
4个未成对电子,当失去2个4s、1个3d电子,形成Fe3+,其电
子排布为1s22s22p63s23p63d5; Fe3+与SCN-形成的多种配位化
合物都是血红色,可用于检验Fe3+。(3)新制备的氢氧化铜可将乙醛氧化为乙酸, 而自身还原成Cu2O, 乙醛
中碳原子的杂化轨道类型为 , 1 mol乙醛分子中含有的σ键
的数目为 。乙酸的沸点明显高于乙醛,其主要原因 。
氧化亚铜为半导体材料, 在其立方晶胞内部有四个氧原子, 其余氧原子
位于面心和顶点,则该晶胞中有 个铜原子。【解析】
(3)乙醛分子中甲基碳原子的空间是四面体构型,采取sp3杂化;
醛基是平面结构,碳原子采取sp2杂化;CH3CHO分子中的碳碳
键、4个碳氢键都是σ键,碳氧双键中有一个σ键,所以1mol乙
醛分子中共有6molσ键,也就是6NA;由于乙酸分子羟基极性更
强,分子间形成了氢键,使分子间作用力增强,造成沸点升高;
在Cu2O的一个晶胞中, 含氧原子数为:4+8×1/8+6×1/2=8,由
于Cu:O=2:1,故有16个Cu原子。(4) Al单质为面心立方晶体,其晶胞参数a=0 . 405nm,晶胞中铝
原子的配位数为 。列式表示Al单质的密度 g · cm-3
(不必计算出结果)【解析】
(4)在Al晶体的一个晶胞中与它距离相等且最近的原子在通过这
个顶点的三个面心上,而通过一个顶点可以形成8个晶胞,由于
每个面重复2次,所以原子的配位数为(3×8)/2=12。在一个晶
胞中含有Al原子个数为8×1/8+6×1/2=4,所以Al单质的密度为:
考查点:晶体、非晶体、准晶体的区分方法、原子结构、离子的
检验、金属晶体的密度计算。
难易程度:中等难度。g/cm3。【答案】
(1)X射线衍射法,
(2)4 1s22s22p63s23p63d5 血红色。
(3)sp3、sp2 6NA 乙酸分子间存在氢键,造成沸点升高 16
(4)12; 38、〔化学—选修5:有机化学基础〕(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。
合成G的一种路线如下:已知以下信息: ①②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤ 回答下列问题:
(1)由A生成B的化学方程式为 ,反应类型为 。
(2)D的化学名称是 ,由D生成E的化学方程式为 。
(3)G的结构简式为 。 【解析】
(1) A是氯代烷烃,发生消去反应得到烯烃B,结合信息① ②可知B是 一种对称烯烃,生成的C是丙酮 ,说明双键碳原子上没有H原子,则B的结构简式为:C(CH3)2=C(CH3)2 (2,3-二甲基-2-丁烯),A的结构简式为:CH(CH3)2-C(CH3)2Cl (2,3-二甲基-2-氯丁烷); A生成B是氯代烃的消去反应:
(2) F分子式为C8H11N,结合信息③,D为单取代芳香烃,相对分子质量为106, 则D是乙苯;F的苯环上只有两种环境的H原子, 则乙基、氨基位于对位上,故F为对氨基乙苯,E为对硝基乙苯;由 D生成E的化学方程式为:
(3)根据信息⑤ ,F与丙酮C发生的 反应生成G,可知G的结构简式:
(4)F的同分异构体中含有苯环的还有 种(不考虑立体异
构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1
的是 。(写出其中的一种的结构简式)。 【解析】
(4)F的同分异构体书写要注意思维的有序性:苯环上有3个取代基(-CH3、-CH3、-NH2)有6种;苯环2个取代基,可能为-CH2CH3、
-NH2,除F外还有2种;可能为-NH-CH3、-CH3,有3种;可能为-CH3、 -CH2-NH2,有3种;苯环上只有1个取代基有5种(-CH2CH2NH2、
-CH2NHCH3、-NHCH2CH3、-N(CH3)2、-CH(NH2)CH3 )。所以共有:6+2+3+3 +5 =19种;根据有4种氢原子,且原子个数比为6︰2︰2︰1,说明有两个-CH3,且对称。则结构简式有:
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
反应条件1所选择的试剂为 ,反应条件2所选择
的试剂为 ,I的结构简式为 。 【解析】
(5)结合题中的信息⑤,采用逆推法:J用H2加成得到产品,J为
,则I为 -NH2,H为 -NO2,反应条件1是苯环上引入硝基,试剂为:浓硝酸、浓硫酸;反应条件2把硝基还原为氨基,试剂为:Fe、稀盐酸。
考查点:有机合成与推断、物质的结构简式、化学方程式、同分异构
体的书写、反应条件的选择。
难易程度:中等难度。
(5)浓硝酸、浓硫酸; Fe/稀盐酸;三、2015年高考化学备考建议 : 通过今年的理综化学试题不难看出,2014年新课标化学试题保持相对稳定的特点, 充分体现了高考的相对稳定性。在2015年的高考中,化学试题依旧会延续“回归教材,贴近生活”的命题宗旨。?一、抓纲扣本,夯实基础? ? 要认真学习和体会《考试大纲》和《考试说明》,不要随意扩大复习范围和难度。通过针对性的知识梳理,使各个知识点系统化,以便查缺补漏。 ?二、关注主干知识,把握重点内容?
尽管历年高考试题考查的不是所有知识点,但重点知识是常考不衰的,而且题型比较稳定。透析近几年的试题不难发现以下内容:
(1)与阿伏伽德罗常数、物质的量有关的比较和计算;(2)氧化还原反应;(3)离子共存、离子方程式;(4)原子结构、元素周期表、周期率;(5)元素及其化合物的重要性质;(6)化学反应速率、化学平衡;(7)盐类水解、离子浓度的大小关系;(8)溶液的PH及计算;(9)物质或离子的检验、鉴别、物质的除杂、净化、分离等;(10)原电池、电解池;(11)有机物的分子式、结构简式、同分异构体、同系物、有机反应类型、官能团的性质及衍变关系;(12)实验基本操作、仪器、装置、评价与设计;(13)混合物的计算;(14) 化学史、环境保护、能源材料等 ;(15) 新信息、新情景材料等。?四、强化化学实验的复习,提升实验能力?
?? 实验是理综试题的重头戏,也是高考化学试题中的一个“拦路虎”,历年来学生的实验得分率总是偏低。原因主要是学生的动手少,分析问题的思维能力差。因此在后期复习中,要做好以下几点:一要对课本中出现过的演示实验、分组实验进行全面的分类复习(如分定量实验、定性实验);二要掌握各种装置的用途;三要注意实验设计和评价能力的培养;四要尽可能到实验室重做一些重要的基本操作和具有代表性的实验;五要做一些典型的实验试题。? 三、进行针对性的训练,提高解题能力??
复习时,一定要重视专题训练和仿真训练,要有意识地强化选择题、无机、有机推断(框图题)、实验题、计算题、信息迁移题等题型的训练;同时要注重经典题、历届的高考题的使用。?六、其它建议?
??? 1、注意收集 “错题”。
2、注意运用化学语言正确表述。如常见的错误表述:
(1)化学用语书写不规范。离子方程式、化学方程式书写不配
平、漏写条件、“↑”、“↓”;错用 、=、→等。
(2)简答文字叙述不达题意,不严密、不完整, 拖泥带水等。??
???3、重视应用化学知识观察、分析生活、生产和社会中的各类
有关的化学问题。?五、强化审题能力培养,保持良好应试心态?
??? 在后期做题及模拟考试时,一定要注意训练审题能力,挖掘
隐含信息和排除干扰条件。每次训练时,都要当作高考来对待,
做到心态平和,耐心细致,挖掘潜力,先易后难,准确作答。谢谢大家
化学试题解析及点评一、整体分析: 2014年高考化学试卷给人整体印象是:考点新颖,贴近生活。试题基本遵循“稳中求变、立足基础、突出能力、锐意求新”的命题指导思想,全卷设计合理、梯度适中,覆盖面广。本套试题没有出现偏、难、怪的试题,体现了新课程理念。
与2013年相比较,计算量减少,试题难度整体有所降低,主要题型也极为相似,避免了大起大落。题目在条件给出及设问环节有所创新。试题源于教材,在命题形式上继续突出新课标标要求,回归基础。以考查高中基础知识为主线,在基础中考查能力。许多类型的题目学生平时都反复练过,基本功扎实的学生容易获得高分。部分题目初看都是考生熟悉的题干,但深入解题后又会发现与过去已做过的题目有所不同,容易掉进出题人的陷阱。整套试卷给学生有一种平和的感觉, 具有如下特点:
2、突出对综合运用能力的考查,注重知识迁移
化学有很多题型都可以通过图表呈现信息,如化学反应速率、化学平衡、电解原理、溶解度与溶解平衡等。考生必须对信息进行分析加工, 提取所需要的信息。例如第11、26、27题便是如此,第28题根据乙烯的平衡转化率与温度、压强的关系变化的曲线图象,考查平衡常数、压强大小的比较、提高转化率的措施。3、重视化学基本方法运用,淡化特殊技巧
该试卷回避了过难、过繁的题目,解题思路不依靠特殊技巧,只要掌握基本方法,就能找到解题思路,例如第11、27题这种命题形式使考生从死记繁多化学反应的备考方法中解脱出来,更有利于学生思维的发展。1、注重对化学基础知识、主干知识的考查,保持试题稳定性 ??? 试题考查了几乎高中化学所有核心内容和主干知识, 试题虽然在解答思路和思维层次上要求较高,但均源于课本, 即高起点低落点。体现了“源于教材,高于教材,理在书内,题在书外”的高考命题原则。7.下列化合物中同分异构体数目最少的是( )
A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯【答案】A
【解析】A.戊烷只有正、异、新三种同分异构体;B. 5个碳原子的碳架有3种,可知戊基有8种,故戊醇有8种;C.由3种碳架引入C=C,可知戊烯共有5种结构;D.乙酸乙酯有6种同分异构体(属于酯的4种:甲酸1—丙醇酯、甲酸2—丙醇酯、乙酸乙酯、丙酸甲酯;属于酸的两种:丁酸、2—甲基丙酸)。所以最少的是戊烷,故选A。
考查点:同分异构体的种类。
难易程度:容易 二、逐题分析8.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )【答案】C
【解析】A. 盐的水解是吸热反应,碳酸钠水解生成NaOH,加热可促进水解,油脂在NaOH 溶液中水解生成可溶性的高级脂肪酸钠和甘油,将油污洗去。而非碳酸钠直接与油污反应,A 错;B.漂白粉在空气中久置变质,是因为有效成分次氯酸钙与空气中的二氧化碳和水反应,生成不稳定的次氯酸,光照分解生成HCl和O2而失效,B错 ;C .由于铵根离子和碳酸根离子发生双水解反应,产生的氨气部分逸出,使氮元素流失而降低肥效,C 正确;D. FeCl3溶液用于铜质印刷线路板制作是因为:2FeCl3+Cu=2FeCl2+CuCl2,将多余的铜反应腐蚀掉,D 错。
考查点:盐类的水解及其应用,化学与STSE问题。
难易程度:容易9.已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,
H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢;H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)【答案】A
【解析】根据反应机理可知I- 是2H2O2=2H2O+O2 ↑的催化剂, 且化反应速率的快慢主要由慢反应决定, 所以I- 浓度越大,则整个反应速率越快,A正确;IO-为中间产物,不是催化剂,B错;98KJ·mol-1是该反应的△H,活化能不能确定,C 错误;由于水是纯液体,不能用来表示反应速率,且H2O2和O2的化学计量数不同,两者的反应速率也不同,D错。
考查点:以催化剂降低反应的活化能同时改变化学反应路径为
载体,考查影响化学反应速率的因素。
难易程度:中等难度。10.X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的
最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层
结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z【答案】D
【解析】由于Y+与Z-的电子层结构相同,所以两种元素位于相邻周期,且Y+位于IA, Z-位于VIIA,则Y是Na,Z是F ;X2-位于VIA, 则X是S。故原子最外层电子数F>S>Na,A错;单质沸点:金属Na最高,F2最低, B错; S2-有3 个电子层, Na+和 F-只有2 个电子层,所以S2-半径最大;当核外电子排布相同时,核电荷数越大,离子半径越小,则S2->F->Na+,C错;原子序数大小是:S>Na>F,D正确 。
考查点:元素的推断, 元素的位置、结构、性质之间的关系。
难易程度:中等难度。11.溴酸银(AgBrO3)溶解度随温度变化曲线
如图所示,下列说法错误的是( )
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
【答案】 A
【解析】 由溶解度随温度变化曲线可知:温度升高, 溶解度增大, 说明溶解平衡右移,故AgBrO3的溶解是吸热过程, A 错;温度升高,AgBrO3溶解在水中的微粒运动速率加快,使其溶解速率加快,B正确; 60 ℃ 时,溴酸银溶解度约为0.6g,则c(AgBrO3) ≈ 0.6g ÷ 236g/mol ÷0.1L ≈ 0.0025
mol/L ,Ksp=c(Ag+)×C(BrO3-)≈0.025×0.025≈6×10-4, C 正确;由于硝酸钾的溶解度随温度变化影响很大,而溴酸银溶解度随温度变化不大,故硝酸钾中含有少量溴酸银,可用重结晶的方法提纯, D正确。
考查点:通过溴酸银的溶解度曲线图,考查溶解平衡、Ksp计算、物质
的分离和提纯等。
难易程度:较难。12.下列有关仪器的使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出
多余液体。【答案】B
【解析】容量瓶为精密的计量仪器,不能放入烘箱中烘干,否则计量
不准,A 错;滴定管在水洗后装液前都要润洗,否则由于内壁粘有水,相当于把溶液稀释了,从而引起实验误差,B 正确;酸碱中和滴
定中,锥形瓶不能用待测液润洗,否则会使得待测液的物质的量增多,造成测定结果偏高,C 错;用容量瓶配制溶液时,若加水超过刻
度线, 会导致所配溶液浓度偏小, 即使用滴管吸出多余液体, 浓度仍然
偏小,需重新配制,D 错。
考查点:常见仪器的正确使用和实验操作。
难易程度:容易。13.利用右图所示装置进行下列实验,能得出相应实验结论的是( )【答案】B
【解析】由于稀硫酸与Na2S反应生成的H2S气体进入③中,与硝酸银反应生成Ag2S沉淀,不能证明AgCl与Ag2S溶解度的相对大小,A 错;浓硫酸使蔗糖脱水炭化,体现了浓硫酸的脱水性,产生的碳再被浓硫酸氧化,生成CO2和SO2气体,体现了浓硫酸的氧化性,产生的SO2进入③中使溴水褪色,生成H2SO4和HBr。通过蔗糖变黑、溴水褪色可以得出浓硫酸具有脱水性、氧化性, B 正确;稀盐酸与Na2SO3反应生成SO2, SO2的水溶液呈酸性,在酸性条件下SO2被NO3-氧化SO42-,从而生成BaSO4沉淀,若③中无氧化性物质,则无沉淀生成,如SO2与BaCl2溶液就不会反应,无白色沉淀生成,C 错;由于浓硝酸具有挥发性,使产生的CO2中含有硝酸,进入③中与Na2SiO3反应,影响碳酸与硅酸酸性的比较,D错。
考查点:以实验的形式,考查元素、化合物的重要性质及相互转化的关系。
难易程度:较难。
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A, 回流50分钟, 反应液冷至室温后,倒入分液漏斗中, 分别用少量水, 饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:26、(13分)乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:(1)装置B的名称是 ;
(2)在洗涤操作中,第一次水洗的主要目的是 ;
第二次 水洗的主要目的是: 。【解析】
(1)由装置示意图可知仪器B是球形冷凝管。
(2)反应后产物中除了生成的乙酸异戊酯以外, 还含有硫酸以及挥发出来的乙酸、异戊醇。第一次水洗的主要目的是除去可溶于水的杂质,即大部分的醋酸和硫酸,再用饱和碳酸氢钠溶液洗涤,可除去余下的醋酸和硫酸,使之转化为醋酸钠和硫酸钠,同时减小乙酸异戊酯的溶解,再次水洗的主要目的是除去过量的碳酸氢钠和少许的醋酸钠、硫酸钠。(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层
后 (填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是 ;
(5)实验中加入少量无水硫酸镁的目的是 ; 【解析】
(3)乙酸异戊酯密度比水小,且不溶于水,酯在上层,水在下层,
分离时应先将下层的水层从分液漏斗下口放出,再将上层的
乙酸异戊酯从上口倒出,所以选d ;
(4)该反应为可逆反应,增大反应物乙酸的量可使平衡正向移动,
从而提高乙醇的转化率;
(5) 加入少量的无水硫酸镁的目的是吸收酯表面的少量水分,进
行干燥;(6)在蒸馏操作中,仪器选择及安装都正确的是 (填标号)【解析】
(6)在蒸馏操作中,温度计的水银球应放在蒸馏烧瓶支管口附近的位
置,排除a、d,而c 中使用的是球形冷凝管,容易使冷凝的液体
产品滞留在冷凝管, 不能全部收集到锥形瓶中,因此 b正确。(7)本实验的产率是 ;
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或低)原因是 。 【解析】
(7)n(乙酸)=6.0g÷60g/moL=0.1 moL, n(异戊醇)=4.4g÷88g/moL
=0.05 moL,由于二者按1:1 进行反应, 所以乙酸过量, 应按异戊醇计算。m ( 乙酸异戊酯)=0.05 moL x130g/moL=6.5g,所以产率为3.9g/6.5g×100%=60%,D 正确;
(8)根据题目提供的数据,若从130℃开始收集馏分,此时的蒸气中会含有少量的未反应的异戊醇,导致产率偏高。
考查点:考查仪器的识别与安装、物质的制取、混合物的分离、
产率的计算等知识。
难易程度:中等难度。【答案】
(1)球形冷凝管
(2)洗掉大部分浓硫酸和醋酸;洗掉碳酸氢钠。
(3)d。
(4)提高异戊醇的转化率
(5)干燥
(6)b
(7)c
(8)高,会收集到少量未反应的异戊醇。27、(15分)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,
回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银,从而可用
于化学镀银。
①H3PO2中,磷元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量
之比为4︰1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填正盐或酸式盐),其溶液显 性
(填弱酸性、中性或者弱碱性) 【解析】
(1)由于 H3PO2是一元中强酸,不是强酸,所以是可逆电离且只发生一步电离:H3PO2 H++H2PO2- (2) ①根据化合物中各元素化合价代数和为0,H是+1价,O是-2价,可得出P为+1价。② Ag+是氧化剂, H3PO2是还原剂, 二者按4︰1反应, 4Ag+ 4Ag共降低4价,则H3PO2升高4价,P元素变为+5价,故生成H3PO4。 ③由于H3PO2是一元酸, 则NaH2PO2是正盐, 属强碱弱酸盐, 水解显碱性。(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3
气体和Ba(H2PO2),后者再与H2SO4反应,写出白磷与Ba(OH)2
溶液反应的化学方程式 。【解析】
(3)该反应的反应物与产物都给出,P4发生歧化反应,由得失
电子相等进行配平可得:
2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2(4)H3PO2也可用电渗析法制备。四室电渗析法工作原理如图
所示(阳膜和阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 。
②分析产品室可得到H3PO2的原因 。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室
的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜 ,
从而合并了阳极室与产品室,其缺点是产品中混有 杂质,
该杂质 产生的原因是 。【解析】
(4)①阳极发生氧化反应,H2O中OH-失电子可知:2H2O-4e-=4H++O2↑或 4OH--4e-=2H2O+O2↑。②由于阳极室OH-放电,使H+浓度增大,H+通过阳膜进入产品室,而原料室中的H2PO2-通过阴膜进入产品室,两者反应生成H3PO2。③由于H3PO2具有还原性,电解时H3PO2在阳极放电被氧化生成H3PO4杂质。
考查点:弱电解质的电离、元素的化合价、化学方程式的书写、
物质的制取、电解原理的应用等知识。
难易程度:较难。 【答案】
(1)H3PO2 H++H2PO2-
(2)①+1 ②H3PO4 ③正盐 碱性
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-=4H++O2↑(或4OH--4e-=2H2O+O2 ↑)
②阳极室 H+通过阳膜扩散进入产品室,原料室中的H2PO2-通过
阴膜进入产品室,二者反应生成H3PO2。
③H3PO4或PO43- H3PO2 或H2PO2-具有还原性,电解时被
氧化生成H3PO428、(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法
或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯
(C2H5OSO3H)。再水解生成乙醇。 写出相应的反应的化学
方程式 。 【解析】
(1)乙烯与硫酸发生加成反应生成硫酸氢乙酯,硫酸氢乙酯再
通过水解进行取代反应得到乙醇。化学方程式为:
CH2=CH2+H2SO4== C2H5OSO3H
C2H5OSO3H+H2O == CH3CH2OH+H2SO4 (2)已知:甲醇脱水反应
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9KJ·mol-1
甲醇制烯烃反应
②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1 KJ·mol-1
乙醇异构化反应
③ CH3CH2OH(g) = CH3OCH3(g)? △H3= + 50.7 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的
? △H= KJ·mol-1。与间接水合法相比,气相直接
水合法的优点是 。【解析】
(2)由盖斯定律, ①- ②- ③,整理可得C2H4 (g)+H2O(g)=
C2H5OH(g) △H= △H1—△H2-△H3=— 45.5KJ·mol-1;比较
两种流程, 可看出气相直接水合法反应步骤少, 产率高,同时减少
污染物的排放;不用硫酸作反应物,减少对设备的腐蚀。①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是
:
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,
反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯
的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当
改变反应温度和压强外,还可以采取的措施有 、 。(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强
的关系(其中n(H2O)︰n(C2H4)=1︰1)【解析】
(3) ①A点乙烯的平衡转化率是20%。令反应前乙烯和水均为
n mol,根据反应:C2H4+H2O = C2H5OH,由差量法可表达
出乙醇的分压 ,同理可表达出乙烯和水
的分压 ,从而得出 Mpa-1
②通过反应C2H4 (g)+H2O(g)=C2H5OH(g),可以看出压强越大,
乙烯的转化率越高,从300℃ 时乙烯的转化率大小可得出:
P1﹤P2﹤P3﹤P4 。
③ 增大另一种反应物H2O蒸气的浓度,或减小生成物乙醇的
浓度,即及时分离出生成的乙醇,均可使平衡右移动,从而
提高乙烯的转化率。
考查点:物质制取方案的设计与比较、(热)化学方程式的书写、
影响化学平衡移动的因素、化学平衡常数的计算。
难易程度:中等难度。【答案】
(1)CH2=CH2+H2SO4 == C2H5OSO3H;
C2H5OSO3H+H2O == CH3CH2OH+H2SO4
(2)-45.5 减少污染,减少对设备的腐蚀。
(3) ①0.07 Mpa-1
② P1﹤P2﹤P3﹤P4;反应分子数减少,相同温度下,压强
升高乙烯转化率升高。
③增大n(H2O)︰n(C2H4)的比值,及时把生成的乙醇液化分离。36、〔化学—选修2:化学与技术〕(15分)
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔 Ca5F(PO4)3 、
Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致
情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。 图(b)是
热法磷酸生产过 程中由磷灰石制单质磷的流程。部分物质的相关性质如下:回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石
使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程
式为: 。现有1t 折合含有P2O5约30% 的磷灰石,
最多可制得85℅的商品磷酸 吨。【解析】(1)根据图示可知,含磷的肥料有两种:磷矿粉肥和
磷肥,共占:4% + 96%×85%×80%=69%
(2)湿法生产磷酸属于复分解反应,符合强酸制弱酸。根据原子
守恒可得:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF
根据P原子守恒:P2O5→2 H3PO4
142 196
0.3t 85%x
则:85%x×142=196×0.3t,x=0.49t(3)如图(b)所示,热法磷酸生产的第一步是将SiO2、过量焦炭与磷
灰石混合,高温反应生成白磷。炉渣的主要成分是 (填化学式),
冷凝塔1的主要沉积物是 ,冷凝塔2的主要沉积物是 。
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾
气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除
去 (均填化学式) 【解析】
(3) SiO2、过量焦炭与磷灰石混合,高温反应除生成白磷外,
还生成炉渣硅酸钙(CaSiO3);根据有关物质的熔沸点可知:
冷凝塔1的温度为 70℃,此时白磷蒸汽冷凝为液体;冷凝塔2
的温度为18℃,此时白磷液体固化变为固体。
(4)因为使用了过量的焦炭,所以尾气中含有大量的CO ,还
含有 SiF4 ;通过呈碱性的纯碱溶液时,酸性的H2S、HF以及
易水解的SiF4被吸收;再通过氧化性的次氯酸钠溶液,还原
性的PH3被吸收。【解析】
(5)虽然热法磷酸工艺复杂,能耗高,但用白磷可制得高纯度
的磷酸,杂质少。
考查点:磷矿石的主要用途、反应原理及有关计算。
难易程度:中等难度。(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 。【答案】
(1)69
(2)Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑ 0.49t
(3)CaSiO3,,液体白磷;固体白磷。
(4)CO、SiF4 H2S、HF、SiF4 PH3
(5)产品纯度高(或产品浓度大)37、〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素
组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,
可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,Fe3+的电子排布式为 。
可用硫氰化钾检验Fe3+ ,形成的配合物颜色为 。 【解析】
(1)从外观无法区分三者,但用X光照射时会发现,晶体会对
X射线发生衍射,而非晶体不会,准晶体介于两者之间。因
此通过有无衍射现象即可区分。
(2)基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,可知有
4个未成对电子,当失去2个4s、1个3d电子,形成Fe3+,其电
子排布为1s22s22p63s23p63d5; Fe3+与SCN-形成的多种配位化
合物都是血红色,可用于检验Fe3+。(3)新制备的氢氧化铜可将乙醛氧化为乙酸, 而自身还原成Cu2O, 乙醛
中碳原子的杂化轨道类型为 , 1 mol乙醛分子中含有的σ键
的数目为 。乙酸的沸点明显高于乙醛,其主要原因 。
氧化亚铜为半导体材料, 在其立方晶胞内部有四个氧原子, 其余氧原子
位于面心和顶点,则该晶胞中有 个铜原子。【解析】
(3)乙醛分子中甲基碳原子的空间是四面体构型,采取sp3杂化;
醛基是平面结构,碳原子采取sp2杂化;CH3CHO分子中的碳碳
键、4个碳氢键都是σ键,碳氧双键中有一个σ键,所以1mol乙
醛分子中共有6molσ键,也就是6NA;由于乙酸分子羟基极性更
强,分子间形成了氢键,使分子间作用力增强,造成沸点升高;
在Cu2O的一个晶胞中, 含氧原子数为:4+8×1/8+6×1/2=8,由
于Cu:O=2:1,故有16个Cu原子。(4) Al单质为面心立方晶体,其晶胞参数a=0 . 405nm,晶胞中铝
原子的配位数为 。列式表示Al单质的密度 g · cm-3
(不必计算出结果)【解析】
(4)在Al晶体的一个晶胞中与它距离相等且最近的原子在通过这
个顶点的三个面心上,而通过一个顶点可以形成8个晶胞,由于
每个面重复2次,所以原子的配位数为(3×8)/2=12。在一个晶
胞中含有Al原子个数为8×1/8+6×1/2=4,所以Al单质的密度为:
考查点:晶体、非晶体、准晶体的区分方法、原子结构、离子的
检验、金属晶体的密度计算。
难易程度:中等难度。g/cm3。【答案】
(1)X射线衍射法,
(2)4 1s22s22p63s23p63d5 血红色。
(3)sp3、sp2 6NA 乙酸分子间存在氢键,造成沸点升高 16
(4)12; 38、〔化学—选修5:有机化学基础〕(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。
合成G的一种路线如下:已知以下信息: ①②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤ 回答下列问题:
(1)由A生成B的化学方程式为 ,反应类型为 。
(2)D的化学名称是 ,由D生成E的化学方程式为 。
(3)G的结构简式为 。 【解析】
(1) A是氯代烷烃,发生消去反应得到烯烃B,结合信息① ②可知B是 一种对称烯烃,生成的C是丙酮 ,说明双键碳原子上没有H原子,则B的结构简式为:C(CH3)2=C(CH3)2 (2,3-二甲基-2-丁烯),A的结构简式为:CH(CH3)2-C(CH3)2Cl (2,3-二甲基-2-氯丁烷); A生成B是氯代烃的消去反应:
(2) F分子式为C8H11N,结合信息③,D为单取代芳香烃,相对分子质量为106, 则D是乙苯;F的苯环上只有两种环境的H原子, 则乙基、氨基位于对位上,故F为对氨基乙苯,E为对硝基乙苯;由 D生成E的化学方程式为:
(3)根据信息⑤ ,F与丙酮C发生的 反应生成G,可知G的结构简式:
(4)F的同分异构体中含有苯环的还有 种(不考虑立体异
构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1
的是 。(写出其中的一种的结构简式)。 【解析】
(4)F的同分异构体书写要注意思维的有序性:苯环上有3个取代基(-CH3、-CH3、-NH2)有6种;苯环2个取代基,可能为-CH2CH3、
-NH2,除F外还有2种;可能为-NH-CH3、-CH3,有3种;可能为-CH3、 -CH2-NH2,有3种;苯环上只有1个取代基有5种(-CH2CH2NH2、
-CH2NHCH3、-NHCH2CH3、-N(CH3)2、-CH(NH2)CH3 )。所以共有:6+2+3+3 +5 =19种;根据有4种氢原子,且原子个数比为6︰2︰2︰1,说明有两个-CH3,且对称。则结构简式有:
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
反应条件1所选择的试剂为 ,反应条件2所选择
的试剂为 ,I的结构简式为 。 【解析】
(5)结合题中的信息⑤,采用逆推法:J用H2加成得到产品,J为
,则I为 -NH2,H为 -NO2,反应条件1是苯环上引入硝基,试剂为:浓硝酸、浓硫酸;反应条件2把硝基还原为氨基,试剂为:Fe、稀盐酸。
考查点:有机合成与推断、物质的结构简式、化学方程式、同分异构
体的书写、反应条件的选择。
难易程度:中等难度。
(5)浓硝酸、浓硫酸; Fe/稀盐酸;三、2015年高考化学备考建议 : 通过今年的理综化学试题不难看出,2014年新课标化学试题保持相对稳定的特点, 充分体现了高考的相对稳定性。在2015年的高考中,化学试题依旧会延续“回归教材,贴近生活”的命题宗旨。?一、抓纲扣本,夯实基础? ? 要认真学习和体会《考试大纲》和《考试说明》,不要随意扩大复习范围和难度。通过针对性的知识梳理,使各个知识点系统化,以便查缺补漏。 ?二、关注主干知识,把握重点内容?
尽管历年高考试题考查的不是所有知识点,但重点知识是常考不衰的,而且题型比较稳定。透析近几年的试题不难发现以下内容:
(1)与阿伏伽德罗常数、物质的量有关的比较和计算;(2)氧化还原反应;(3)离子共存、离子方程式;(4)原子结构、元素周期表、周期率;(5)元素及其化合物的重要性质;(6)化学反应速率、化学平衡;(7)盐类水解、离子浓度的大小关系;(8)溶液的PH及计算;(9)物质或离子的检验、鉴别、物质的除杂、净化、分离等;(10)原电池、电解池;(11)有机物的分子式、结构简式、同分异构体、同系物、有机反应类型、官能团的性质及衍变关系;(12)实验基本操作、仪器、装置、评价与设计;(13)混合物的计算;(14) 化学史、环境保护、能源材料等 ;(15) 新信息、新情景材料等。?四、强化化学实验的复习,提升实验能力?
?? 实验是理综试题的重头戏,也是高考化学试题中的一个“拦路虎”,历年来学生的实验得分率总是偏低。原因主要是学生的动手少,分析问题的思维能力差。因此在后期复习中,要做好以下几点:一要对课本中出现过的演示实验、分组实验进行全面的分类复习(如分定量实验、定性实验);二要掌握各种装置的用途;三要注意实验设计和评价能力的培养;四要尽可能到实验室重做一些重要的基本操作和具有代表性的实验;五要做一些典型的实验试题。? 三、进行针对性的训练,提高解题能力??
复习时,一定要重视专题训练和仿真训练,要有意识地强化选择题、无机、有机推断(框图题)、实验题、计算题、信息迁移题等题型的训练;同时要注重经典题、历届的高考题的使用。?六、其它建议?
??? 1、注意收集 “错题”。
2、注意运用化学语言正确表述。如常见的错误表述:
(1)化学用语书写不规范。离子方程式、化学方程式书写不配
平、漏写条件、“↑”、“↓”;错用 、=、→等。
(2)简答文字叙述不达题意,不严密、不完整, 拖泥带水等。??
???3、重视应用化学知识观察、分析生活、生产和社会中的各类
有关的化学问题。?五、强化审题能力培养,保持良好应试心态?
??? 在后期做题及模拟考试时,一定要注意训练审题能力,挖掘
隐含信息和排除干扰条件。每次训练时,都要当作高考来对待,
做到心态平和,耐心细致,挖掘潜力,先易后难,准确作答。谢谢大家
同课章节目录
