【授课用】2014年高考化学(浙江卷)试题解析与点评
文档属性
| 名称 | 【授课用】2014年高考化学(浙江卷)试题解析与点评 |

|
|
| 格式 | zip | ||
| 文件大小 | 583.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-08-21 00:00:00 | ||
图片预览











文档简介
课件44张PPT。2014年
浙江高考化学试题解析浙江省武义第一中学 潘振伟 第一部分
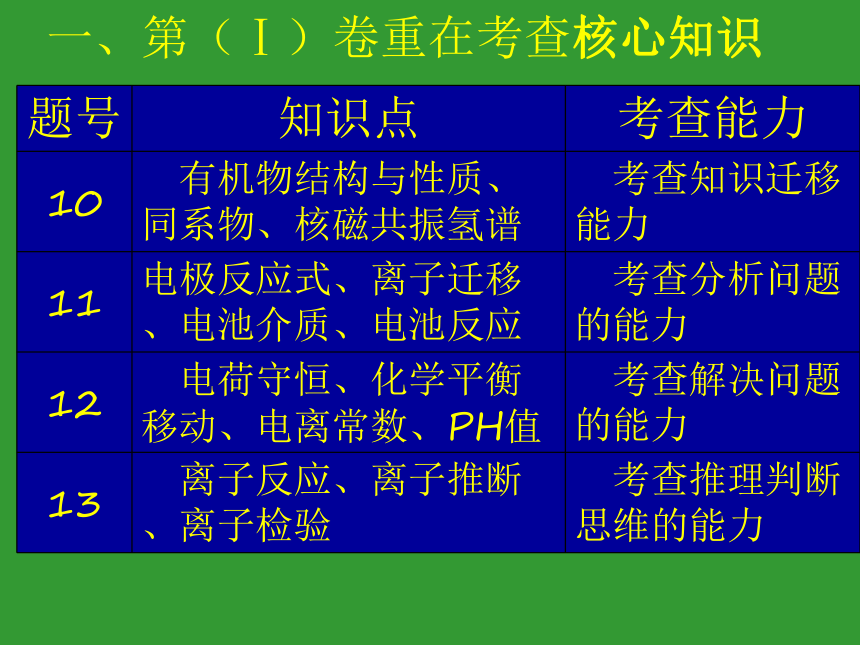
2014年浙江化学试题评价一、第(Ⅰ)卷重在考查核心知识一、第(Ⅰ)卷重在考查核心知识二、第(Ⅱ)卷重在考查学科能力二、第(Ⅱ)卷重在考查学科能力三、试卷的其它亮点三、试卷的其它亮点三、试卷的其它亮点第二部分
2014年浙江化学试题讲解7.下列说法不正确的是 ( )
A.光催化还原水制氢比电解水制氢更节能环保、 更经济
B.氨氮废水(含NH4+及N H3)可用化学氧化法或电化学氧化法处理
C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
DN/(6.02╳1023)/10-12 mol.L-1约为1-6个分子8.下列说法正确的是 ( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质B 茚三酮用于一级和二级胺和氨基酸的检测,不用于蛋白质 的检测。9.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元
素的原子最外层电子数之
和为22。下列说法正确的
是 ( )
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4D 设X的最外层电子数为a,则a+(a+1)+(a-1)+(a+2)=22,得X=5。
即X-N,Y-O,Z-Cl, W-Si T-Ge。
四氯化锗是分子晶体10.下列说法正确的是( )
A.乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物
C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
C二者核磁共振氢谱中峰的位置不同,可以鉴别11.镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式:Ni(OH)2+M=NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+ NO2-。 下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液A水电离的H+得电子被还原,不是被M还原12.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl-
K2=10-3.4
HClO H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在
三者中所占分数(α)随pH变化
的关系如图所示。下列表述正确的是 ( )
A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
CKa=10-7.5×0.5 /0.5=10-7.5K=K1 ×K2×Ka=10-12.1C(H+)=C(OH-)+C(Cl-)+C(ClO-)13.雾霾严重影响人们的生活与健康。某地区的雾霾中可 能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4B溶液中一定有NH4+、Mg2+、SO42-、NO3-,
可能有 Na+、Al3+、Cl-?。26.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示
意图________,写出气体甲的电子式_______。另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g。
(2)X的化学式是 ,在惰性气流中加热X至完全分解的化学方程式为 。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_________________________(用化学方程式表示)。
Ca Fe(CO3)2设FeO和CaO的物质的量各为a和b。则a+b=0.1, 72a+56b=6.4,解得 a=b=0.05mol。即Ca2+和Fe2+与CO32-为1:1:2.4Fe(OH)2+O2+2H2O=4Fe(OH)3(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 ,
并设计实验方案验证该反应的产物_________ 。 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶于,若显红色,表明产物有Fe(Ⅲ);
检测CO:将气体通过灼热CuO,黑色固体变为红色;
27.煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),
△H1=218.4 kJ·mol-1 (反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g),
△H2=-175.6 kJ·mol-1 ( 反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
高温△G=△H-T△S<0Kp=K4(CO2)/K4(CO) 相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)
△H1=218.4 kJ·mol-1(Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g),
△H2=-175.6 kJ·mol-1 (Ⅱ)
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由 。 (3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2) ,则下列反应过程能量变化示意图正确的是 。C 如果气相中SO2和CO2的浓度之比随时间发生变化,则表明两个反应同时进行
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施
有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度 A B C
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。 28.葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液BC(2)第②步充分反应后CaCO3固体需有剩余,
其目的是_____________________________;
本实验中不宜用CaCl2替代CaCO3,理由是
_____________________________________。 提高葡萄糖酸的转化率;便于后
续分离。 CaCl2难与葡萄糖酸直接反应得到葡萄糖酸钙(3)第③步需趁热过滤,其原因是_________________________________________________________。
(4)第④步加入乙醇的作用是_________________________________________________________。
(5)第⑥步中,下列洗涤剂最合适的是__ 。
A.冷水 B.热水
C.乙醇 D.乙醇-水混合溶液 葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会
损失产品 可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出D 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是_____。
A.可与浓盐酸形成盐 B.不与氢气发生加成反应
C.可发生水解反应 D.能形成内盐A CHNCH2CH3)2HOCH2CH2NCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:(2)写出化合物B的结构简式_____________。
(3)写出B→C反应所需的试剂__________。
(4)写出C+D→E的化学反应方程式_________________________________________。酸性KMnO4溶液
HNCH2CH3)2HOCH2CH2NCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
(5)写出同时符合下列条件的B的所有同分异构体的结构简式________________________。
①分子中含有羧基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。HOCH2CH2NCH2CH3)2HNCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学方程式表示以乙烯为原料制备X的合成路线(无机试剂任选) _____________________________________ 。
_____________________________________。CH2=CH2+HCl→CH3CH2Cl2CH3CH2Cl+NH3→HN(CH2CH3)2+2HClHOCH2CH2NCH2CH3)2HNCH2CH3)2第三部分 2015年高考化学备考和展望一、 2014年高考化学试题讲解启发 第10题氢核磁共振氢谱中乙酸乙酯和丙酸甲酯的鉴别1、化学高考题立足基础,重视能力 第11题储氢金属中, MH中H元素存在形态的判断2、化学高考题考查面广,注重细节一、 2014年高考化学试题讲解启发
4、化学高考题高于课本,获取信息3、化学高考题取材新颖,迁移应用 第28题加入乙醇的作用,从盐析迁移到醇析 第29题是三个已知条件是我们没有学习过的知识,但要求我们现场获取信息,临时解决问题。 1.元素化合物知识类试题背景材料和设问指向更为丰富
背景内容丰富多彩(以生产生活实际或实验现象分析为背景,以文字描述为基本形式物质间转化框图为形式) 但是它必定体现研究物质的基本思想,如溶解、加试剂、看现象、测量数据、推断结论。2015年高考题展望 2、化学反应原理试题更强调数据阅读分析处理,凸现了图表信息的综合运用 高考原理题将紧密联系实际,综合考查化学反应速率、化学平衡、电解质溶液、电化学等化学反应原理。2015年高考题展望 试题内容背景几乎均取之于生产实际,特别是物质制备过程中的物质分离与提纯;仪器的使用,实验的注意事项。还要关注简单的计算问题。
3.化学实验试题更加关注实验操作的细节问题2015年高考题展望 4.有机化学基础将会以合成框图为主要呈现形式
内容取材于生活中各领域的化学物质,预计将以合成框图为主要呈现形式,问题设置梯度明显,有机反应类型、有机物的命名、有机反应方程式的书写、同分异构体的确定和书写仍是命题重点。要关注对波谱知识和有机定量计算的考查。2015年高考题展望 1、对元素化合物的教学,除了一般意义上性质的复习之外,尤其是实验内容与试题的相互融合又是一个新的趋势,应该关注实验对元素化合物知识的探究和验证功能的指导、以及突出并加强元素化合物知识在实际生产生活中应用价值分析。2015年备考要点 2、化学反应原理试题强调了数据的阅读和处理、图表信息的综合运用,平时要加强这方面的训练。2015年备考要点 3.实验复习教学应尽量还原、复原课本实验,尽量将课本实验综合化是重要的复习思路。教材中所体现的设计、比较、选择、控制、探究等实验基本思想。
2015年备考要点 4.有机化学复习要以合成框图为主要呈现形式,有机反应类型、有机物的命名、有机官能团名称及书写,有机反应方程式的书写、同分异构体的确定和书写要复习到位,但要关注对波谱知识和有机定量计算的考查。2015年备考要点欢迎各位同行、专家批评指正!
2014年浙江化学试题评价一、第(Ⅰ)卷重在考查核心知识一、第(Ⅰ)卷重在考查核心知识二、第(Ⅱ)卷重在考查学科能力二、第(Ⅱ)卷重在考查学科能力三、试卷的其它亮点三、试卷的其它亮点三、试卷的其它亮点第二部分
2014年浙江化学试题讲解7.下列说法不正确的是 ( )
A.光催化还原水制氢比电解水制氢更节能环保、 更经济
B.氨氮废水(含NH4+及N H3)可用化学氧化法或电化学氧化法处理
C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
DN/(6.02╳1023)/10-12 mol.L-1约为1-6个分子8.下列说法正确的是 ( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质B 茚三酮用于一级和二级胺和氨基酸的检测,不用于蛋白质 的检测。9.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元
素的原子最外层电子数之
和为22。下列说法正确的
是 ( )
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4D 设X的最外层电子数为a,则a+(a+1)+(a-1)+(a+2)=22,得X=5。
即X-N,Y-O,Z-Cl, W-Si T-Ge。
四氯化锗是分子晶体10.下列说法正确的是( )
A.乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物
C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
C二者核磁共振氢谱中峰的位置不同,可以鉴别11.镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式:Ni(OH)2+M=NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+ NO2-。 下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液A水电离的H+得电子被还原,不是被M还原12.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl-
K2=10-3.4
HClO H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在
三者中所占分数(α)随pH变化
的关系如图所示。下列表述正确的是 ( )
A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
CKa=10-7.5×0.5 /0.5=10-7.5K=K1 ×K2×Ka=10-12.1C(H+)=C(OH-)+C(Cl-)+C(ClO-)13.雾霾严重影响人们的生活与健康。某地区的雾霾中可 能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4B溶液中一定有NH4+、Mg2+、SO42-、NO3-,
可能有 Na+、Al3+、Cl-?。26.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示
意图________,写出气体甲的电子式_______。另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g。
(2)X的化学式是 ,在惰性气流中加热X至完全分解的化学方程式为 。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_________________________(用化学方程式表示)。
Ca Fe(CO3)2设FeO和CaO的物质的量各为a和b。则a+b=0.1, 72a+56b=6.4,解得 a=b=0.05mol。即Ca2+和Fe2+与CO32-为1:1:2.4Fe(OH)2+O2+2H2O=4Fe(OH)3(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 ,
并设计实验方案验证该反应的产物_________ 。 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶于,若显红色,表明产物有Fe(Ⅲ);
检测CO:将气体通过灼热CuO,黑色固体变为红色;
27.煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),
△H1=218.4 kJ·mol-1 (反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g),
△H2=-175.6 kJ·mol-1 ( 反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
高温△G=△H-T△S<0Kp=K4(CO2)/K4(CO) 相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)
△H1=218.4 kJ·mol-1(Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g),
△H2=-175.6 kJ·mol-1 (Ⅱ)
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由 。 (3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2) ,则下列反应过程能量变化示意图正确的是 。C 如果气相中SO2和CO2的浓度之比随时间发生变化,则表明两个反应同时进行
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施
有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度 A B C
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。 28.葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液BC(2)第②步充分反应后CaCO3固体需有剩余,
其目的是_____________________________;
本实验中不宜用CaCl2替代CaCO3,理由是
_____________________________________。 提高葡萄糖酸的转化率;便于后
续分离。 CaCl2难与葡萄糖酸直接反应得到葡萄糖酸钙(3)第③步需趁热过滤,其原因是_________________________________________________________。
(4)第④步加入乙醇的作用是_________________________________________________________。
(5)第⑥步中,下列洗涤剂最合适的是__ 。
A.冷水 B.热水
C.乙醇 D.乙醇-水混合溶液 葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会
损失产品 可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出D 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是_____。
A.可与浓盐酸形成盐 B.不与氢气发生加成反应
C.可发生水解反应 D.能形成内盐A CHNCH2CH3)2HOCH2CH2NCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:(2)写出化合物B的结构简式_____________。
(3)写出B→C反应所需的试剂__________。
(4)写出C+D→E的化学反应方程式_________________________________________。酸性KMnO4溶液
HNCH2CH3)2HOCH2CH2NCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
(5)写出同时符合下列条件的B的所有同分异构体的结构简式________________________。
①分子中含有羧基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。HOCH2CH2NCH2CH3)2HNCH2CH3)2 29.某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学方程式表示以乙烯为原料制备X的合成路线(无机试剂任选) _____________________________________ 。
_____________________________________。CH2=CH2+HCl→CH3CH2Cl2CH3CH2Cl+NH3→HN(CH2CH3)2+2HClHOCH2CH2NCH2CH3)2HNCH2CH3)2第三部分 2015年高考化学备考和展望一、 2014年高考化学试题讲解启发 第10题氢核磁共振氢谱中乙酸乙酯和丙酸甲酯的鉴别1、化学高考题立足基础,重视能力 第11题储氢金属中, MH中H元素存在形态的判断2、化学高考题考查面广,注重细节一、 2014年高考化学试题讲解启发
4、化学高考题高于课本,获取信息3、化学高考题取材新颖,迁移应用 第28题加入乙醇的作用,从盐析迁移到醇析 第29题是三个已知条件是我们没有学习过的知识,但要求我们现场获取信息,临时解决问题。 1.元素化合物知识类试题背景材料和设问指向更为丰富
背景内容丰富多彩(以生产生活实际或实验现象分析为背景,以文字描述为基本形式物质间转化框图为形式) 但是它必定体现研究物质的基本思想,如溶解、加试剂、看现象、测量数据、推断结论。2015年高考题展望 2、化学反应原理试题更强调数据阅读分析处理,凸现了图表信息的综合运用 高考原理题将紧密联系实际,综合考查化学反应速率、化学平衡、电解质溶液、电化学等化学反应原理。2015年高考题展望 试题内容背景几乎均取之于生产实际,特别是物质制备过程中的物质分离与提纯;仪器的使用,实验的注意事项。还要关注简单的计算问题。
3.化学实验试题更加关注实验操作的细节问题2015年高考题展望 4.有机化学基础将会以合成框图为主要呈现形式
内容取材于生活中各领域的化学物质,预计将以合成框图为主要呈现形式,问题设置梯度明显,有机反应类型、有机物的命名、有机反应方程式的书写、同分异构体的确定和书写仍是命题重点。要关注对波谱知识和有机定量计算的考查。2015年高考题展望 1、对元素化合物的教学,除了一般意义上性质的复习之外,尤其是实验内容与试题的相互融合又是一个新的趋势,应该关注实验对元素化合物知识的探究和验证功能的指导、以及突出并加强元素化合物知识在实际生产生活中应用价值分析。2015年备考要点 2、化学反应原理试题强调了数据的阅读和处理、图表信息的综合运用,平时要加强这方面的训练。2015年备考要点 3.实验复习教学应尽量还原、复原课本实验,尽量将课本实验综合化是重要的复习思路。教材中所体现的设计、比较、选择、控制、探究等实验基本思想。
2015年备考要点 4.有机化学复习要以合成框图为主要呈现形式,有机反应类型、有机物的命名、有机官能团名称及书写,有机反应方程式的书写、同分异构体的确定和书写要复习到位,但要关注对波谱知识和有机定量计算的考查。2015年备考要点欢迎各位同行、专家批评指正!
同课章节目录
