7.3 溶液浓稀的表示同步练习 (含解析)
文档属性
| 名称 | 7.3 溶液浓稀的表示同步练习 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 137.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-28 10:09:37 | ||
图片预览



文档简介
7.3 溶液浓稀的表示
一、选择题
下列关于溶液的说法错误的是
A.与乳化作用相比,溶解能使物质混合得更均匀
B.食盐的饱和溶液变成不饱和溶液后,溶质的质量分数不一定变小
C.一定温度下,搅拌可以增加食盐的溶解的质量
D.饱和溶液恒温蒸发部分水后,剩余溶液的溶质质量分数不变
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,下列说法正确的是
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D. 时,甲的溶解度最大
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,下列说法正确的是
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D. 时,甲的溶解度最大
炎热夏天,从冰箱冷藏室()取出一杯底部有少量蔗糖固体的蔗糖溶液 ,室温下放置一段时间后晶体消失并得到溶液 。下列有关说法,错误的是
A. 时, 溶液一定是饱和溶液
B.室温下, 溶液一定是饱和溶液
C.蔗糖的溶解度随温度升高而增大
D.溶液 的溶质质量分数比溶液 的小
如下图所示,一定温度下将蔗糖的不饱和溶液恒温蒸发去适量水,直到有少量晶体析出。在此变化过程中,溶质质量分数()与时间()的相互关系是
A. B.
C. D.
下列物质长期放置在空气中,溶液质量和溶质质量分数都会减小的是
A.氢氧化钠溶液 B.浓盐酸 C.浓硫酸 D.食盐溶液
以下应用守恒思想解决相关问题,推论正确的是
A.聚乙烯在空气中燃烧生成二氧化碳和水,根据元素守恒推出其组成元素为碳、氢、氧
B. 硫与 氧气充分反应,根据质量守恒推出生成 二氧化硫
C. 的盐酸加入 水,根据溶质守恒推出稀盐酸的溶质质量分数为
D.水电解生成 和 的分子个数比为 ,根据原子守恒推出水分子中 、 原子个数比为
配制 的氯化钠溶液时,不需用到的仪器是
A. 量筒 B.烧杯 C.玻璃棒 D.天平
已知 时,硝酸钾的溶解度是 克/ 克水,则在 时,向 克溶质质量分数为 的硝酸钾溶液中再加 克硝酸钾,加入硝酸钾后溶液的溶质质量分数为
A. B. C. D.
在 时有 硝酸钾饱和溶液,在以下各种操作中,能改变溶液中溶质的质量分数的是
A.温度不变蒸发 水 B.温度不变加入 水
C.温度不变加入 硝酸钾 D.用玻璃棒搅拌
向 克 的 溶液中加入 并搅拌至完全溶解,则所得 的溶质质分数是
A. B. C. D.
下列条件下的氢氧化钙溶液,其质量分数最大的是
A. 的饱和溶液 B. 的不饱和溶液
C. 的不饱和溶液 D. 的饱和溶液
二、填空题(共3题)
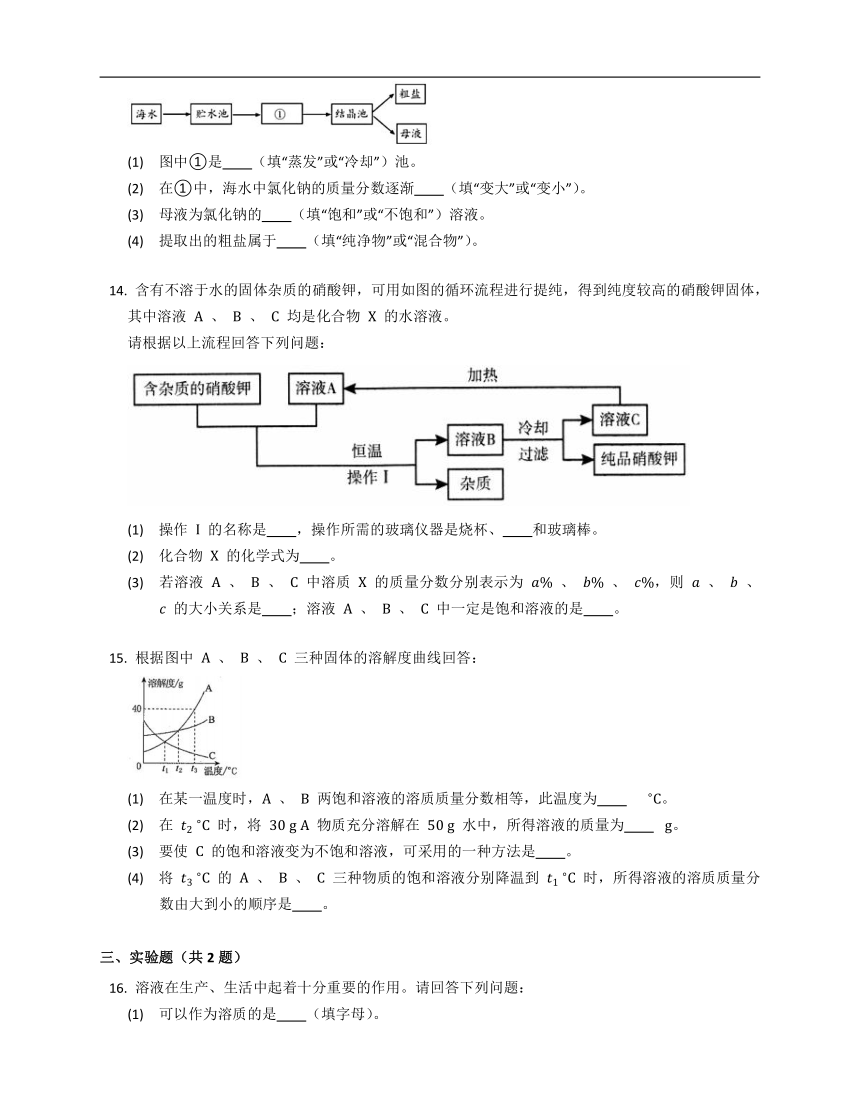
下图是利用海水提取粗盐的过程。
(1) 图中①是 (填“蒸发”或“冷却”)池。
(2) 在①中,海水中氯化钠的质量分数逐渐 (填“变大”或“变小”)。
(3) 母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
(4) 提取出的粗盐属于 (填“纯净物”或“混合物”)。
含有不溶于水的固体杂质的硝酸钾,可用如图的循环流程进行提纯,得到纯度较高的硝酸钾固体,其中溶液 、 、 均是化合物 的水溶液。
请根据以上流程回答下列问题:
(1) 操作 的名称是 ,操作所需的玻璃仪器是烧杯、 和玻璃棒。
(2) 化合物 的化学式为 。
(3) 若溶液 、 、 中溶质 的质量分数分别表示为 、 、 ,则 、 、 的大小关系是 ;溶液 、 、 中一定是饱和溶液的是 。
根据图中 、 、 三种固体的溶解度曲线回答:
(1) 在某一温度时, 、 两饱和溶液的溶质质量分数相等,此温度为 。
(2) 在 时,将 物质充分溶解在 水中,所得溶液的质量为 。
(3) 要使 的饱和溶液变为不饱和溶液,可采用的一种方法是 。
(4) 将 的 、 、 三种物质的饱和溶液分别降温到 时,所得溶液的溶质质量分数由大到小的顺序是 。
三、实验题(共2题)
溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1) 可以作为溶质的是 (填字母)。
A.只有固体
B.只有液体
C.只有气体
D.气体、液体、固体都可以
(2) 生活中常用 的酒精消毒,配制 的酒精溶液不需要用到的仪器有 (填序号)。
①天平
②胶头滴管
③漏斗
④量筒
⑤烧杯
⑥玻璃棒
(3) 图甲是小明在 时进行的系列实验示意图,① ⑤表示实验所得溶液;图乙是 , 的溶解度曲线。
i 时, 的溶解度() ;⑤是 (填“饱和”或“不饱和”)溶液。
ii 时,饱和 溶液中溶质的质量分数()与饱和 溶液中溶质的质量分数( )的大小关系是: (填“”、“”或“”)。
iii 小明发现:升温至 ,② ③的过程中有少量水蒸发。下列叙述正确的是 (填序号)。
A.①、②均为不饱和溶液
B.②中溶质与溶剂的质量比为
C.② ③的过程中溶质质量分数变大
D.④ ⑤的过程中析出 晶体
iv 除去 固体中混有的少量 的实验操作是:加适量水溶解 加热得到热饱和溶液 过滤 洗涤 干燥 晶体。
水是宝贵的自然资源,对于人类生活、工农业生产都具有重要意义。
(1) 保持水的化学性质的微粒是 (填名称)。
(2) 写出一个能够证明水由氢元素和氧元素组成的实验名称是 。
(3) 自来水消毒的过程中,发生了水与氯气()的反应,该反应可以用下图表示。
氯气中约含 个氯原子。该反应的化学方程式为 。
从以上微观示意图,你可以得出的信息有 (写出一条即可)。
(4) 许多物质能够溶解在水中,下表列出了 在不同温度下的溶解度。
i 由上表可推出, 溶解度曲线的变化规律是 。
ii 在 时,向 水中加入 ,形成 (选填“饱和”或“不饱和”)溶液,将其温度升高到 时,溶质与溶剂的质量比为 。
iii 时, 饱和溶液 ,要使其质量分数变为 ,需加水 。
答案
一、选择题(共12题)
1. 【答案】C
【解析】与乳化作用相比,溶解能使物质混合得更均匀,A项正确;食盐的饱和溶液由于溶解度变大变成不饱和溶液时,溶质的质量分数不变,所以食盐的饱和溶液变成不饱和溶液后,溶质的质量分数不一定变小,B项正确;一定温度下,搅拌可以加快食盐的溶解速率,不能增加食盐的溶解的质量,C项错误;温度不变,物质的溶解度不变,所以饱和溶液恒温蒸发部分水后,剩余溶液的溶质质量分数不变,D项正确。
【知识点】溶液的定义、质量百分比浓度概念辨析及定义式计算、乳化原理及应用
2. 【答案】C
【解析】丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,A项错误;
丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,B项错误;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则丙溶液的溶质质量分数最大,C项正确;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则 时,丙的溶解度最大,D项错误。
答案选C。
【知识点】质量百分比浓度概念辨析及定义式计算、溶解度的计算、饱和溶液
3. 【答案】C
【解析】丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,A项错误;
丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,B项错误;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则丙溶液的溶质质量分数最大,C项正确;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则 时,丙的溶解度最大,D项错误。
答案选C。
【知识点】饱和溶液、溶解度的计算、质量百分比浓度概念辨析及定义式计算
4. 【答案】B
【知识点】质量百分比浓度概念辨析及定义式计算、饱和溶液、常见物质溶解度随温度变化趋势
5. 【答案】D
【知识点】质量百分比浓度概念辨析及定义式计算
6. 【答案】B
【知识点】盐酸的物理性质、浓硫酸吸水、质量百分比浓度概念辨析及定义式计算
7. 【答案】D
【知识点】质量守恒定律定义辨析、浓缩稀释计算质量百分比浓度
8. 【答案】A
【知识点】配制一定浓度的溶液、选择仪器药品
9. 【答案】B
【知识点】质量百分比浓度与溶解度的换算
10. 【答案】A
【知识点】质量百分比浓度概念辨析及定义式计算
11. 【答案】D
【知识点】质量百分比浓度概念辨析及定义式计算
12. 【答案】D
【知识点】饱和不饱和与浓稀溶液的关系、质量百分比浓度与溶解度的换算、常见物质溶解度随温度变化趋势
二、填空题(共3题)
13. 【答案】
(1) 蒸发
(2) 变大
(3) 饱和
(4) 混合物
【知识点】蒸发结晶、饱和溶液、混合物、质量百分比浓度概念辨析及定义式计算
14. 【答案】
(1) 过滤;漏斗
(2)
(3) ;
【知识点】质量百分比浓度概念辨析及定义式计算、物质分离、提纯、过滤、物理方法分离、提纯、饱和溶液
15. 【答案】
(1)
(2)
(3) 降温(或增加溶剂)
(4)
【知识点】专题:s-T曲线、饱和溶液与不饱和溶液的互相转化、溶液的组成、溶解度定义、质量百分比浓度概念辨析及定义式计算
三、实验题(共2题)
16. 【答案】
(1) D
(2) ①③
(3) i ;饱和
ii
iii C
iv 降温结晶
【解析】
(1) 本题考查了溶解度曲线及其应用,有关溶液结晶的方法和溶质质量分数的变化等。
可以作为溶质的是:气体、液体、固体都可以。故选D。
(2) 生活中常用 的酒精消毒,配制 的酒精溶液不需要用到的仪器有:天平、漏斗;故选①③。
(3) i 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,⑤中 水, 的 , 不能全部溶解,有固体析出⑤是饱和溶液。
ii 时氯化钠的溶解度小于硝酸钾,一定温度下的饱和溶液的溶质质量分数 , 时,饱和 溶液中溶质的质量分数( )与饱和 溶液中溶质的质量分数( )的大小关系是:。
iii A. 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,①中只有 形成的是不饱和溶液,②中有 形成的是饱和溶液,错误;
B.②中有 水,根据溶解度的涵义可知最多溶解 ,溶质与溶剂的质量比为 ,错误;
C.升温至 溶解度增大,虽在② ③的过程中有少量水蒸发,烧杯底部的固体会逐渐溶解,溶质质量分数变大,正确;
D. 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,④ ⑤的过程中析出 晶体的质量 ,错误。
iv 除去 固体中混有的少量 的实验操作是:加适量水溶解 加热得到热饱和溶液 降温结晶 过滤 洗涤 干燥 晶体。
【知识点】配制一定浓度的溶液-操作步骤、饱和溶液、溶液的组成、质量百分比浓度概念辨析及定义式计算、专题:s-T曲线、不饱和溶液、选择仪器药品、溶解度定义、质量百分比浓度与溶解度的换算、降温结晶
17. 【答案】
(1) 水分子
(2) 氢气在氧气中燃烧(或水通电,合理即可)
(3) ;;化学变化前后,元素种类不变(合理即可,从微观、从质量守恒定律的角度,比如化学反应前后,原子种类、个数不变等)
(4) i 溶解度随温度升高而变大
ii 饱和;
iii
【知识点】分子的概念、溶解度定义、微粒与物质变化、溶液的组成、物质的量与微粒数的关系(沪教版)、浓缩稀释计算质量百分比浓度、氢气的可燃性、化学方程式、常见物质溶解度随温度变化趋势、饱和溶液、电解水实验
一、选择题
下列关于溶液的说法错误的是
A.与乳化作用相比,溶解能使物质混合得更均匀
B.食盐的饱和溶液变成不饱和溶液后,溶质的质量分数不一定变小
C.一定温度下,搅拌可以增加食盐的溶解的质量
D.饱和溶液恒温蒸发部分水后,剩余溶液的溶质质量分数不变
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,下列说法正确的是
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D. 时,甲的溶解度最大
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,下列说法正确的是
A.所得溶液一定都是饱和溶液 B.丙溶液一定是不饱和溶液
C.丙溶液的溶质质量分数最大 D. 时,甲的溶解度最大
炎热夏天,从冰箱冷藏室()取出一杯底部有少量蔗糖固体的蔗糖溶液 ,室温下放置一段时间后晶体消失并得到溶液 。下列有关说法,错误的是
A. 时, 溶液一定是饱和溶液
B.室温下, 溶液一定是饱和溶液
C.蔗糖的溶解度随温度升高而增大
D.溶液 的溶质质量分数比溶液 的小
如下图所示,一定温度下将蔗糖的不饱和溶液恒温蒸发去适量水,直到有少量晶体析出。在此变化过程中,溶质质量分数()与时间()的相互关系是
A. B.
C. D.
下列物质长期放置在空气中,溶液质量和溶质质量分数都会减小的是
A.氢氧化钠溶液 B.浓盐酸 C.浓硫酸 D.食盐溶液
以下应用守恒思想解决相关问题,推论正确的是
A.聚乙烯在空气中燃烧生成二氧化碳和水,根据元素守恒推出其组成元素为碳、氢、氧
B. 硫与 氧气充分反应,根据质量守恒推出生成 二氧化硫
C. 的盐酸加入 水,根据溶质守恒推出稀盐酸的溶质质量分数为
D.水电解生成 和 的分子个数比为 ,根据原子守恒推出水分子中 、 原子个数比为
配制 的氯化钠溶液时,不需用到的仪器是
A. 量筒 B.烧杯 C.玻璃棒 D.天平
已知 时,硝酸钾的溶解度是 克/ 克水,则在 时,向 克溶质质量分数为 的硝酸钾溶液中再加 克硝酸钾,加入硝酸钾后溶液的溶质质量分数为
A. B. C. D.
在 时有 硝酸钾饱和溶液,在以下各种操作中,能改变溶液中溶质的质量分数的是
A.温度不变蒸发 水 B.温度不变加入 水
C.温度不变加入 硝酸钾 D.用玻璃棒搅拌
向 克 的 溶液中加入 并搅拌至完全溶解,则所得 的溶质质分数是
A. B. C. D.
下列条件下的氢氧化钙溶液,其质量分数最大的是
A. 的饱和溶液 B. 的不饱和溶液
C. 的不饱和溶液 D. 的饱和溶液
二、填空题(共3题)
下图是利用海水提取粗盐的过程。
(1) 图中①是 (填“蒸发”或“冷却”)池。
(2) 在①中,海水中氯化钠的质量分数逐渐 (填“变大”或“变小”)。
(3) 母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
(4) 提取出的粗盐属于 (填“纯净物”或“混合物”)。
含有不溶于水的固体杂质的硝酸钾,可用如图的循环流程进行提纯,得到纯度较高的硝酸钾固体,其中溶液 、 、 均是化合物 的水溶液。
请根据以上流程回答下列问题:
(1) 操作 的名称是 ,操作所需的玻璃仪器是烧杯、 和玻璃棒。
(2) 化合物 的化学式为 。
(3) 若溶液 、 、 中溶质 的质量分数分别表示为 、 、 ,则 、 、 的大小关系是 ;溶液 、 、 中一定是饱和溶液的是 。
根据图中 、 、 三种固体的溶解度曲线回答:
(1) 在某一温度时, 、 两饱和溶液的溶质质量分数相等,此温度为 。
(2) 在 时,将 物质充分溶解在 水中,所得溶液的质量为 。
(3) 要使 的饱和溶液变为不饱和溶液,可采用的一种方法是 。
(4) 将 的 、 、 三种物质的饱和溶液分别降温到 时,所得溶液的溶质质量分数由大到小的顺序是 。
三、实验题(共2题)
溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1) 可以作为溶质的是 (填字母)。
A.只有固体
B.只有液体
C.只有气体
D.气体、液体、固体都可以
(2) 生活中常用 的酒精消毒,配制 的酒精溶液不需要用到的仪器有 (填序号)。
①天平
②胶头滴管
③漏斗
④量筒
⑤烧杯
⑥玻璃棒
(3) 图甲是小明在 时进行的系列实验示意图,① ⑤表示实验所得溶液;图乙是 , 的溶解度曲线。
i 时, 的溶解度() ;⑤是 (填“饱和”或“不饱和”)溶液。
ii 时,饱和 溶液中溶质的质量分数()与饱和 溶液中溶质的质量分数( )的大小关系是: (填“”、“”或“”)。
iii 小明发现:升温至 ,② ③的过程中有少量水蒸发。下列叙述正确的是 (填序号)。
A.①、②均为不饱和溶液
B.②中溶质与溶剂的质量比为
C.② ③的过程中溶质质量分数变大
D.④ ⑤的过程中析出 晶体
iv 除去 固体中混有的少量 的实验操作是:加适量水溶解 加热得到热饱和溶液 过滤 洗涤 干燥 晶体。
水是宝贵的自然资源,对于人类生活、工农业生产都具有重要意义。
(1) 保持水的化学性质的微粒是 (填名称)。
(2) 写出一个能够证明水由氢元素和氧元素组成的实验名称是 。
(3) 自来水消毒的过程中,发生了水与氯气()的反应,该反应可以用下图表示。
氯气中约含 个氯原子。该反应的化学方程式为 。
从以上微观示意图,你可以得出的信息有 (写出一条即可)。
(4) 许多物质能够溶解在水中,下表列出了 在不同温度下的溶解度。
i 由上表可推出, 溶解度曲线的变化规律是 。
ii 在 时,向 水中加入 ,形成 (选填“饱和”或“不饱和”)溶液,将其温度升高到 时,溶质与溶剂的质量比为 。
iii 时, 饱和溶液 ,要使其质量分数变为 ,需加水 。
答案
一、选择题(共12题)
1. 【答案】C
【解析】与乳化作用相比,溶解能使物质混合得更均匀,A项正确;食盐的饱和溶液由于溶解度变大变成不饱和溶液时,溶质的质量分数不变,所以食盐的饱和溶液变成不饱和溶液后,溶质的质量分数不一定变小,B项正确;一定温度下,搅拌可以加快食盐的溶解速率,不能增加食盐的溶解的质量,C项错误;温度不变,物质的溶解度不变,所以饱和溶液恒温蒸发部分水后,剩余溶液的溶质质量分数不变,D项正确。
【知识点】溶液的定义、质量百分比浓度概念辨析及定义式计算、乳化原理及应用
2. 【答案】C
【解析】丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,A项错误;
丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,B项错误;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则丙溶液的溶质质量分数最大,C项正确;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则 时,丙的溶解度最大,D项错误。
答案选C。
【知识点】质量百分比浓度概念辨析及定义式计算、溶解度的计算、饱和溶液
3. 【答案】C
【解析】丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,A项错误;
丙物质未溶解固体的质量为 ,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,B项错误;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则丙溶液的溶质质量分数最大,C项正确;
溶剂质量相同(),而甲、乙、丙三种溶液中溶质质量的大小关系为丙 乙 甲,则 时,丙的溶解度最大,D项错误。
答案选C。
【知识点】饱和溶液、溶解度的计算、质量百分比浓度概念辨析及定义式计算
4. 【答案】B
【知识点】质量百分比浓度概念辨析及定义式计算、饱和溶液、常见物质溶解度随温度变化趋势
5. 【答案】D
【知识点】质量百分比浓度概念辨析及定义式计算
6. 【答案】B
【知识点】盐酸的物理性质、浓硫酸吸水、质量百分比浓度概念辨析及定义式计算
7. 【答案】D
【知识点】质量守恒定律定义辨析、浓缩稀释计算质量百分比浓度
8. 【答案】A
【知识点】配制一定浓度的溶液、选择仪器药品
9. 【答案】B
【知识点】质量百分比浓度与溶解度的换算
10. 【答案】A
【知识点】质量百分比浓度概念辨析及定义式计算
11. 【答案】D
【知识点】质量百分比浓度概念辨析及定义式计算
12. 【答案】D
【知识点】饱和不饱和与浓稀溶液的关系、质量百分比浓度与溶解度的换算、常见物质溶解度随温度变化趋势
二、填空题(共3题)
13. 【答案】
(1) 蒸发
(2) 变大
(3) 饱和
(4) 混合物
【知识点】蒸发结晶、饱和溶液、混合物、质量百分比浓度概念辨析及定义式计算
14. 【答案】
(1) 过滤;漏斗
(2)
(3) ;
【知识点】质量百分比浓度概念辨析及定义式计算、物质分离、提纯、过滤、物理方法分离、提纯、饱和溶液
15. 【答案】
(1)
(2)
(3) 降温(或增加溶剂)
(4)
【知识点】专题:s-T曲线、饱和溶液与不饱和溶液的互相转化、溶液的组成、溶解度定义、质量百分比浓度概念辨析及定义式计算
三、实验题(共2题)
16. 【答案】
(1) D
(2) ①③
(3) i ;饱和
ii
iii C
iv 降温结晶
【解析】
(1) 本题考查了溶解度曲线及其应用,有关溶液结晶的方法和溶质质量分数的变化等。
可以作为溶质的是:气体、液体、固体都可以。故选D。
(2) 生活中常用 的酒精消毒,配制 的酒精溶液不需要用到的仪器有:天平、漏斗;故选①③。
(3) i 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,⑤中 水, 的 , 不能全部溶解,有固体析出⑤是饱和溶液。
ii 时氯化钠的溶解度小于硝酸钾,一定温度下的饱和溶液的溶质质量分数 , 时,饱和 溶液中溶质的质量分数( )与饱和 溶液中溶质的质量分数( )的大小关系是:。
iii A. 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,①中只有 形成的是不饱和溶液,②中有 形成的是饱和溶液,错误;
B.②中有 水,根据溶解度的涵义可知最多溶解 ,溶质与溶剂的质量比为 ,错误;
C.升温至 溶解度增大,虽在② ③的过程中有少量水蒸发,烧杯底部的固体会逐渐溶解,溶质质量分数变大,正确;
D. 时, 的溶解度 ; 时, 的溶解度 即 时 水中最多溶解 ,④ ⑤的过程中析出 晶体的质量 ,错误。
iv 除去 固体中混有的少量 的实验操作是:加适量水溶解 加热得到热饱和溶液 降温结晶 过滤 洗涤 干燥 晶体。
【知识点】配制一定浓度的溶液-操作步骤、饱和溶液、溶液的组成、质量百分比浓度概念辨析及定义式计算、专题:s-T曲线、不饱和溶液、选择仪器药品、溶解度定义、质量百分比浓度与溶解度的换算、降温结晶
17. 【答案】
(1) 水分子
(2) 氢气在氧气中燃烧(或水通电,合理即可)
(3) ;;化学变化前后,元素种类不变(合理即可,从微观、从质量守恒定律的角度,比如化学反应前后,原子种类、个数不变等)
(4) i 溶解度随温度升高而变大
ii 饱和;
iii
【知识点】分子的概念、溶解度定义、微粒与物质变化、溶液的组成、物质的量与微粒数的关系(沪教版)、浓缩稀释计算质量百分比浓度、氢气的可燃性、化学方程式、常见物质溶解度随温度变化趋势、饱和溶液、电解水实验
