第6章常用的金属和盐检测题(含答案)---2022-2023学年九年级化学沪教版(上海)第二学期
文档属性
| 名称 | 第6章常用的金属和盐检测题(含答案)---2022-2023学年九年级化学沪教版(上海)第二学期 |
|
|
| 格式 | docx | ||
| 文件大小 | 212.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-28 10:56:21 | ||
图片预览


文档简介
第6章《常用的金属和盐》检测题
一、单选题
1.下列变化表现为吸收热量的是
A.镁和盐酸反应 B.天然气在空气中燃烧
C.碳与二氧化碳的反应 D.生石灰投入水中
2.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
选项 待提纯的物质 选用的试剂 操作的方法
A CuSO4溶液(H2SO4溶液) 过量的氢氧化钠溶液 过滤
B HNO3溶液(HCl溶液) 过量的AgNO3溶液 过滤
C Cu(Fe) 过量的稀盐酸 溶解、过滤
D CO2(CO) 氧气 点燃
A.A B.B C.C D.D
3.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用只是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,铁元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
4.图示材料属于合金的是
A.高纯硅片 B.青铜器
C.青花瓷器 D.汉白玉雕塑
5.现有X、Y、Z三种金属,已知:① ② ③不反应,则下列符合要求的X、Y、Z分别是
A.Cu、Zn、Fe B.Cu、Fe、Ag C.Ag、Zn、Mg D.Ag、Zn、Cu
6.向AgNO3和Cu(NO3)2混合溶液中加入一定量铜粉,充分反应后过滤,滤得固体中一定含有的金属是( )
A.Ag B.Cu C.Ag、Cu D.不能确定
7.“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是:
A.黄铜片比铜片硬度小
B.多数合金的熔点低于组成它的纯金属
C.生锈的钢铁制品没有回收价值
D.合金中一定不含有非金属
8.黄金溶解在“王水”(浓盐酸与浓硝酸的混合液)中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是
A.“王水” 溶解黄金是物理变化
B.金比氢活泼
C.HAuCl4中,Au的化合价为+3价
D.“王水” 能用铁质容器盛装
9.一定条件下,能用NaOH溶液和红色石蕊试纸检验的离子是
A. B.K+ C. D.
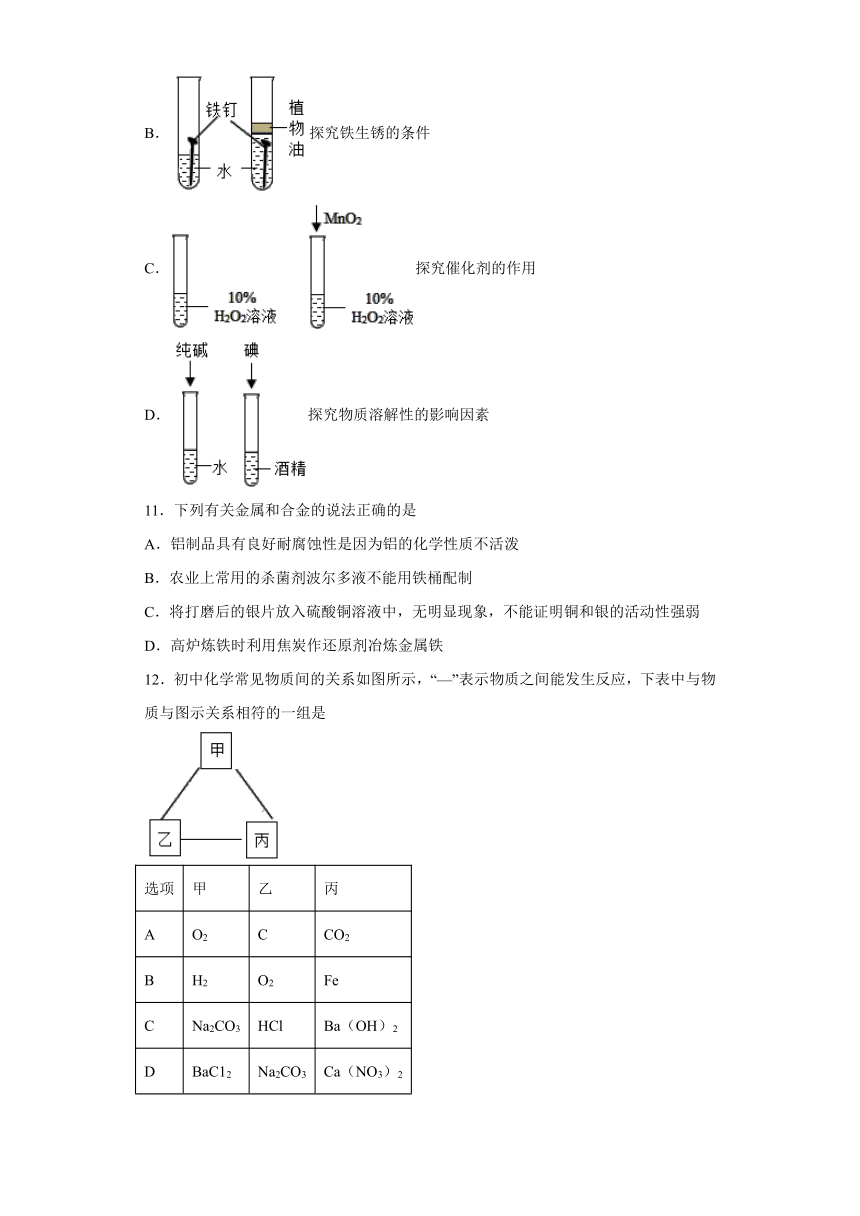
10.下列实验中不发生化学变化的是
A.探究可燃物燃烧条件
B.探究铁生锈的条件
C.探究催化剂的作用
D.探究物质溶解性的影响因素
11.下列有关金属和合金的说法正确的是
A.铝制品具有良好耐腐蚀性是因为铝的化学性质不活泼
B.农业上常用的杀菌剂波尔多液不能用铁桶配制
C.将打磨后的银片放入硫酸铜溶液中,无明显现象,不能证明铜和银的活动性强弱
D.高炉炼铁时利用焦炭作还原剂冶炼金属铁
12.初中化学常见物质间的关系如图所示,“—”表示物质之间能发生反应,下表中与物质与图示关系相符的一组是
选项 甲 乙 丙
A O2 C CO2
B H2 O2 Fe
C Na2CO3 HCl Ba(OH)2
D BaC12 Na2CO3 Ca(NO3)2
A.A B.B C.C D.D
二、填空题
13.现有氢、氧、硫、铁四种元素,请选用其中两种或几种元素组成符合下列要求的物质,写出化学式各一个:
(1)酸_____
(2)碱_____
(3)金属氧化物_____
(4)盐_____.
14.化学与我们的生活和生产密切相关。请用下列物质的序号填空:
①氧气 ②氦气 ③不锈钢 ④硝酸钾⑤石墨
(1)用来填充飞艇的是______;
(2)能作铅笔芯的是______;
(3)可用于制作炊具的是______;
(4)维持人的生命活动所必需的物质是______ ;
(5)常用冷却热饱和溶液提纯的物质是______。
15.生产生活中很多领域涉及化学知识,请用适当的化学用语填空:
(1)氖气可充入霓虹灯中使用,保持氖气化学性质的最小粒子是____。
(2)用于游泳池消毒的硫酸铜含有的阴离子是_____。
(3)能用作食品干燥剂,能与水反应放热,俗称生石灰的物质是_____。
三、实验题
16.氢化钙固体常作为登山运动员的能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:
查阅资料:a.钙易与水反应生成碱和气体。b.无水氯化钙能作干燥剂。
①请写出E图中仪器①的名称___________。
②请按气流方向连接装置顺序D→__→___ →E→A (填装置编号)。写出C中可能发生的化学方程式:_____________。
③实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验的确有CaH2生成。另一位同学认为该同学的判断不准确,原因是_______。氢化钙作为能源提供剂,与直接用氢气相比,其优点是__________(答出任何一点即可)。
四、计算题
17.为测定某稀硫酸的溶质质量分数,小华取一定量碳酸钠放入烧杯中,称量烧杯及碳酸钠的总质量为121.2g,将150g稀硫酸分五次加入烧杯中,并称量每次反应后烧杯及烧杯内物质的总质量,数据如下表,请根据相关知识和数据回答下列问题:
实验次数 加入稀硫酸的质量/g 反应后烧杯及烧杯内物质的总质量/g
1 30 150.1
2 30 179
3 30 207.9
4 30 236.8
5 30 266.8
(1)碳酸钠的水溶液显___________(填“酸”、“碱”或“中”)性。
(2)反应完全后产生气体的质量为___________g。
(3)该稀硫酸的溶质质量分数是多少?(结果精确到0.1%)
18.用“侯氏制碱法”制得的纯碱常含有少量的氯化钠。为了测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3克,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示。求:(请写明解题过程)
(1)该纯碱样品中碳酸钠的质量。
(2)所加入氯化钙溶液的溶质质量分数。
试卷第4页,共5页
参考答案:
1.C
2.C
3.D
4.B
5.B
6.A
7.B
8.C
9.D
10.D
11.B
12.C
13.(1)H2SO4(合理即可)
(2)Fe(OH)3(合理即可)
(3)FeO(答案合理即可)
(4)FeSO4(答案合理即可)
14. ② ⑤ ③ ① ④
15.(1)Ne
(2)
(3)CaO
16. 铁架台 C B 钙与水反应也能生成碱,同时也有气泡冒出 便于携带;安全;通过反应,能将水中的氢元素部分转化为氢气
17.(1)碱
(2)4.4
(3)8.2%
解:设30g稀硫酸中硫酸质量为x
x=2.45g
稀硫酸溶质质量分数为: 。
答:稀硫酸溶质质量分数为8.2%。
18.(1)3.18(2)15%
一、单选题
1.下列变化表现为吸收热量的是
A.镁和盐酸反应 B.天然气在空气中燃烧
C.碳与二氧化碳的反应 D.生石灰投入水中
2.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
选项 待提纯的物质 选用的试剂 操作的方法
A CuSO4溶液(H2SO4溶液) 过量的氢氧化钠溶液 过滤
B HNO3溶液(HCl溶液) 过量的AgNO3溶液 过滤
C Cu(Fe) 过量的稀盐酸 溶解、过滤
D CO2(CO) 氧气 点燃
A.A B.B C.C D.D
3.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用只是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,铁元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
4.图示材料属于合金的是
A.高纯硅片 B.青铜器
C.青花瓷器 D.汉白玉雕塑
5.现有X、Y、Z三种金属,已知:① ② ③不反应,则下列符合要求的X、Y、Z分别是
A.Cu、Zn、Fe B.Cu、Fe、Ag C.Ag、Zn、Mg D.Ag、Zn、Cu
6.向AgNO3和Cu(NO3)2混合溶液中加入一定量铜粉,充分反应后过滤,滤得固体中一定含有的金属是( )
A.Ag B.Cu C.Ag、Cu D.不能确定
7.“中国制造”、“一带一路”的基础建设都需要用到大量金属材料。下列有关金属材料的说法正确的是:
A.黄铜片比铜片硬度小
B.多数合金的熔点低于组成它的纯金属
C.生锈的钢铁制品没有回收价值
D.合金中一定不含有非金属
8.黄金溶解在“王水”(浓盐酸与浓硝酸的混合液)中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是
A.“王水” 溶解黄金是物理变化
B.金比氢活泼
C.HAuCl4中,Au的化合价为+3价
D.“王水” 能用铁质容器盛装
9.一定条件下,能用NaOH溶液和红色石蕊试纸检验的离子是
A. B.K+ C. D.
10.下列实验中不发生化学变化的是
A.探究可燃物燃烧条件
B.探究铁生锈的条件
C.探究催化剂的作用
D.探究物质溶解性的影响因素
11.下列有关金属和合金的说法正确的是
A.铝制品具有良好耐腐蚀性是因为铝的化学性质不活泼
B.农业上常用的杀菌剂波尔多液不能用铁桶配制
C.将打磨后的银片放入硫酸铜溶液中,无明显现象,不能证明铜和银的活动性强弱
D.高炉炼铁时利用焦炭作还原剂冶炼金属铁
12.初中化学常见物质间的关系如图所示,“—”表示物质之间能发生反应,下表中与物质与图示关系相符的一组是
选项 甲 乙 丙
A O2 C CO2
B H2 O2 Fe
C Na2CO3 HCl Ba(OH)2
D BaC12 Na2CO3 Ca(NO3)2
A.A B.B C.C D.D
二、填空题
13.现有氢、氧、硫、铁四种元素,请选用其中两种或几种元素组成符合下列要求的物质,写出化学式各一个:
(1)酸_____
(2)碱_____
(3)金属氧化物_____
(4)盐_____.
14.化学与我们的生活和生产密切相关。请用下列物质的序号填空:
①氧气 ②氦气 ③不锈钢 ④硝酸钾⑤石墨
(1)用来填充飞艇的是______;
(2)能作铅笔芯的是______;
(3)可用于制作炊具的是______;
(4)维持人的生命活动所必需的物质是______ ;
(5)常用冷却热饱和溶液提纯的物质是______。
15.生产生活中很多领域涉及化学知识,请用适当的化学用语填空:
(1)氖气可充入霓虹灯中使用,保持氖气化学性质的最小粒子是____。
(2)用于游泳池消毒的硫酸铜含有的阴离子是_____。
(3)能用作食品干燥剂,能与水反应放热,俗称生石灰的物质是_____。
三、实验题
16.氢化钙固体常作为登山运动员的能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:
查阅资料:a.钙易与水反应生成碱和气体。b.无水氯化钙能作干燥剂。
①请写出E图中仪器①的名称___________。
②请按气流方向连接装置顺序D→__→___ →E→A (填装置编号)。写出C中可能发生的化学方程式:_____________。
③实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验的确有CaH2生成。另一位同学认为该同学的判断不准确,原因是_______。氢化钙作为能源提供剂,与直接用氢气相比,其优点是__________(答出任何一点即可)。
四、计算题
17.为测定某稀硫酸的溶质质量分数,小华取一定量碳酸钠放入烧杯中,称量烧杯及碳酸钠的总质量为121.2g,将150g稀硫酸分五次加入烧杯中,并称量每次反应后烧杯及烧杯内物质的总质量,数据如下表,请根据相关知识和数据回答下列问题:
实验次数 加入稀硫酸的质量/g 反应后烧杯及烧杯内物质的总质量/g
1 30 150.1
2 30 179
3 30 207.9
4 30 236.8
5 30 266.8
(1)碳酸钠的水溶液显___________(填“酸”、“碱”或“中”)性。
(2)反应完全后产生气体的质量为___________g。
(3)该稀硫酸的溶质质量分数是多少?(结果精确到0.1%)
18.用“侯氏制碱法”制得的纯碱常含有少量的氯化钠。为了测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3克,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示。求:(请写明解题过程)
(1)该纯碱样品中碳酸钠的质量。
(2)所加入氯化钙溶液的溶质质量分数。
试卷第4页,共5页
参考答案:
1.C
2.C
3.D
4.B
5.B
6.A
7.B
8.C
9.D
10.D
11.B
12.C
13.(1)H2SO4(合理即可)
(2)Fe(OH)3(合理即可)
(3)FeO(答案合理即可)
(4)FeSO4(答案合理即可)
14. ② ⑤ ③ ① ④
15.(1)Ne
(2)
(3)CaO
16. 铁架台 C B 钙与水反应也能生成碱,同时也有气泡冒出 便于携带;安全;通过反应,能将水中的氢元素部分转化为氢气
17.(1)碱
(2)4.4
(3)8.2%
解:设30g稀硫酸中硫酸质量为x
x=2.45g
稀硫酸溶质质量分数为: 。
答:稀硫酸溶质质量分数为8.2%。
18.(1)3.18(2)15%
