化学人教版(2019)选择性必修1 1.2.1盖斯定律(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2.1盖斯定律(共22张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-28 00:00:00 | ||
图片预览





文档简介
(共22张PPT)
第1课时 盖斯定律
第一章 化学反应的热效应
第二节 反应热的计算
一、导入新课
【问题引入】下列数据表示燃烧热吗?为什么?H2(g)+1/2 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
那么,H2的燃烧热ΔH究竟是多少?已知:H2O(g)=H2O(l) ΔH 2=-44 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(l) ΔH=ΔH 1+ΔH 2=-285.8 kJ·mol-1
如何测出这个反应的反应热:C(s)+1/2O2(g)=CO(g) ΔH=?
1836年,俄国化学家盖斯,提出了盖斯定律为我们解决了这个问题。
二、盖斯定律
盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
1.盖斯定律的内容
一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
二、盖斯定律
2.对盖斯定律的理解
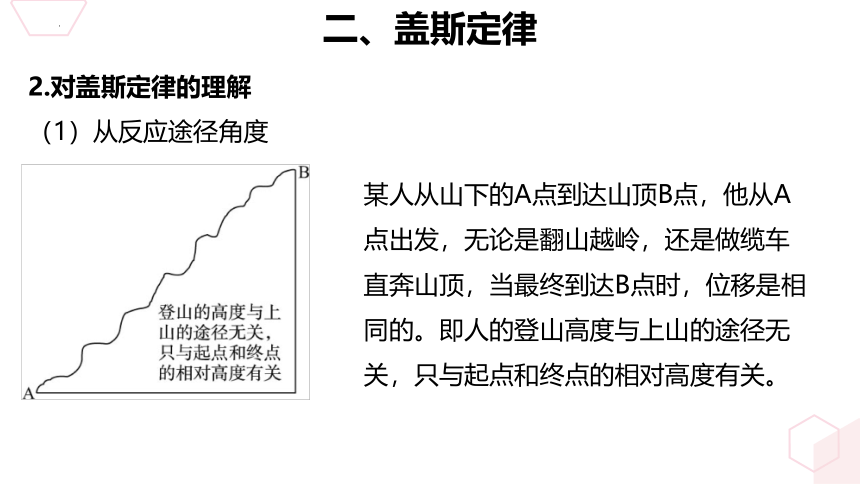
(1)从反应途径角度
某人从山下的A点到达山顶B点,他从A点出发,无论是翻山越岭,还是做缆车直奔山顶,当最终到达B点时,位移是相同的。即人的登山高度与上山的途径无关,只与起点和终点的相对高度有关。
二、盖斯定律
2.对盖斯定律的理解
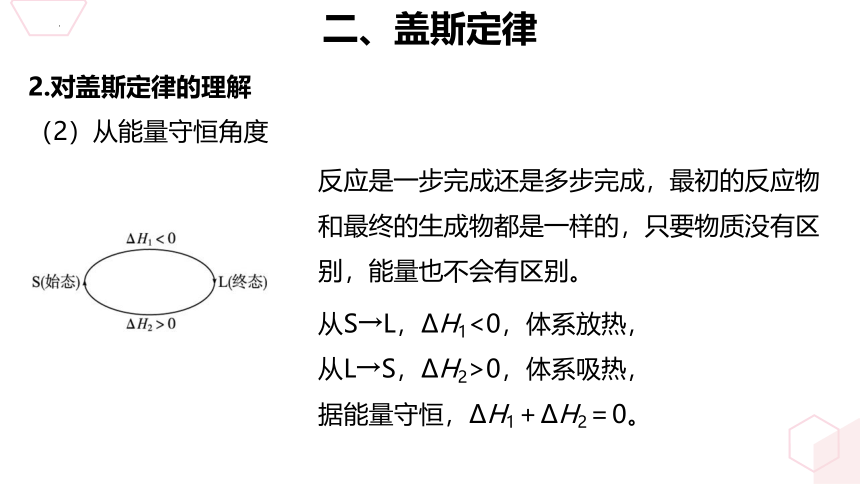
(2)从能量守恒角度
反应是一步完成还是多步完成,最初的反应物和最终的生成物都是一样的,只要物质没有区别,能量也不会有区别。
从S→L,ΔH1<0,体系放热,从L→S,ΔH2>0,体系吸热,据能量守恒,ΔH1+ΔH2=0。
二、盖斯定律
2.对盖斯定律的理解
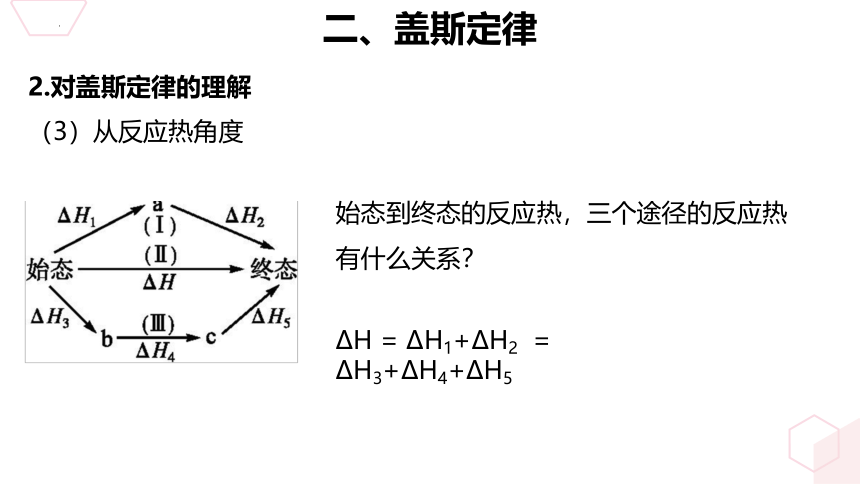
(3)从反应热角度
始态到终态的反应热,三个途径的反应热有什么关系?
ΔH = ΔH1+ΔH2 = ΔH3+ΔH4+ΔH5
二、盖斯定律
3.盖斯定律的应用
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
【交流讨论】
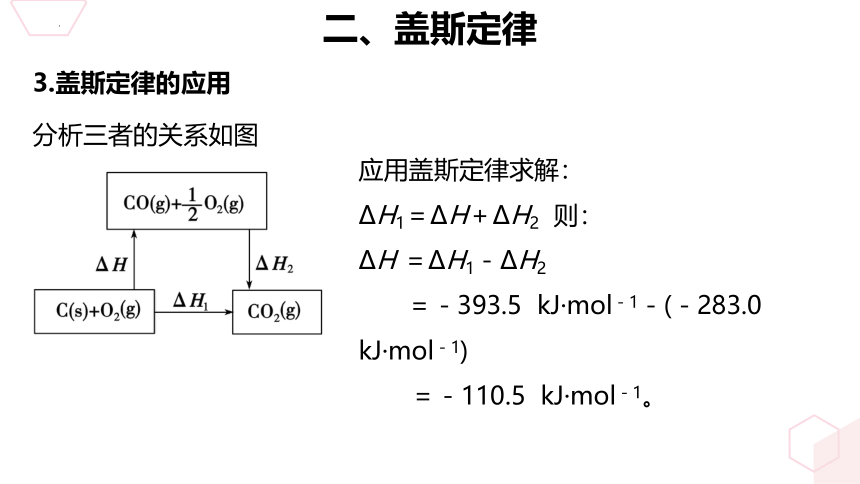
已知:(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1 (2)CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1 若C(s)+1/2O2(g)=CO(g)的反应热为ΔH,求ΔH。
二、盖斯定律
3.盖斯定律的应用
应用盖斯定律求解:
ΔH1=ΔH+ΔH2 则:
ΔH =ΔH1-ΔH2
=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)
=-110.5 kJ·mol-1。
分析三者的关系如图
二、盖斯定律
【例题讲解】
1.已知:①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH为( )A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
【解析】 根据盖斯定律,由题意知:①×1/2-②×1/2得:
ΔH=(-221.0 kJ·mol-1)×1/2-(-483.6 kJ·mol-1)×1/2=+131.3 kJ·mol-1。
三、例题讲解
D
【交流讨论】
热化学反应方程式加和的方法,目标方程式如何通过“四则运算式”导出?
目标方程式:C(s)+H2O(g)=CO(g)+H2(g),
可由①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1导出,
运算式为①×1/2-②×1/2
方法总结:写出目标方程式,确定“过渡物质”(要消去的物质),然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
三、例题讲解
【例题讲解】
三、例题讲解
2.按照盖斯定律,结合下述反应方程式回答问题,已知:①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ·mol-1②NH3(g)+H2O(l)=NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1③HCl(g)+H2O(l)=HCl(aq) ΔH3=-72.3 kJ·mol-1④NH3(aq)+HCl(aq)=NH4Cl(aq) ΔH4=-52.3 kJ·mol-1⑤NH4Cl(s)+2H2O(l)=NH4Cl(aq) ΔH5=?则第⑤个方程式中的反应热ΔH是__________。
【解析】根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,即ΔH5=ΔH4+ΔH3++ΔH2-ΔH1 =+16.3 kJ·mol-1
【例题讲解】
三、例题讲解
3.已知①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ·mol-1②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ·mol-1试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解析】①×2+②×4-③=④
ΔH=ΔH1×2+ΔH2×4-ΔH3=-283.2 kJ·mol-1×2-285.8 kJ·mol-1×4+1 370 kJ·mol-1=-339.6 kJ·mol-1
【例题讲解】
三、例题讲解
4.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。①4P(s,红)+5O2(g)=2P2O5(s) ΔH1 ②4P(s,白)+5O2(g)=2P2O5(s) ΔH2则ΔH1与ΔH2的关系正确的是( )A.ΔH1=ΔH2 B.ΔH1>ΔH2C.ΔH1<ΔH2 D.无法确定
【解析】由反应①减去反应②可得,4P(s,红)=4P(s,白)
ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2。
B
【总结】应用盖斯定律计算反应热时应注意的问题:
(1)首先要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
(2)不同途径对应的最终结果应一样。
(3)可以利用方程式加和法求反应热,当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
(4)将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
(5)在设计反应过程中,可能会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
四、课堂小结
四、课堂小结
五、课堂检测
1.已知热化学方程式:
C(金刚石,s)+O2(g)=CO2(g) ΔH1 C(石墨,s)+O2(g)=CO2(g) ΔH2
C(石墨,s)=C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应 B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2 D.ΔH1>ΔH2
【解析】将方程式依次编号①、②、③,可得③=②-①,即ΔH3=ΔH2-ΔH1=+1.9 kJ·mol-1>0得出石墨比金刚石稳定。
A
2.盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应进行的具体途径无关。物质A在一定条件下可发生一系列转化,由图示可判断下列关系错误的是( )
A.A→F,ΔH=-ΔH6B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|D.ΔH1+ΔH2+ΔH3=-ΔH4-ΔH5-ΔH6
B
【解析】6个步骤相加即回到原点,则ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,B项错误。
五、课堂检测
3.已知25℃、101 kPa条件下:①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1由此得出的正确结论是( )A.等质量的O2比O3能量低,由O2变O3为吸热反应B.反应①可确定铝的燃烧热是708.7 kJC.O3比O2稳定,由O2变O3为放热反应D.反应②可确定铝的燃烧热是779.78 kJ·mol-1
【解析】利用盖斯定律,将反应①-②得3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1,可知等质量的O2比O3能量低,物质的能量越低越稳定。
A
五、课堂检测
4.已知下列各反应的焓变①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) ΔH=-1206.8 kJ·mol-1②Ca(s)+1/2O2(g)=CaO(s) ΔH=-635.1 kJ·mol-1③C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1试求④CaCO3(s)=CaO(s)+CO2(g)的焓变。
【解析】④=②+③-①,ΔH=-635.1 kJ·mol-1-393.5 kJ·mol-1-(-1 206.8 kJ·mol-1)=+178.2 kJ·mol-1
五、课堂检测
5.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。根据图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式为
。(2)PCl5分解成PCl3和Cl2的热化学方程式为
。(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=
,P和Cl2一步反应生成
1 mol PCl5的ΔH4_____(填“>”“<”或“=”)ΔH3。
3/2Cl2(g)+P(s)=PCl3(g) ΔH=-306kJ/mol
PCl5(g)=PCl3(g)+Cl2(g) ΔH=+93kJ/mol
-399kJ/mol
=
【解析】根据盖斯定律求得:ΔH3=-399 kJ/mol。因焓变与反应的途径无关,只与反应物、生成物状态、量有关,故ΔH3=ΔH4。
五、课堂检测
再 见
单击此处添加副标题内容
第1课时 盖斯定律
第一章 化学反应的热效应
第二节 反应热的计算
一、导入新课
【问题引入】下列数据表示燃烧热吗?为什么?H2(g)+1/2 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
那么,H2的燃烧热ΔH究竟是多少?已知:H2O(g)=H2O(l) ΔH 2=-44 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(l) ΔH=ΔH 1+ΔH 2=-285.8 kJ·mol-1
如何测出这个反应的反应热:C(s)+1/2O2(g)=CO(g) ΔH=?
1836年,俄国化学家盖斯,提出了盖斯定律为我们解决了这个问题。
二、盖斯定律
盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
1.盖斯定律的内容
一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
二、盖斯定律
2.对盖斯定律的理解
(1)从反应途径角度
某人从山下的A点到达山顶B点,他从A点出发,无论是翻山越岭,还是做缆车直奔山顶,当最终到达B点时,位移是相同的。即人的登山高度与上山的途径无关,只与起点和终点的相对高度有关。
二、盖斯定律
2.对盖斯定律的理解
(2)从能量守恒角度
反应是一步完成还是多步完成,最初的反应物和最终的生成物都是一样的,只要物质没有区别,能量也不会有区别。
从S→L,ΔH1<0,体系放热,从L→S,ΔH2>0,体系吸热,据能量守恒,ΔH1+ΔH2=0。
二、盖斯定律
2.对盖斯定律的理解
(3)从反应热角度
始态到终态的反应热,三个途径的反应热有什么关系?
ΔH = ΔH1+ΔH2 = ΔH3+ΔH4+ΔH5
二、盖斯定律
3.盖斯定律的应用
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
【交流讨论】
已知:(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1 (2)CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1 若C(s)+1/2O2(g)=CO(g)的反应热为ΔH,求ΔH。
二、盖斯定律
3.盖斯定律的应用
应用盖斯定律求解:
ΔH1=ΔH+ΔH2 则:
ΔH =ΔH1-ΔH2
=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)
=-110.5 kJ·mol-1。
分析三者的关系如图
二、盖斯定律
【例题讲解】
1.已知:①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH为( )A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
【解析】 根据盖斯定律,由题意知:①×1/2-②×1/2得:
ΔH=(-221.0 kJ·mol-1)×1/2-(-483.6 kJ·mol-1)×1/2=+131.3 kJ·mol-1。
三、例题讲解
D
【交流讨论】
热化学反应方程式加和的方法,目标方程式如何通过“四则运算式”导出?
目标方程式:C(s)+H2O(g)=CO(g)+H2(g),
可由①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1导出,
运算式为①×1/2-②×1/2
方法总结:写出目标方程式,确定“过渡物质”(要消去的物质),然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
三、例题讲解
【例题讲解】
三、例题讲解
2.按照盖斯定律,结合下述反应方程式回答问题,已知:①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ·mol-1②NH3(g)+H2O(l)=NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1③HCl(g)+H2O(l)=HCl(aq) ΔH3=-72.3 kJ·mol-1④NH3(aq)+HCl(aq)=NH4Cl(aq) ΔH4=-52.3 kJ·mol-1⑤NH4Cl(s)+2H2O(l)=NH4Cl(aq) ΔH5=?则第⑤个方程式中的反应热ΔH是__________。
【解析】根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,即ΔH5=ΔH4+ΔH3++ΔH2-ΔH1 =+16.3 kJ·mol-1
【例题讲解】
三、例题讲解
3.已知①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ·mol-1②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ·mol-1试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解析】①×2+②×4-③=④
ΔH=ΔH1×2+ΔH2×4-ΔH3=-283.2 kJ·mol-1×2-285.8 kJ·mol-1×4+1 370 kJ·mol-1=-339.6 kJ·mol-1
【例题讲解】
三、例题讲解
4.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。①4P(s,红)+5O2(g)=2P2O5(s) ΔH1 ②4P(s,白)+5O2(g)=2P2O5(s) ΔH2则ΔH1与ΔH2的关系正确的是( )A.ΔH1=ΔH2 B.ΔH1>ΔH2C.ΔH1<ΔH2 D.无法确定
【解析】由反应①减去反应②可得,4P(s,红)=4P(s,白)
ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2。
B
【总结】应用盖斯定律计算反应热时应注意的问题:
(1)首先要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
(2)不同途径对应的最终结果应一样。
(3)可以利用方程式加和法求反应热,当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
(4)将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
(5)在设计反应过程中,可能会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
四、课堂小结
四、课堂小结
五、课堂检测
1.已知热化学方程式:
C(金刚石,s)+O2(g)=CO2(g) ΔH1 C(石墨,s)+O2(g)=CO2(g) ΔH2
C(石墨,s)=C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应 B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2 D.ΔH1>ΔH2
【解析】将方程式依次编号①、②、③,可得③=②-①,即ΔH3=ΔH2-ΔH1=+1.9 kJ·mol-1>0得出石墨比金刚石稳定。
A
2.盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应进行的具体途径无关。物质A在一定条件下可发生一系列转化,由图示可判断下列关系错误的是( )
A.A→F,ΔH=-ΔH6B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|D.ΔH1+ΔH2+ΔH3=-ΔH4-ΔH5-ΔH6
B
【解析】6个步骤相加即回到原点,则ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,B项错误。
五、课堂检测
3.已知25℃、101 kPa条件下:①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1由此得出的正确结论是( )A.等质量的O2比O3能量低,由O2变O3为吸热反应B.反应①可确定铝的燃烧热是708.7 kJC.O3比O2稳定,由O2变O3为放热反应D.反应②可确定铝的燃烧热是779.78 kJ·mol-1
【解析】利用盖斯定律,将反应①-②得3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1,可知等质量的O2比O3能量低,物质的能量越低越稳定。
A
五、课堂检测
4.已知下列各反应的焓变①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) ΔH=-1206.8 kJ·mol-1②Ca(s)+1/2O2(g)=CaO(s) ΔH=-635.1 kJ·mol-1③C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1试求④CaCO3(s)=CaO(s)+CO2(g)的焓变。
【解析】④=②+③-①,ΔH=-635.1 kJ·mol-1-393.5 kJ·mol-1-(-1 206.8 kJ·mol-1)=+178.2 kJ·mol-1
五、课堂检测
5.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。根据图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式为
。(2)PCl5分解成PCl3和Cl2的热化学方程式为
。(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=
,P和Cl2一步反应生成
1 mol PCl5的ΔH4_____(填“>”“<”或“=”)ΔH3。
3/2Cl2(g)+P(s)=PCl3(g) ΔH=-306kJ/mol
PCl5(g)=PCl3(g)+Cl2(g) ΔH=+93kJ/mol
-399kJ/mol
=
【解析】根据盖斯定律求得:ΔH3=-399 kJ/mol。因焓变与反应的途径无关,只与反应物、生成物状态、量有关,故ΔH3=ΔH4。
五、课堂检测
再 见
单击此处添加副标题内容
