共价键课件
图片预览







文档简介
课件80张PPT。第二章 分子结构与性质 第一节 复习回忆什么是化学键?
什么是离子键?
什么是共价键?化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的化学键。
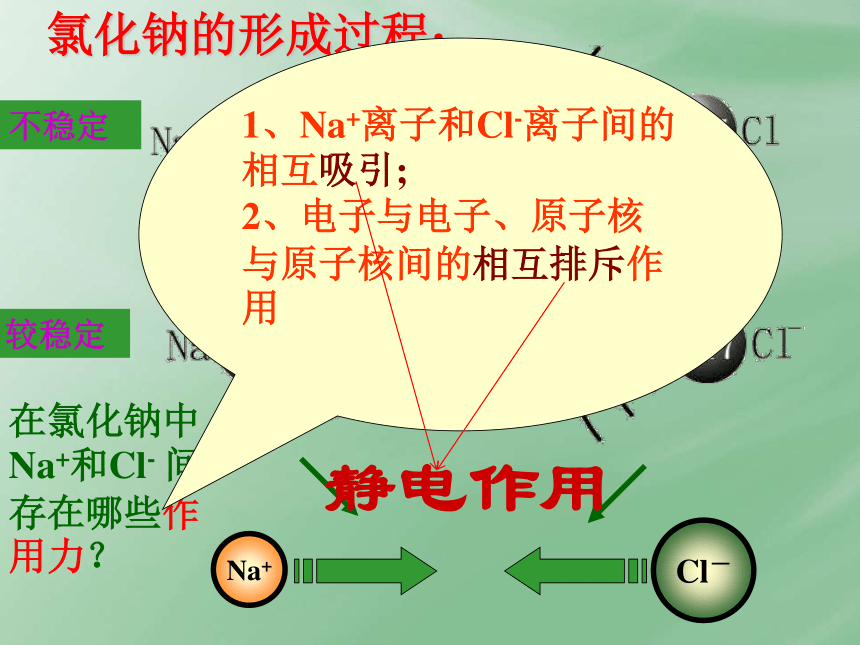
共价键:原子间通过共用电子对形成的化学键。一、回顾化学键Na+Cl-电子转移1氯化钠的形成过程:不稳定较稳定在氯化钠中Na+和Cl- 间存在哪些作用力?1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
静电作用(使阴、阳离子结合成化合物的静电作用。)1.成键微粒:Ⅰ、离子键:2.成键本质:
3.形成条件:(阴、阳离子)阴阳离子间的静电作用(静电吸引、静电排斥)活泼金属( ) 和活泼非金属( )易形成离子键 ⅠA 、ⅡAⅥA、ⅦA带相反电荷的离子 人们把带相反电荷的离子之间的相互作用称为离子键。<一>、定义:<二>、要点:(1)活泼金属元素和活泼非金属元素一定形成离子键吗?
(2)仅由非金属元素组成的物质中一定不含离子键吗?
(2)不一定,如NH4Cl全由非金属元素组成,但它是离子化合物。 【思考】 (1)不一定,如AlCl3中铝元素和氯元素形成共价键。思考 哪些物质中存在离子键呢?②、活泼的金属元素和酸根离子形成的盐
(如:NaNO3)③、铵根和酸根离子(或活泼非金属元素)形成的盐。
(如:NH4Cl , (NH4)2SO4 ) ①、活泼的金属元素 和活泼的非金属元素
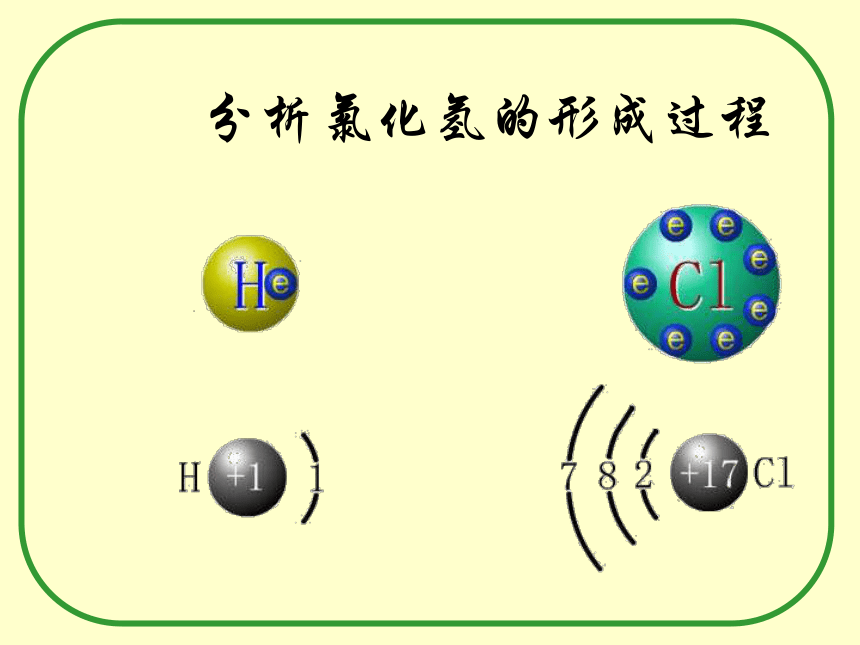
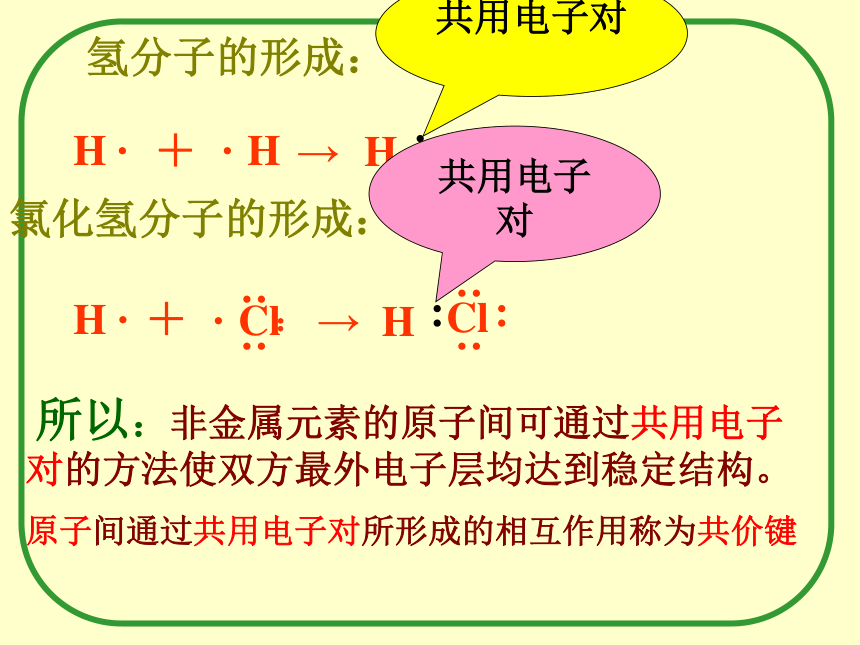
之间的化合物。(如:Na2O)④、强碱(IA、IIA)(VIA、VIIA)(如 NaOH)4、 存在:如:离子化合物。强碱、绝大多数盐、典型的活泼金属氧化物和金属过氧化物等。分析氯化氢的形成过程共价键氢分子的形成: H ·氯化氢分子的形成:· H+→H ·+→ 所以:非金属元素的原子间可通过共用电子对的方法使双方最外电子层均达到稳定结构。原子间通过共用电子对所形成的相互作用称为共价键共用电子对共用电子对4、存在:1.成键微粒:Ⅱ、共价键:
2.成键本质:
3.形成条件:共价化合物离子化合物非金属单质(稀有气体除外)(含有非金属元素组成的原子团)(一般由非金属元素组成)原子之间通过共用电子对所形成的相互作用原子原子间通过共用电子对形成的相互作用一般是非金属元素之间<一>、定义:<二>、要点: 共价键仅存在于共价化合物中吗?
【思考】
不是,共价键也可以存在于离子化合物中,如NaOH,NH4Cl中都含有共价键。 小 结:共价键与离子键的比较非金属元素间活泼金属与活泼非金属化合 原 子阴、阳离子形成共用电子对静电作用同种元素原子不同种元素原子相同不相同不偏向任何一个原子偏向吸引电子能力强的原子 a=b,
共用电子对无偏向 a> b,
共用电子对偏向Cl不显电性相对显正电性相对显负电性同种元素原子不同种元素原子相同不相同不偏向任何一个原子偏向吸引电子能力强的原子不显电性显电性键无极性键有极性H ·· H+→ 由同种元素原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,成键原子不显电性,这样的共价键叫做非极性共价键.简称非极性键5 、共价键的种类:<1>.非极性键如: 不同种元素原子形成共价键时,原子吸引电子的能力不同。共用电子对将偏向吸引电子能力强的一方.像这样共用电子对偏移的共价键叫做极性共价键,简称极性键.<2>.极性键如:
A.特点:非极性键:极性键:B.规律: 非极性键:极性键:共用电子对不发生偏移共用电子对偏向吸引电子能力强的一方同中元素原子间的共价键是非极性键不同中元素原子间的共价键是极性键判断方法同种非金属元素原子间形成的共价键是非极性键不同种非金属元素原子间形成的共价键是极性键(考点) 在元素符号周围用小黑点.(或×)来
表示原子的最外层电子的式子。 书写要点1、原子的电子式: 电子式中最外层电子要尽可能均匀对称的分布在上、下、左、右四方注意:Ⅲ 、电子式(考点)①阴离子的电子式2、离子的电子式:②阳离子的电子式即离子符号如NH4+:使每一个原子达到稳定结构要注明最外层电子数及电荷数 H+书写要点书写要点画出最外层电子数,加“[ ]”括号内应达稳定结构,右上角标出所带电荷。3、离子化合物的电子式:
由阳离子的电子式和阴离子的电子式组合而成.注意:相同的离子不能写在一起,一般对称
排列. 如:×书写要点4、用电子式表示离子化合物的形成过程 左侧写原子的电子式,右侧写离子化合物的电子式,中间用 连接.注意:用弧形箭头表示电子转移的方向.
书写要点原子电子式通过共用电子对的组合注意:相同的原子不能写在一起,一般 对称排列.5 、共价化合物电子式 书写要点例:6 、用电子式表示共价化合物的形成过程左侧写原子的电子式右侧写共价化合物的电子式→用电子式表示硫化氢的形成过程:
书写要点注意事项:相同原子不能合并在一起;
练习:下列物质中,
1.含离子键的物质是(??? );
2.含非极性共价键的物质是(??? );
3.含极性共价键的物质是( )。
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4
H、CCl4 I、 Br2 J、 PH3 A、F、K、LB、E、G、H、J、KC、D、I、L、M【课堂练习】M、H2O2L、Na2O2 K、KOH下列关于化学键的说法,正确的是 ( )
A、由金属元素与非金属元素构成的一定是离子键
B、由非金属元素组成的化合物一定是共价化合物
C、含有金属元素的化合物中一定有离子键
D、由两种非金属元素形成的化合物一定是共价化合物
练习D下列叙述正确的是( )
A.含有共价键的化合物一定是共价化合物
B.由共价键构成的化合物一定是共价化合物
C.在共价化合物中一定存在共价键
D.离子化合物中只含有离子键
E. 仅含有共价键的物质一定属于共价化合物
F 任何物质中都有化学键C练习1.写出下列物质的电子式CO2 、MgCl2 、 O2、 N2 、NH4Cl 、 CCl4
Na2O2 、 NaOH
2.用电子式表示下列物质的形成过程H2 H2O Cl2 K2S 有没有可能存在 H3 、Cl3 、
H2Cl分子?为什么?
不可能,共价键具有饱和性。?学与问1、共价键具有饱和性 按照价键理论的电子配对原理,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就共价键的“饱和性”。跟踪练习.
分别写出下列非金属元素的原子电子配对成键数目 H 、ⅤA 、ⅥA 、ⅦA 。(一)、共价键的特征——共价键具有饱和性决定了共价化合物的分子组成二、共价键1、共价键具有饱和性(一)、共价键的特征二、共价键2、共价键具有方向性 两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,且原子轨道重叠越多,则电子在两核间出现的概率越大,形成的共价键越牢固。——共价键具有方向性决定了分子的空间构型(二)、共价键的分类二、共价键1、按共用电子对是否发生偏移极性共价键和非极性共价键2、按原子轨道的重叠方式 我们在第一章中学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云是如何重叠的呢?
N2分子中三条键的成键方式分别是什么?科学探究1个p-pσ键和2个p-pπ键N2中1个p-pσ键和2个p-pπ键的形成过程科学探究1、H2分子的形成过程HH用电子云来描述共价键的形成过程(s-sσ键) 特征:以形成化学键的两原子核的连线做为轴
旋转操作,共价键电子云的图形不变,称为轴对称。
电子云重叠H—H共价键氢原子形成氢分子的电子云描述(1). s-s σ键的形成2、HCl分子的形成过程 3、Cl2分子的形成过程 (s-p σ键)(p-p σ键)
(2). s-p σ键的形成(3)、p-p σ键的形成2、重叠方式:σ键小结 1、种类:3、特征 : "头碰头"轴对称4、π键形成过程 特征:电子云由两块组成,分别位于由两原子核构成的平面两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征为镜面对称。
“肩并肩”(p-pπ键)2.π键的形成(1)、σ键、 π键概念σ键:π键: 形成共价键的未成对电子的原子轨道采取头碰头方式重叠。 形成共价键的未成对电子的原子轨道采取肩并肩方式重叠。(2)、σ键、 π键的判断规律 s电子和s电子、s电子和p电子只能形成σ键;
p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。① σ键、 π键的成键规律(2)、σ键、 π键的判断规律共价单键是σ键;
共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键。② σ键、 π键的判断规律(考点) 头碰头肩并肩轴对称,可旋转镜面对称,不可旋转σ键强度大,
不易断裂,不活泼。π键强度较小,
容易断裂,活泼。共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键较大较小(3)、 σ键和π键的比较(二)、共价键的分类二、共价键1、按共用电子对是否发生偏移极性共价键和非极性共价键2、按原子轨道的重叠方式头碰头肩并肩轴对称镜面对称S-S σ键S-P σ键P-P σ键P-P π键2、乙烷、乙烯、乙炔分子中的共价键分别是由几个σ键和几个π键组成。
乙烷: 个σ键乙烯: 个σ键 个π键乙炔: 个σ键 个π键75132科学探究练习3.在氟气分子中,形成共价键的原子轨道是 ( )
A、氟原子的2p轨道和氟原子的1s轨道
B、氟原子的3p轨道和氟原子的1s轨道
C、氟原子的2p轨道和氟原子的2p轨道
D、氟原子的3p轨道和氟原子的3p轨道 C4、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. CO B. CH4
C. CO2 D. C2H4课堂练习ACD5.σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2课堂练习s-ps-pp-ps-s6、下列说法中正确的是
A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头碰头”重叠可形成π键
C、s和p轨道以“头碰头”重叠可形成σ键
D、共价键是两个原子轨道以“头碰头”重叠
形成的C课堂反馈7.下列物质分子中无π键的是
A.N2 B.O2 C.Cl2 D.C2H4C课堂反馈 乙烯分子与溴发生加成反应时,断裂哪种类型的键?为什么?738、课堂反馈中学常见共价型分子的、分子式、电子式结构式等分析考点中学常见共价型分子的、分子式、电子式结构式等分析考点三、键参数(一)、键能1、概念: 气态基态原子形成1mol共价键释放的最低能量(或拆开1mol共价键所吸收的能量)。例如:H-H 键的键能为436.0kJ.mol-1。2、意义:1、概念:衡量共价键的稳定性。三、键参数(一)、键能3、应用:① 判断共价键的强弱。② 判断分子的稳定性。共价键键能越大,共价键越强,越稳定。 对结构相似的分子,共价键键能越大,共价键越强,分子越稳定。三、键参数(一)、键能3、应用:② 判断分子的稳定性。典例:Ⅰ、 已知键能HF>HCl > HBr > HI
判断分子的稳定性。Ⅱ、 N2与Cl2稳定性比较。原因:N2分子中 的键能比Cl2
分子中Cl-Cl的键能大,破坏它消耗能量多,故N2分子比Cl2 稳定。(考点)三、键参数(一)、键能3、应用: 一般来说,非金属性越强,对应单质的活性越强。如: 非金属性F>Cl>Br,
则对应单质的活性F2>Cl2 > Br2,
三、键参数(一)、键能3、应用:③ 判断分子的活性的大小。 特殊情况:考点键能越大,结构越稳定,越不易被破坏,活性越小。如: 非金属性N>P,
而对应单质的活性N2 < P,
稳定性N2>P 。为什么原因: N2分子中 的键能较大,破坏它消耗能量多,故N2分子较稳定。三、键参数(一)、键能3、应用:④ 判断热效应。② 判断分子的稳定性。① 判断共价键的强弱。三、键参数(二)、键长1、概念:形成共价键的两个原子之间的核间的平衡距离。2、意义:衡量共价键的稳定性。3、应用:① 决定共价键键长的因素:半径② 判断共价键的稳定性。半径越小,键长越短。键长越短,键能越大,共价键越强,分子越稳定。三、键参数(三)、键角1、概念:多原子分子中,两共价键之间的夹角叫做键角2、意义:①决定了分子的空间构形
②表明共价键的方向性三、键参数(三)、键角3、应用:常见分子的键角CO2 ______ H2O ______ NH3 ______ CH4 ______ P4 ______ BF3 ______ 中学常见共价型分子的、分子式、电子式结构式等分析考点中学常见共价型分子的、分子式、电子式结构式等分析考点小结:键能、键长、键角是共价键 的三个参数
键能、键长决定了共价键的稳定性;键角、键长决定了分子的空间构型。 练习:
1、下列说法正确的是( )
A、分子中键能越大,键越长,则分子越稳定。
B、只有非金属原子之间才能形成共价键。
C、水分子可以表示为H-O-H,分子中键角180°。
D、H-O键键能463 KJ/ mol ,故破坏18克水分子中的H-O键时需要吸收的能量为2X463 KJ。
D2、能用键能大小解释的是 ( )
A、N 2的化学性质比O2稳定。
B、硝酸易挥发,硫酸难挥发。
C、惰性气体一般难发生化学反应。
D、通常情况下,Br2呈液态,I2呈固态。A四、等电子原理 1、等电子原理 : 原子总数相同、价电子总数相同的分子或离子具有相似的化学键特征和相近的物理性质,而化学性质不同。此原理称为等电子原理结构相似2、等电子体:
原子总数相同、价电子总数相同的分子或离子互为等电子体。如:四、等电子原理 1、等电子原理 :2、等电子体:
如:强调 : 等电子体的价电子总数相同,但组成原子的核外电子总数不一定相同。④ 写等电子体的电子式或结构式。② 判断一些分子或离子的共价键类型。① 利用等电子原理判断物理性质。四、等电子原理 1、等电子原理 :2、等电子体:
3、等电子原理的应用 :考点 ③ 判断一些分子或离子的空间构型。
①二原子10电子的等电子体:
N2、CO、CN-、C22- O22+
②二原子11电子的等电子体:
NO、 O2+
③三原子16电子等电子体:
CO2、CS2、N2O、CNO-、N3- 、SCN-
④三原子18电子的等电子体:
NO2-、O3、SO2
⑤四原子24电子的等电子体:
NO3-、CO32-、BF3、SO3(g)4、中学常见的等电子体:
思考探究:
在N2、CO2、 CO 、N2O之间互为等电子体的是谁?
请预测:1、 N2O的几何构型?
2、 CO 中的共价键类型?
1.1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3A2、(1)根据等电子原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:______________和______________;______________和______________。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______________。答案: (1)N2 CO CO2 N2O
(2)SO2、O3再见!
什么是离子键?
什么是共价键?化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的化学键。
共价键:原子间通过共用电子对形成的化学键。一、回顾化学键Na+Cl-电子转移1氯化钠的形成过程:不稳定较稳定在氯化钠中Na+和Cl- 间存在哪些作用力?1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
静电作用(使阴、阳离子结合成化合物的静电作用。)1.成键微粒:Ⅰ、离子键:2.成键本质:
3.形成条件:(阴、阳离子)阴阳离子间的静电作用(静电吸引、静电排斥)活泼金属( ) 和活泼非金属( )易形成离子键 ⅠA 、ⅡAⅥA、ⅦA带相反电荷的离子 人们把带相反电荷的离子之间的相互作用称为离子键。<一>、定义:<二>、要点:(1)活泼金属元素和活泼非金属元素一定形成离子键吗?
(2)仅由非金属元素组成的物质中一定不含离子键吗?
(2)不一定,如NH4Cl全由非金属元素组成,但它是离子化合物。 【思考】 (1)不一定,如AlCl3中铝元素和氯元素形成共价键。思考 哪些物质中存在离子键呢?②、活泼的金属元素和酸根离子形成的盐
(如:NaNO3)③、铵根和酸根离子(或活泼非金属元素)形成的盐。
(如:NH4Cl , (NH4)2SO4 ) ①、活泼的金属元素 和活泼的非金属元素
之间的化合物。(如:Na2O)④、强碱(IA、IIA)(VIA、VIIA)(如 NaOH)4、 存在:如:离子化合物。强碱、绝大多数盐、典型的活泼金属氧化物和金属过氧化物等。分析氯化氢的形成过程共价键氢分子的形成: H ·氯化氢分子的形成:· H+→H ·+→ 所以:非金属元素的原子间可通过共用电子对的方法使双方最外电子层均达到稳定结构。原子间通过共用电子对所形成的相互作用称为共价键共用电子对共用电子对4、存在:1.成键微粒:Ⅱ、共价键:
2.成键本质:
3.形成条件:共价化合物离子化合物非金属单质(稀有气体除外)(含有非金属元素组成的原子团)(一般由非金属元素组成)原子之间通过共用电子对所形成的相互作用原子原子间通过共用电子对形成的相互作用一般是非金属元素之间<一>、定义:<二>、要点: 共价键仅存在于共价化合物中吗?
【思考】
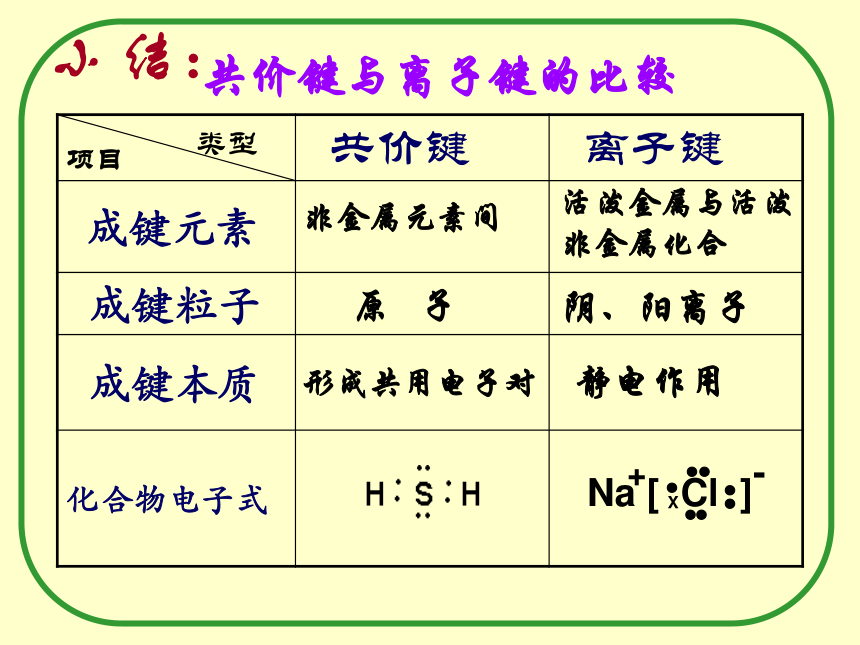
不是,共价键也可以存在于离子化合物中,如NaOH,NH4Cl中都含有共价键。 小 结:共价键与离子键的比较非金属元素间活泼金属与活泼非金属化合 原 子阴、阳离子形成共用电子对静电作用同种元素原子不同种元素原子相同不相同不偏向任何一个原子偏向吸引电子能力强的原子 a=b,
共用电子对无偏向 a> b,
共用电子对偏向Cl不显电性相对显正电性相对显负电性同种元素原子不同种元素原子相同不相同不偏向任何一个原子偏向吸引电子能力强的原子不显电性显电性键无极性键有极性H ·· H+→ 由同种元素原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,成键原子不显电性,这样的共价键叫做非极性共价键.简称非极性键5 、共价键的种类:<1>.非极性键如: 不同种元素原子形成共价键时,原子吸引电子的能力不同。共用电子对将偏向吸引电子能力强的一方.像这样共用电子对偏移的共价键叫做极性共价键,简称极性键.<2>.极性键如:
A.特点:非极性键:极性键:B.规律: 非极性键:极性键:共用电子对不发生偏移共用电子对偏向吸引电子能力强的一方同中元素原子间的共价键是非极性键不同中元素原子间的共价键是极性键判断方法同种非金属元素原子间形成的共价键是非极性键不同种非金属元素原子间形成的共价键是极性键(考点) 在元素符号周围用小黑点.(或×)来
表示原子的最外层电子的式子。 书写要点1、原子的电子式: 电子式中最外层电子要尽可能均匀对称的分布在上、下、左、右四方注意:Ⅲ 、电子式(考点)①阴离子的电子式2、离子的电子式:②阳离子的电子式即离子符号如NH4+:使每一个原子达到稳定结构要注明最外层电子数及电荷数 H+书写要点书写要点画出最外层电子数,加“[ ]”括号内应达稳定结构,右上角标出所带电荷。3、离子化合物的电子式:
由阳离子的电子式和阴离子的电子式组合而成.注意:相同的离子不能写在一起,一般对称
排列. 如:×书写要点4、用电子式表示离子化合物的形成过程 左侧写原子的电子式,右侧写离子化合物的电子式,中间用 连接.注意:用弧形箭头表示电子转移的方向.
书写要点原子电子式通过共用电子对的组合注意:相同的原子不能写在一起,一般 对称排列.5 、共价化合物电子式 书写要点例:6 、用电子式表示共价化合物的形成过程左侧写原子的电子式右侧写共价化合物的电子式→用电子式表示硫化氢的形成过程:
书写要点注意事项:相同原子不能合并在一起;
练习:下列物质中,
1.含离子键的物质是(??? );
2.含非极性共价键的物质是(??? );
3.含极性共价键的物质是( )。
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4
H、CCl4 I、 Br2 J、 PH3 A、F、K、LB、E、G、H、J、KC、D、I、L、M【课堂练习】M、H2O2L、Na2O2 K、KOH下列关于化学键的说法,正确的是 ( )
A、由金属元素与非金属元素构成的一定是离子键
B、由非金属元素组成的化合物一定是共价化合物
C、含有金属元素的化合物中一定有离子键
D、由两种非金属元素形成的化合物一定是共价化合物
练习D下列叙述正确的是( )
A.含有共价键的化合物一定是共价化合物
B.由共价键构成的化合物一定是共价化合物
C.在共价化合物中一定存在共价键
D.离子化合物中只含有离子键
E. 仅含有共价键的物质一定属于共价化合物
F 任何物质中都有化学键C练习1.写出下列物质的电子式CO2 、MgCl2 、 O2、 N2 、NH4Cl 、 CCl4
Na2O2 、 NaOH
2.用电子式表示下列物质的形成过程H2 H2O Cl2 K2S 有没有可能存在 H3 、Cl3 、
H2Cl分子?为什么?
不可能,共价键具有饱和性。?学与问1、共价键具有饱和性 按照价键理论的电子配对原理,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就共价键的“饱和性”。跟踪练习.
分别写出下列非金属元素的原子电子配对成键数目 H 、ⅤA 、ⅥA 、ⅦA 。(一)、共价键的特征——共价键具有饱和性决定了共价化合物的分子组成二、共价键1、共价键具有饱和性(一)、共价键的特征二、共价键2、共价键具有方向性 两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,且原子轨道重叠越多,则电子在两核间出现的概率越大,形成的共价键越牢固。——共价键具有方向性决定了分子的空间构型(二)、共价键的分类二、共价键1、按共用电子对是否发生偏移极性共价键和非极性共价键2、按原子轨道的重叠方式 我们在第一章中学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云是如何重叠的呢?
N2分子中三条键的成键方式分别是什么?科学探究1个p-pσ键和2个p-pπ键N2中1个p-pσ键和2个p-pπ键的形成过程科学探究1、H2分子的形成过程HH用电子云来描述共价键的形成过程(s-sσ键) 特征:以形成化学键的两原子核的连线做为轴
旋转操作,共价键电子云的图形不变,称为轴对称。
电子云重叠H—H共价键氢原子形成氢分子的电子云描述(1). s-s σ键的形成2、HCl分子的形成过程 3、Cl2分子的形成过程 (s-p σ键)(p-p σ键)
(2). s-p σ键的形成(3)、p-p σ键的形成2、重叠方式:σ键小结 1、种类:3、特征 : "头碰头"轴对称4、π键形成过程 特征:电子云由两块组成,分别位于由两原子核构成的平面两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征为镜面对称。
“肩并肩”(p-pπ键)2.π键的形成(1)、σ键、 π键概念σ键:π键: 形成共价键的未成对电子的原子轨道采取头碰头方式重叠。 形成共价键的未成对电子的原子轨道采取肩并肩方式重叠。(2)、σ键、 π键的判断规律 s电子和s电子、s电子和p电子只能形成σ键;
p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。① σ键、 π键的成键规律(2)、σ键、 π键的判断规律共价单键是σ键;
共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键。② σ键、 π键的判断规律(考点) 头碰头肩并肩轴对称,可旋转镜面对称,不可旋转σ键强度大,
不易断裂,不活泼。π键强度较小,
容易断裂,活泼。共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键较大较小(3)、 σ键和π键的比较(二)、共价键的分类二、共价键1、按共用电子对是否发生偏移极性共价键和非极性共价键2、按原子轨道的重叠方式头碰头肩并肩轴对称镜面对称S-S σ键S-P σ键P-P σ键P-P π键2、乙烷、乙烯、乙炔分子中的共价键分别是由几个σ键和几个π键组成。
乙烷: 个σ键乙烯: 个σ键 个π键乙炔: 个σ键 个π键75132科学探究练习3.在氟气分子中,形成共价键的原子轨道是 ( )
A、氟原子的2p轨道和氟原子的1s轨道
B、氟原子的3p轨道和氟原子的1s轨道
C、氟原子的2p轨道和氟原子的2p轨道
D、氟原子的3p轨道和氟原子的3p轨道 C4、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. CO B. CH4
C. CO2 D. C2H4课堂练习ACD5.σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2课堂练习s-ps-pp-ps-s6、下列说法中正确的是
A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头碰头”重叠可形成π键
C、s和p轨道以“头碰头”重叠可形成σ键
D、共价键是两个原子轨道以“头碰头”重叠
形成的C课堂反馈7.下列物质分子中无π键的是
A.N2 B.O2 C.Cl2 D.C2H4C课堂反馈 乙烯分子与溴发生加成反应时,断裂哪种类型的键?为什么?738、课堂反馈中学常见共价型分子的、分子式、电子式结构式等分析考点中学常见共价型分子的、分子式、电子式结构式等分析考点三、键参数(一)、键能1、概念: 气态基态原子形成1mol共价键释放的最低能量(或拆开1mol共价键所吸收的能量)。例如:H-H 键的键能为436.0kJ.mol-1。2、意义:1、概念:衡量共价键的稳定性。三、键参数(一)、键能3、应用:① 判断共价键的强弱。② 判断分子的稳定性。共价键键能越大,共价键越强,越稳定。 对结构相似的分子,共价键键能越大,共价键越强,分子越稳定。三、键参数(一)、键能3、应用:② 判断分子的稳定性。典例:Ⅰ、 已知键能HF>HCl > HBr > HI
判断分子的稳定性。Ⅱ、 N2与Cl2稳定性比较。原因:N2分子中 的键能比Cl2
分子中Cl-Cl的键能大,破坏它消耗能量多,故N2分子比Cl2 稳定。(考点)三、键参数(一)、键能3、应用: 一般来说,非金属性越强,对应单质的活性越强。如: 非金属性F>Cl>Br,
则对应单质的活性F2>Cl2 > Br2,
三、键参数(一)、键能3、应用:③ 判断分子的活性的大小。 特殊情况:考点键能越大,结构越稳定,越不易被破坏,活性越小。如: 非金属性N>P,
而对应单质的活性N2 < P,
稳定性N2>P 。为什么原因: N2分子中 的键能较大,破坏它消耗能量多,故N2分子较稳定。三、键参数(一)、键能3、应用:④ 判断热效应。② 判断分子的稳定性。① 判断共价键的强弱。三、键参数(二)、键长1、概念:形成共价键的两个原子之间的核间的平衡距离。2、意义:衡量共价键的稳定性。3、应用:① 决定共价键键长的因素:半径② 判断共价键的稳定性。半径越小,键长越短。键长越短,键能越大,共价键越强,分子越稳定。三、键参数(三)、键角1、概念:多原子分子中,两共价键之间的夹角叫做键角2、意义:①决定了分子的空间构形
②表明共价键的方向性三、键参数(三)、键角3、应用:常见分子的键角CO2 ______ H2O ______ NH3 ______ CH4 ______ P4 ______ BF3 ______ 中学常见共价型分子的、分子式、电子式结构式等分析考点中学常见共价型分子的、分子式、电子式结构式等分析考点小结:键能、键长、键角是共价键 的三个参数
键能、键长决定了共价键的稳定性;键角、键长决定了分子的空间构型。 练习:
1、下列说法正确的是( )
A、分子中键能越大,键越长,则分子越稳定。
B、只有非金属原子之间才能形成共价键。
C、水分子可以表示为H-O-H,分子中键角180°。
D、H-O键键能463 KJ/ mol ,故破坏18克水分子中的H-O键时需要吸收的能量为2X463 KJ。
D2、能用键能大小解释的是 ( )
A、N 2的化学性质比O2稳定。
B、硝酸易挥发,硫酸难挥发。
C、惰性气体一般难发生化学反应。
D、通常情况下,Br2呈液态,I2呈固态。A四、等电子原理 1、等电子原理 : 原子总数相同、价电子总数相同的分子或离子具有相似的化学键特征和相近的物理性质,而化学性质不同。此原理称为等电子原理结构相似2、等电子体:
原子总数相同、价电子总数相同的分子或离子互为等电子体。如:四、等电子原理 1、等电子原理 :2、等电子体:
如:强调 : 等电子体的价电子总数相同,但组成原子的核外电子总数不一定相同。④ 写等电子体的电子式或结构式。② 判断一些分子或离子的共价键类型。① 利用等电子原理判断物理性质。四、等电子原理 1、等电子原理 :2、等电子体:
3、等电子原理的应用 :考点 ③ 判断一些分子或离子的空间构型。
①二原子10电子的等电子体:
N2、CO、CN-、C22- O22+
②二原子11电子的等电子体:
NO、 O2+
③三原子16电子等电子体:
CO2、CS2、N2O、CNO-、N3- 、SCN-
④三原子18电子的等电子体:
NO2-、O3、SO2
⑤四原子24电子的等电子体:
NO3-、CO32-、BF3、SO3(g)4、中学常见的等电子体:
思考探究:
在N2、CO2、 CO 、N2O之间互为等电子体的是谁?
请预测:1、 N2O的几何构型?
2、 CO 中的共价键类型?
1.1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3A2、(1)根据等电子原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:______________和______________;______________和______________。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______________。答案: (1)N2 CO CO2 N2O
(2)SO2、O3再见!
