云南省保山一中高中化学必修一教学课件:第三章 金属及其化合物(共107张PPT)
文档属性
| 名称 | 云南省保山一中高中化学必修一教学课件:第三章 金属及其化合物(共107张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-08-28 00:00:00 | ||
图片预览





文档简介
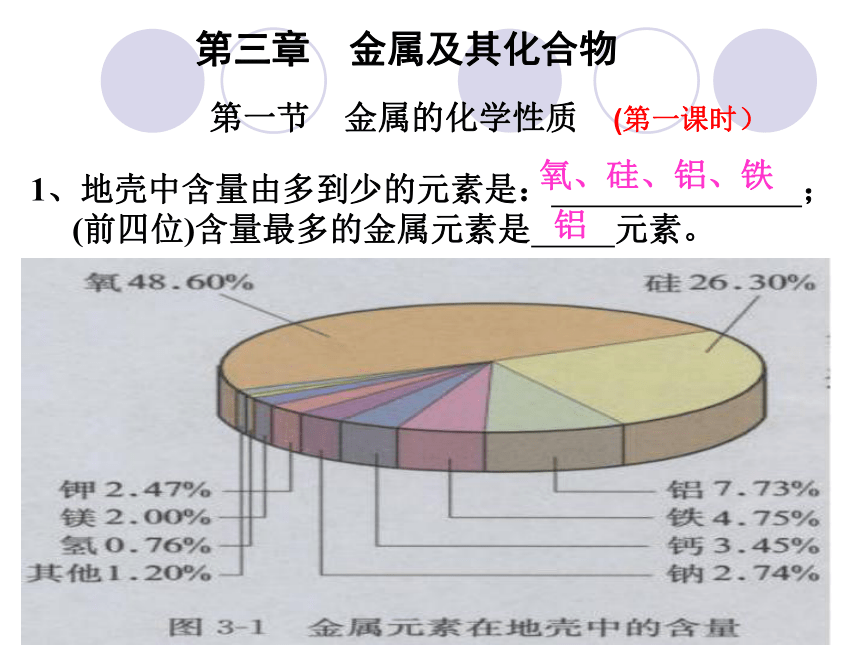
课件107张PPT。保山一中 朱智荣1、地壳中含量由多到少的元素是: ;
(前四位)含量最多的金属元素是 元素。氧、硅、铝、铁铝第三章 金属及其化合物第一节 金属的化学性质 (第一课时)保山一中 朱智荣2物
理
性
质有金属光泽、有导电性、有导热性、延展性 大多数是固体、2、金属有哪些共同的物理性质和化学性质?排在H前面的金属能置换出酸里的氢与盐: Fe+CuSO4==FeSO4+Cu排在前面的金属能把排在后面的金属从其盐溶液中置换出来化
学
性
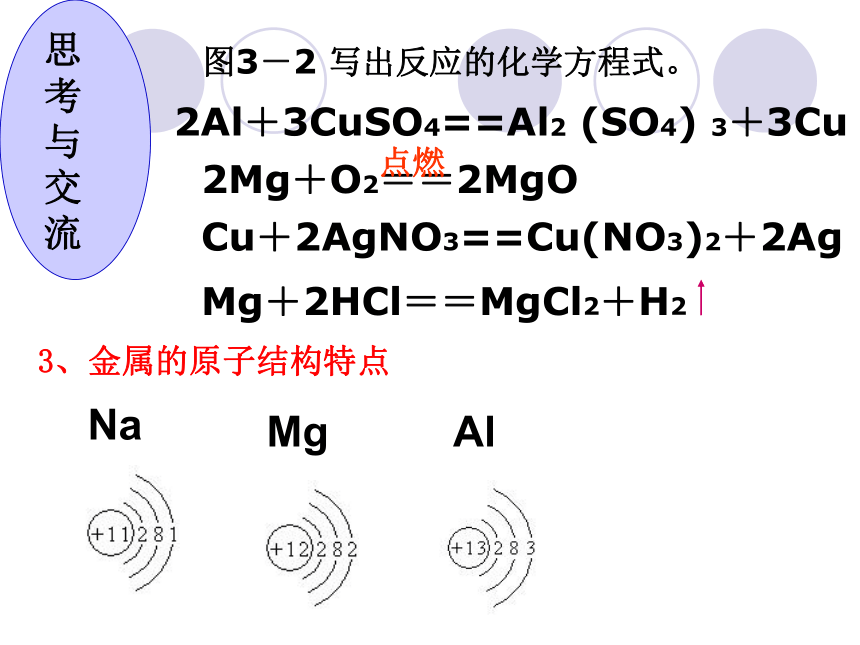
质保山一中 朱智荣图3-2 写出反应的化学方程式。2Al+3CuSO4==Al2 (SO4) 3+3Cu 2Mg+O2==2MgO 点燃 Cu+2AgNO3==Cu(NO3)2+2Ag3、金属的原子结构特点NaMgAl 思
考
与
交
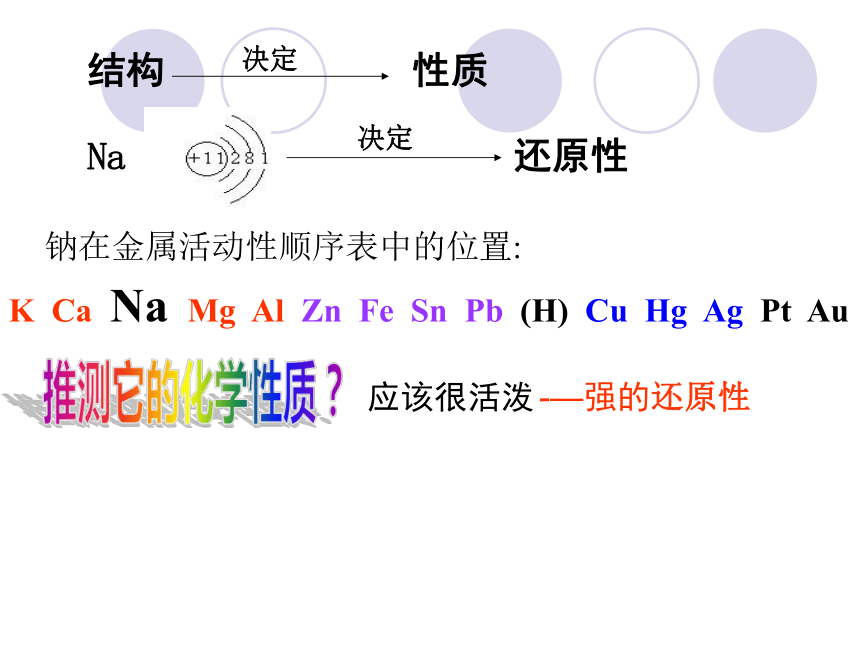
流 保山一中 朱智荣结构Na钠在金属活动性顺序表中的位置:推测它的化学性质?应该很活泼-—强的还原性K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 保山一中 朱智荣取一小块金属钠,用滤纸
吸干表面的煤油,用小刀
切去一端的表层,观察表
面的颜色;将其放置在空
气中,观察表面颜色的变化。实验探究 1反应: 4Na + O2= 2Na2O (白色固体)现象:钠的新切面由光亮的银白色渐渐变暗保山一中 朱智荣将一小块金属钠放在坩埚里,用酒精灯对其加热,观察实验现象.实验探究2反应: 2Na+O2 === Na2O2 (淡黄色)现象: 钠在空气中受热后,先熔化成闪亮 的小球后
剧烈燃烧产生黄色火焰,生成淡黄色固体.过氧化钠保山一中 朱智荣 2Na + O2 == Na2O2 (淡黄色固体)1.钠与非金属反应常温下加热(2) 钠与氯气反应(1) 钠与氧气反应+1 -2+1 -1 保山一中 朱智荣 向一只盛有水的烧杯中滴加几滴酚酞
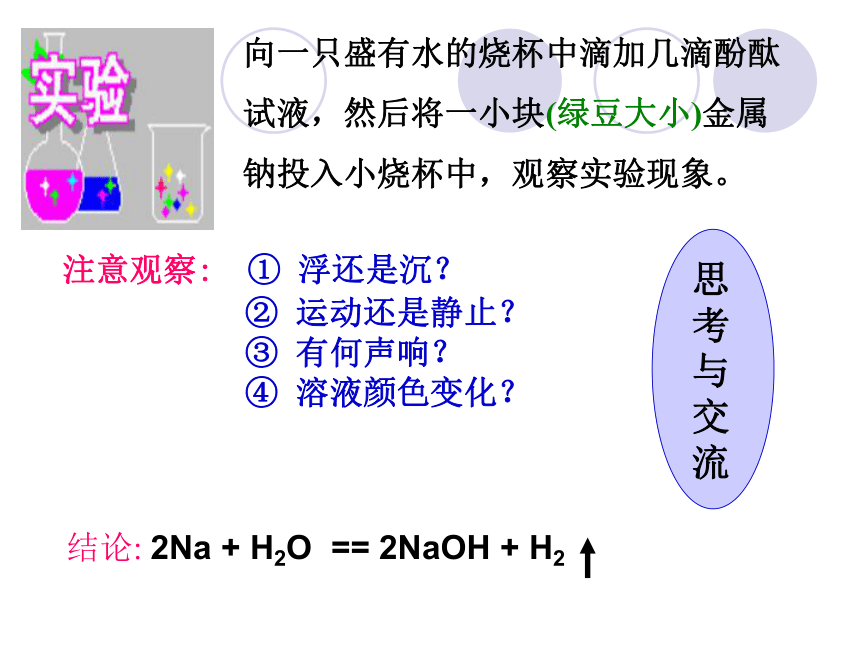
试液,然后将一小块(绿豆大小)金属
钠投入小烧杯中,观察实验现象。 注意观察: ① 浮还是沉?
② 运动还是静止?
③ 有何声响?
④ 溶液颜色变化? 思
考
与
交
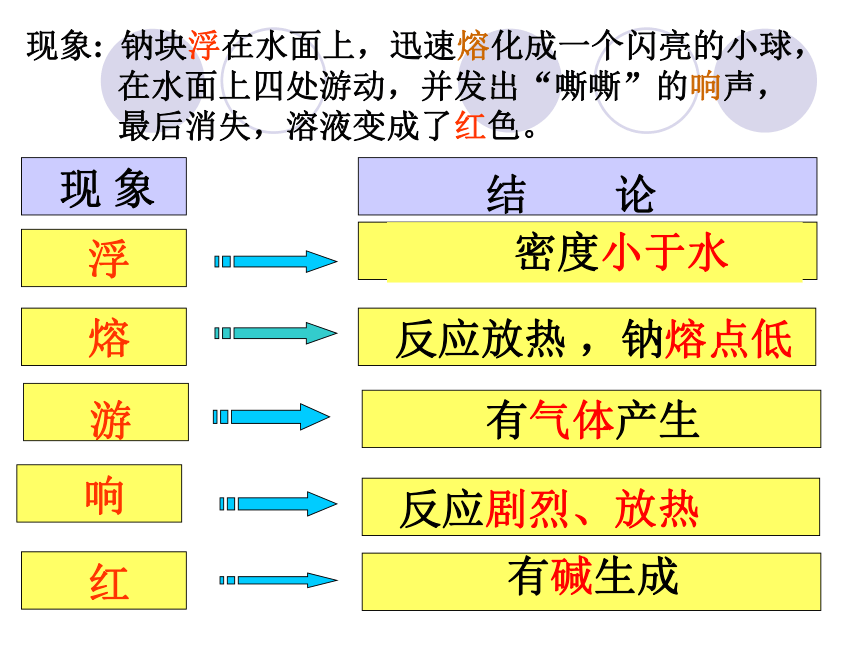
流 保山一中 朱智荣 现象: 钠块浮在水面上,迅速熔化成一个闪亮的小球,
在水面上四处游动,并发出“嘶嘶”的响声,
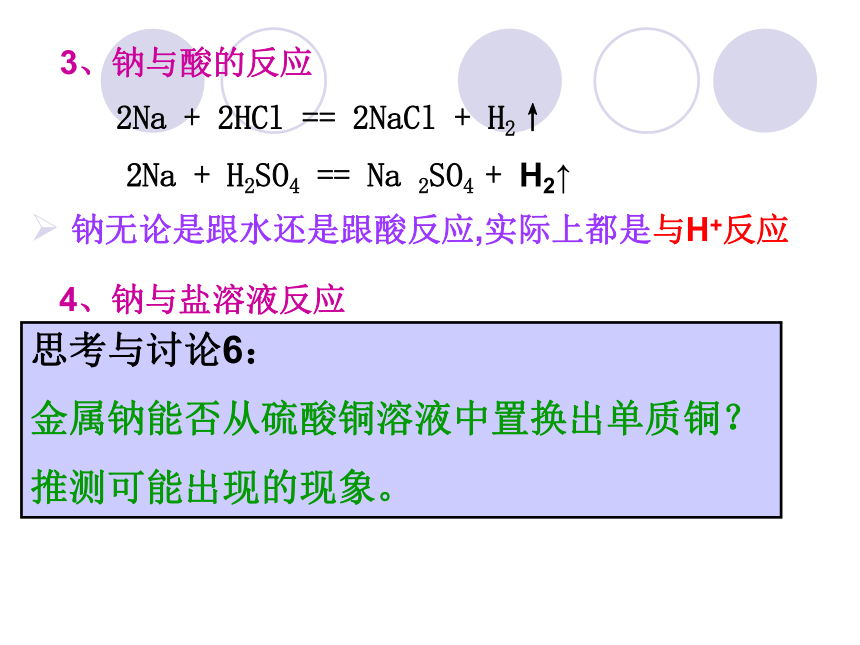
最后消失,溶液变成了红色。保山一中 朱智荣3、钠与酸的反应2Na + 2HCl == 2NaCl + H2↑ 2Na + H2SO4 == Na 2SO4 + H2↑思考与讨论6:
金属钠能否从硫酸铜溶液中置换出单质铜?
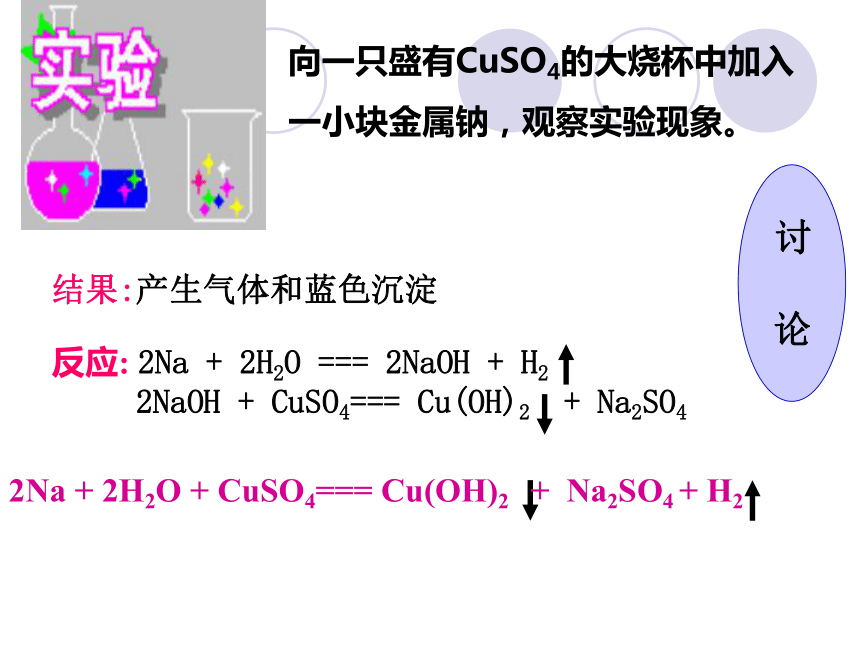
推测可能出现的现象。 钠无论是跟水还是跟酸反应,实际上都是与H+反应4、钠与盐溶液反应保山一中 朱智荣结果:产生气体和蓝色沉淀 向一只盛有CuSO4的大烧杯中加入
一小块金属钠,观察实验现象。反应: 2Na + 2H2O === 2NaOH + H2 2NaOH + CuSO4=== Cu(OH)2 + Na2SO42Na + 2H2O + CuSO4=== Cu(OH)2 + Na2SO4 + H2 讨
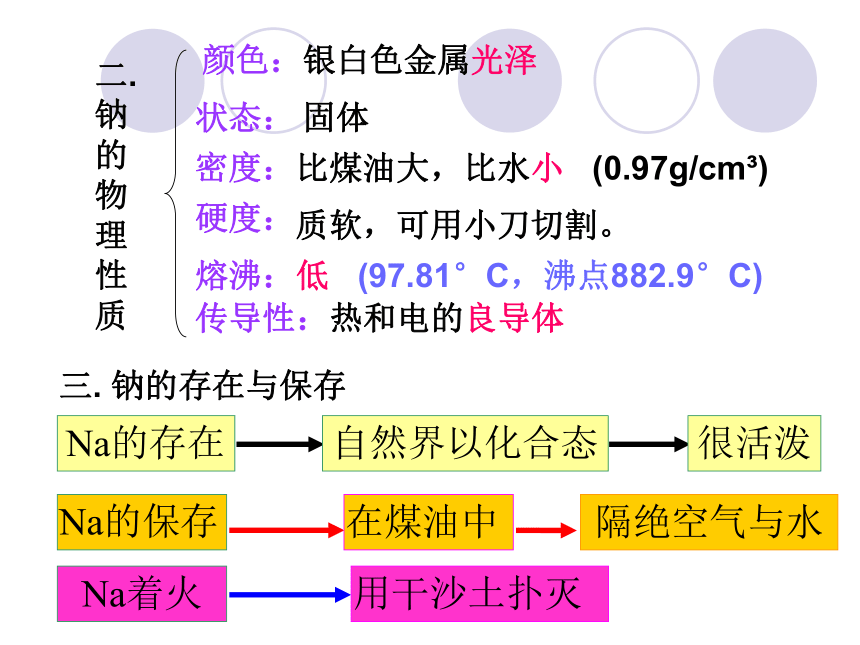
论保山一中 朱智荣二.
钠
的
物
理
性
质
质软,可用小刀切割。银白色金属光泽固体颜色:状态:硬度:密度:比煤油大,比水小 (0.97g/cm3) 熔沸:低 (97.81°C,沸点882.9°C)传导性:热和电的良导体三. 钠的存在与保存Na的存在自然界以化合态很活泼Na的保存Na着火在煤油中隔绝空气与水用干沙土扑灭保山一中 朱智荣1.钠与非金属反应常温下//加热 (2) 钠与氯气反应:(1) 钠与氧气反应:2.钠与水反应 3. 钠与酸或其他盐溶液的反应(二). 钠的化学性质:(一). 钠的物理性质颜色:状态:硬度: 密度: 课
堂
小
结一. 钠----先与水反应(三). 钠的存在与保存保山一中 朱智荣第三章 金属及其化合物一. 钠第一节 金属的化学性质(第二课时)保山一中 朱智荣1.钠与非金属反应常温下//加热 (2) 钠与氯气反应:(1) 钠与氧气反应:2.钠与水反应 3. 钠与酸或其他盐溶液的反应(二). 钠的化学性质:(一). 钠的物理性质颜色:状态:硬度: 密度: 温
故一. 钠----先与水反应,
再与盐溶液
反应(三). 钠的存在与保存化合态:元素在化
合物中的存在形态游离态:元素以单
质的形态存在保山一中 朱智荣第三章 金属及其化合物一. 钠二. 铁第一节 金属的化学性质想一想N a与FeCl3溶液反应的现象?保山一中 朱智荣3.与盐: Fe+CuSO4==FeSO4+Cu2.与酸:Fe+H2SO4==FeSO4+H2 1.与氧气:4Fe+3O2==2Fe2O3二. 铁 思
考
与
交
流 我们学过铁的那些化学反应: 3Fe+2O2==Fe3O4点燃铁与水能反应吗?保山一中 朱智荣实验装置设计思路:
水蒸气的产生装置→
水蒸气与铁粉的反应装置→
气体产物检验装置科学探究1 -----铁与水蒸气反应保山一中 朱智荣4. 铁与水蒸气反应3Fe+4H2O(g)== Fe3O4+4H2 保山一中 朱智荣第三章 金属及其化合物一. 钠二. 铁第一节 金属的化学性质三. 铝保山一中 朱智荣 实验:用坩锅钳夹住一小块铝箔(箔厚约0.1mm),
在酒精灯上加热至熔化,轻轻晃动。仔细观察. 现象: 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着。 解释:这是因为铝表面的氧化膜保护了铝。构成薄膜的Al2O3的熔点(2050度)高于铝的熔点(660度),包在铝的外面,所以熔化了的液态铝不会落下来。科学探究2 -----加热铝箔保山一中 朱智荣 实验:再取一块铝箔用砂纸仔细打磨,除去表面
保护膜,再加热至熔化。又有什么现象呢? 现象: 熔化的铝仍不滴落。 原因: 铝很活泼,磨去原来的氧化膜后,在空气中又会很快地生成一层新的氧化膜。科学探究3 1.与氧气反应:铝是一种活泼金属。-----加热去氧化膜的铝箔保山一中 朱智荣结论:金属活动性顺序表中(H) 前面的金属
与酸反应产生H2 。
金属越活泼,与酸反应越剧烈。金属与酸的反应思考: 能与酸反应是活泼和较活泼金属的通性, 那么金属能不能与碱反应呢?2.与酸反应:2Al+6HCl==2AlCl3 +3H2保山一中 朱智荣实验:取2支试管,分别加入几片(用砂纸去掉氧化膜)
铝片,然后再分别加入2mL 盐酸和2mLNaOH溶液
观察实验现象。科学探究4 -----铝与 NaOH溶液反应从守恒角度考虑:反应所产生的气体可能是什么?铝的特殊性:既能跟酸反应产生H2,
又能跟强碱溶液反应产生H2。保山一中 朱智荣2Al + 2NaOH + 2H2O== 2NaAlO2 + 3H2↑偏铝酸钠3.与强碱溶液反应:离子方程式:2Al + 2OH -+ 2H2O=2AlO2- + 3H2↑保山一中 朱智荣铝和氧化铝(铝的保护膜,也能与酸、碱反应)能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性的食物。化学与生活 资料表明:铝盐可能导致人的记忆力丧失(老年痴呆)。世界卫生组织提出人体每天的摄铝量不应超过1mg/kg体重,一般情况下,一个人每天摄取的铝量绝不会超过这个量。保山一中 朱智荣【小结】金属单质在发生化学反应时,容易 电子,化合价 ,被 。一般都作为 剂,表现出 性。失去升高氧化还原还原Na
Fe
Al化
学
性
质→1.与氧气反应2.与酸反应3.与盐反应4.活泼金属与水反应5.Al与强碱溶液反应第一节 金属的化学性质保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(1)
-----钠的重要化合物 (第三课时)保山一中 朱智荣Na2O + H2O = 2NaOH1.溶于水并与水反应Na2O + 2HCl= 2NaCl + H2O2.氧化钠与盐酸反应:
(一 ) .氧化钠(Na2O)属于碱性氧化物-2一 .氧化物保山一中 朱智荣(二)过氧化钠 (Na2O2) 颜色:淡黄色
状态:粉末状固体 思考:溶解度 Na2O2是否也会与水发生化学反应呢?1.物理性质-1保山一中 朱智荣 2 Na2O2 + 2H2O === 4NaOH + O2↑ 既是氧化剂,又是还原剂。那么Na2O2在这个反应中充当了什么角色呢? 有哪些元素发生了化合价的变化了呢? 只有氧元素;2.化学性质(1).跟水反应 (2).与二氧化碳的反应2Na2O2 + 2CO2 == 2Na2CO3 + O23.用途供氧剂:氧化剂 漂白剂呼吸面具保山一中 朱智荣思考:通过滴加酚酞的对比实验,
能说明一个什么问题?Na2CO3 NaHCO3 >二.钠盐俗 名 纯碱或苏打 小苏打探究(1)溶解性和溶液酸碱性溶解性:溶液显碱性碱性:Na2CO3 NaHCO3 >保山一中 朱智荣思考:1.在Na2CO3饱和溶液中通入CO2后有沉淀析出,
为什么?[解析]1、将CO2通入Na2CO3溶液中,发生如下反应:
Na2CO3+H2O+CO2=2NaHCO3
2、生成的NaHCO3的溶解度比Na2CO3的溶解度小。2. 把Na2CO3溶液和NaHCO3溶液分别滴入稀盐酸中,
会有什么现象?为什么?保山一中 朱智荣有无色气体产生
有无色气体产(反应较剧烈)Na2CO3与盐酸反应一开始没有气泡,继续滴加有气泡产生;
NaHCO3溶液中滴入盐酸立刻有气泡产生。
探究(2)Na2CO3、NaHCO3与酸的反应: CO32 - + H+ = HCO3 -保山一中 朱智荣Na2CO3、NaHCO3与某些的性质 回
顾溶解性:Na2CO3 NaHCO3 >溶液碱性Na2CO3 NaHCO3 >与同浓度H+反应剧烈程度Na2CO3 NaHCO3<保山一中 朱智荣 Na2CO3 + CaCl2==CaCO3 + 2NaCl NaHCO3 + CaCl2 不反应 探究(3)分别取少量碳酸钠和碳酸氢钠溶液于两支
试管中,加入氯化钙溶液(3)Na2CO3、NaHCO3与某些盐的反应 探究(4)继续向盛有碳酸氢钠溶液的试管中加入
氢氧化钠溶液 再加入NaOH溶液,有白色沉淀生成 HCO3- + OH - = CO3 2- +H2O 保山一中 朱智荣 (4)Na2CO3、NaHCO3与某些碱的反应HCO3- + OH - = CO3 2- +H2OCO3 2-与OH – 不反应保山一中 朱智荣 加热
碳酸钠固体和
碳酸氢钠固体(5)Na2CO3、NaHCO3的热稳定性探究(5)现象: 碳酸钠受热没有变化。 碳酸氢钠受热,试管壁有无色
液滴,放出无色气体,该气体使石灰水变浑浊。2NaHCO3 == Na2CO3 + H2O + CO2△ 热稳定性:Na2CO3 > NaHCO3保山一中 朱智荣1号试管: 澄 清石灰水变浑浊2号试管: 澄 清石灰水不变浑浊(1)(2)探究(5)---- Na2CO3、NaHCO3的热稳定性保山一中 朱智荣3.用 途制玻璃制 皂造 纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制 药抗酸药反应原理保山一中 朱智荣三. 焰色反应含义:某些金属或其化合物灼烧时使
火焰呈现出特殊的颜色(2) 操作:(P57: 实验3-6)(3) 结论: 钠:黄色
钾:紫色(透过蓝色钴玻璃观察)(4) 应用:离子检验,物质鉴别。-----物理变化保山一中 朱智荣一、钠的化合物 课 堂
小 结1.钠的氧化物碱性氧化物Na2ONa2O2强氧化性2.Na2CO3和NaHCO3 > >√√√① CO2+H2O② H+①固,△ ② OH- >×保山一中 朱智荣1.有一包白色碳酸钠粉末,如何证明里面是否混有碳酸氢钠?如果有碳酸氢钠,如何除去? 答:加热,产生气体,而且气体能使澄清石灰水变
混浊则证明碳酸钠粉末中含有碳酸氢钠。
加热直到没有气体放出,碳酸氢钠就已除尽。讨论题2.有一瓶无色的碳酸氢钠溶液,如何证明碳酸氢钠溶液
中是否混有碳酸钠? 答:加入可溶性的钙盐和钡盐,生成白色的沉淀。保山一中 朱智荣3.怎样鉴别碳酸钠和碳酸氢钠 ⑴ 加热固体。产生能使石灰水变浑浊的无色气体
的是碳酸氢钠。2NaHCO3 == Na2CO3 + H2O + CO2△ ⑶ 在固体中加入相同浓度的盐酸,反应剧烈的是
碳酸氢钠。Na2CO3 + CaCl2 = 2NaCl + CaCO3 ⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(2)
-----铝的重要化合物(第四课时)保山一中 朱智荣二. 铝的重要化合物: 颜色和状态:白色固体溶解性:难溶于水熔点:高(一)氧化铝----Al2O31.物理性质铝以化合态存在于自然界保山一中 朱智荣(1)与酸溶液反应Al2O3 + 6HCl = 2AlCl3 + 3H2OAl2O3 + 6H+ = 2Al3+ + 3H2O两性氧化物:既能与酸反应,又能与碱反应氧化物。
Al2O3是两性氧化物2.化学性质(2)与强碱溶液反应保山一中 朱智荣金属氧化物一定是碱性氧化物吗?
碱性氧化物一定是金属氧化物吗? 金属氧化物不一定是碱性氧化物
(如Al2O3是两性氧化物)
碱性氧化物一定是金属氧化物。 思
考
与
交
流 保山一中 朱智荣3.用途用耐磨的
Al2O3做成的轴承 用耐高温的
Al2O3制成的坩埚耐火材料。如:耐火管、耐火坩埚等实验仪器是冶炼金属铝的原料保山一中 朱智荣(二) 氢氧化铝-----Al(OH)31.化学性质:(1)与酸溶液反应Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+ = Al3++3H2O (2)与强碱溶液反应Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+ OH-=AlO2-+2H2O两性氢氧化物:既能与酸反应,又能与碱反应氢氧化物
Al(OH)3是两性氢氧化物(3)加热分解
探究
(1)
探究
(2)
探究
(3)
保山一中 朱智荣为什么不用氢氧化钠溶液与硫酸铝溶液
反应制备氢氧化铝?氢氧化铝可溶解在氢氧化钠溶液中:
当氢氧化钠不足时,铝离子沉淀不完全,
Al3++3OH-=Al(OH)3↓;
当氢氧化钠过量时,铝离子会转化为AlO2-。 Al(OH)3+OH-=AlO2-+2H2O,2.制备:可溶性铝盐 + 氨水 思
考
与
交
流 Al2(SO4)3+ 6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4白色胶状沉淀Al3++ 3NH3·H2O= Al(OH)3 ↓ + 3NH4+保山一中 朱智荣能凝聚水中的悬浮物,并能吸附色素溶解性:难溶于水 颜色和状态:白色胶状物质治疗胃酸4.用途 思
考
与
交
流 某胃病患者胃酸过多,如果你是医生,
你用什么药物治疗胃酸过多?用小苏打(NaHCO3)或氢氧化铝[Al(OH)3],
如果该患者有胃溃疡,还能用小苏打吗?
为什么?3.物理性质保山一中 朱智荣[商品名称]斯达舒
[成份]本品每粒含氢氧化铝140毫克,维生素U50
毫克,颠茄提取物10毫克,辅料: 淀粉 。
[药理作用]本品中氢氧化铝为抗酸药,能中和胃酸
并保护溃疡面;维生素U能促进肉芽发
育和黏膜再生;颠茄流浸膏可抑制腺体
分泌,解除平滑痉挛引起的疼痛。保山一中 朱智荣 (1)向Al2 (SO4)3溶液里滴加NaOH溶液至过量Al(OH)3+NaOH=NaAlO2+2H2OAl2 (SO4)3+6NaOH=2Al(OH)3 ↓ +3Na2SO4(2)向NaOH溶液里滴加Al2 (SO4)3溶液至过量现象:先产生白色沉淀,然后沉淀逐渐溶解。现象:开始无沉淀,过一会儿产生白色沉淀且不溶解科学探究4:不加任何试剂怎样鉴别标签丢失的硫酸铝
溶液和氢氧化钠溶液?保山一中 朱智荣KAl(SO4)2·12H2O KAl(SO4)2 == K++Al3++2SO42-(三)明矾无色晶体,易溶于水Al3+ + 3H2O ==Al(OH)3 + 3H+(胶体)浑浊水清水保山一中 朱智荣1、晶体中含有水的实验为___________。
2、晶体中含有Al3+的实验为_________。
3、晶体中含有SO42-的实验为________。
4、溶液是否有胶体存在的实验为_____。 设计实验证明明矾的成分和性质
探究
(5)
保山一中 朱智荣
课 堂
小 结
二. 铝的重要化合物 (一)氧化铝物理性质化学性质:用途两性氧化物(二) 氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(三)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(第五课时)
铁的重要化合物绵阳中学高一化学备课组 蔡世通保山一中 朱智荣1、铁的氧化物三、铁的重要化合物保山一中 朱智荣FeO+2H+ ==
Fe2+ + H2O Fe2O3 + 6H+==
2Fe3++ 3H2O ------1、铁的氧化物磁铁矿与H+反应 与CO反应溶解性 不溶于水 不溶于水 不溶于水 保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物三、铁的重要化合物 思
考
与
交
流 如何制取
Fe(OH)2 和 Fe(OH)3 ?
可溶性铁盐和可溶性亚铁盐与碱溶液反应 保山一中 朱智荣我
来
试
一
试反应原理: Fe3+ + 3OH-== Fe(OH)3 ↓Fe(OH)3 沉淀保山一中 朱智荣Fe(OH)2 不稳定,在空气中易被氧化成 Fe(OH)3 思
考
与
交
流 4Fe(OH)2 +O2+ 2H2O == 4Fe(OH)3我
也
来
试
一
试反应原理: Fe2+ + 2OH-== Fe(OH)2 ↓保山一中 朱智荣[方法]: Fe(OH)2 不稳定,容易被空气中的O2 、或者溶液中溶解的O2所氧化,那么我们有没有办法观察到白色Fe(OH)2沉淀?
想一想 议一议在溶液上加入保护层(例如植物油)将胶头滴管尖端插入试管底部用煮沸过的蒸馏水配制溶液
……
保山一中 朱智荣2、铁的氢氧化物Fe(OH)2 + 2H+ ==
Fe 2+ +2 H2O Fe(OH)3 + 3H+ ==
Fe3+ + 3H2O 高温不稳定
2Fe(OH) 3
Fe2O3 +3H2O
不稳定易氧化
4 Fe(OH)2 +O2 +2H2O
== 4Fe(OH)3溶解性 不溶于水 不溶于水 与H+反应稳 定 性保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
三、铁的重要化合物(1)Fe3+的检验3.铁盐与亚铁盐我
来
说
一
说保山一中 朱智荣[观察现象]:
溶液呈现血红色。[观察现象]:
没有明显变化。
保山一中 朱智荣(1).检验方法NaOH溶液 白→灰绿→红褐色 红褐色KSCN溶液无明显变化 红色溶液颜色 浅绿色 黄色保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
三、铁的重要化合物(1)Fe3+的检验3.铁盐与亚铁盐(2)Fe2+和Fe3+的相互转化保山一中 朱智荣保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
(1)制备
(2)性质
3.铁盐与亚铁盐
(1)Fe3+的检验
(2)Fe2+和Fe3+的相互转化三、铁的重要化合物Fe 2+Fe 3+O2、Cl2、HNO3等保山一中 朱智荣黄色溶液变为浅绿色。还原铁粉FeCl3 溶液(2)Fe2+和Fe3+的相互转化Fe 2+Fe 3+O2、Cl2、HNO3等Fe等保山一中 朱智荣三、铁的重要化合物Fe 2+Fe 3+ 课 堂
小 结氧化剂1.铁的氧化物2.铁的氢氧化物3.铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水碱性氧化物:与H+反应不溶于水与H+反应稳 定 性还原剂保山一中 朱智荣 2. 要除去FeCl2溶液中的少量FeCl3,可行的办法是
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉 ( B)( D) ( B ) 学 以 致 用下列物质跟铁反应后的生成物,能跟KSCN溶液
作用生成红色溶液的是
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸3 .苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,
现榨的苹果汁在空气中由淡绿色变为棕黄色(Fe3+)
若榨汁时加入维生素C,可有效防止这种现象发生。
这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性保山一中 朱智荣( C ) 学 以 致 用4. ?要证明某溶液中不含Fe 3+而可能含有Fe 2+进行如下
实验操作时最佳顺序为
① 加入足量氯水?? ② 加入足量NaOH溶液??
③ 加入少量KSCN溶液
A. ① ③??? B. ③ ②??? C. ③ ①??? D. ① ② ③保山一中 朱智荣5. 下列离子方程式书写正确的是( )
A. 稀硫酸滴在铁片上:Fe + 2H+== Fe3+ + H2↑
B. 足量盐酸滴在石灰石上:
CaCO3 + 2H+==== Ca2+ + CO2↑+ H2O
C. 三氯化铁溶液中加入铁粉:Fe3+ + Fe==2Fe2+ D. FeCl2溶液跟Cl2反应:2Fe2+ + Cl2= 2Fe3+ + 2Cl- BD 学 以 致 用保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(第六课时)
(归纳与整理)
一、钠的化合物二. 铝的重要化合物 三、铁的重要化合物氧化物氢氧化铝盐保山一中 朱智荣一、钠的化合物1.钠的氧化物碱性氧化物---与H2O、H+反应Na2ONa2O2强氧化性---2.Na2CO3和NaHCO3 > >√√√① CO2+H2O② H+①固,△ ② OH- >×强氧化性---与H2O、H+反应② H+保山一中 朱智荣二. 铝的重要化合物 (一)氧化铝物理性质化学性质:用途两性氧化物(二) 氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(三)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣三、铁的重要化合物Fe 2+Fe 3+氧化剂1.铁的氧化物2.铁的氢氧化物3.铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水碱性氧化物:与H+反应不溶于水与H+反应稳 定 性还原剂 习题:P105(变-4)、例-4保山一中 朱智荣四. 焰色反应物理变化应用:物质鉴别如: Na+ 、K+保山一中 朱智荣钠及其重要化合物CO2保山一中 朱智荣
AlO2? Al(OH)3 Al3+ AlAl2O3① O2② OH_③ H+④ OH_⑨ H+⑩ H+⑧ OH_⑦ OH_⑤ H+铝及其重要化合物⑥ 加热3113保山一中 朱智荣FeFe3O4FeCl3Fe(OH)2Fe(OH)3
红褐色FeCl2①②③Cl2④⑤⑥⑦⑧⑨铁及其重要化合物 潮湿的空气中与氧气作用氧化铁Fe2O3保山一中 朱智荣第三章 金属及其化合物第三节 用途广泛的金属材料(第八课时)保山一中 朱智荣1、合金:一种金属跟其他一种或几种金属
(或非金属)一起熔合而成的具有
金属特性的物质
低大2、合金的特性:熔点一般比成分金属的
硬度比成分金属的硬度一、常见的合金保山一中 朱智荣(1).铜合金青铜:主要含铜和锡----我国使用最早的合金
黄铜:主要含铜和锌
白铜:主要含铜和镍3.常见合金保山一中 朱智荣(2).铁合金① 生铁与钢的比较保山一中 朱智荣② 钢---用量最大,用途最广的合金保山一中 朱智荣(3).其它几种常见合金的组成、性质和用途保山一中 朱智荣1.人类使用材料的进化顺序石器时代铜器时代铁器时代材 料金属材料非金属材料合成高分子材料二、正确选用金属材料保山一中 朱智荣 2. 选用材料的因素:主要用途、外观、物理性质、
化学性质、价格、加工难度、
日常维护、对环境的影响等。保山一中 朱智荣K金是在黄金中添加少量银、铜、锌等金属,以增强黄金的强度和韧性。 K金白金是黄金与钯、镍、银和锌
等金属的白色合金 生活中的合金 24K金纯度为99.9%保山一中 朱智荣形状记忆合金原形 放入热水后?? 再放入冷水 记忆合金制
作的眼镜架 记忆合金用
于骨骼固定保山一中 朱智荣未来的金属:钛和钛合金保山一中 朱智荣
第三章 金属及其化合物(复习)
一 .金属的化学性质三. 金属及其化合物的重要应用Na及其化合物Al及其化合物Fe及其化合物二.重要的金属及其化合物保山一中 朱智荣化
学
性
质→1.与氧气等非金属单质反应:如O2、Cl2、S2.与酸( H+)反应:如盐酸、稀硫酸3.与盐反应:(反应条件)4.活泼金属与水反应:5.Al与强碱溶液反应:一 .金属的化学性质金属单质在发生化学反应时,容易 电子,化合价 ,被 。一般都作为 剂,表现
出 性。 失去升高 氧化 还原还原保山一中 朱智荣常温下//加热与O2反应:与盐溶液反应化学性质1. 钠二. 钠及其化合物先与水反应物理性质----特殊性存在与保存2.钠的化合物(1)氧化物Na2O碱性氧化物---与H2O、H+反应Na2O2强氧化性---与H2O、CO2反应 供氧剂、漂白剂保山一中 朱智荣(2)钠盐溶解性溶液碱性与H+反应与碱反应热稳定性Na2CO3NaHCO3保山一中 朱智荣 3. 钠的化合物相互关系 《名师》 : P 114保山一中 朱智荣常温下//点燃与O2反应:与强碱溶液(OH- )反应化学性质1.铝三.铝及其化合物物理性质----特殊性存在2. 铝的化合物(1)氧化铝---两性氧化物与H+反应与强碱溶液(OH- )反应耐火材料保山一中 朱智荣(2)氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(3)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣
AlO2? Al(OH)3 Al3+ AlAl2O3① O2② OH_③ H+④ OH_⑨ H+⑩ H+⑧ OH_⑦ OH_⑤ H+⑥ 加热 3.铝的化合物相互关系保山一中 朱智荣常温下//加热与O2反应:化学性质1.铁四. 铁及其化合物物理性质----特殊性存在2. 铁的化合物(1)氧化物---碱性氧化物:与H+反应FeO
Fe2O3
Fe3O4保山一中 朱智荣Fe 2+Fe 3+氧化剂(2)氢氧化物(3)铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水与H+反应 稳 定 性还原剂保山一中 朱智荣FeFe3O4FeCl3Fe(OH)2Fe(OH)3FeCl2Fe2O3①②③④⑤⑥⑦⑧⑨ 3. 铁的化合物相互关系保山一中 朱智荣1. 焰色反应物理变化应用:物质鉴别如: Na+ 、K+五. 金属及其化合物的重要应用3. 常见合金2.铝盐和铁盐的净水作用:在水中形成Fe(OH)3胶体Al(OH)3胶体 概念特性 用途4. 铜及其化合物六. 物质的量在化学方程式计算中的应用
(前四位)含量最多的金属元素是 元素。氧、硅、铝、铁铝第三章 金属及其化合物第一节 金属的化学性质 (第一课时)保山一中 朱智荣2物
理
性
质有金属光泽、有导电性、有导热性、延展性 大多数是固体、2、金属有哪些共同的物理性质和化学性质?排在H前面的金属能置换出酸里的氢与盐: Fe+CuSO4==FeSO4+Cu排在前面的金属能把排在后面的金属从其盐溶液中置换出来化
学
性
质保山一中 朱智荣图3-2 写出反应的化学方程式。2Al+3CuSO4==Al2 (SO4) 3+3Cu 2Mg+O2==2MgO 点燃 Cu+2AgNO3==Cu(NO3)2+2Ag3、金属的原子结构特点NaMgAl 思
考
与
交
流 保山一中 朱智荣结构Na钠在金属活动性顺序表中的位置:推测它的化学性质?应该很活泼-—强的还原性K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 保山一中 朱智荣取一小块金属钠,用滤纸
吸干表面的煤油,用小刀
切去一端的表层,观察表
面的颜色;将其放置在空
气中,观察表面颜色的变化。实验探究 1反应: 4Na + O2= 2Na2O (白色固体)现象:钠的新切面由光亮的银白色渐渐变暗保山一中 朱智荣将一小块金属钠放在坩埚里,用酒精灯对其加热,观察实验现象.实验探究2反应: 2Na+O2 === Na2O2 (淡黄色)现象: 钠在空气中受热后,先熔化成闪亮 的小球后
剧烈燃烧产生黄色火焰,生成淡黄色固体.过氧化钠保山一中 朱智荣 2Na + O2 == Na2O2 (淡黄色固体)1.钠与非金属反应常温下加热(2) 钠与氯气反应(1) 钠与氧气反应+1 -2+1 -1 保山一中 朱智荣 向一只盛有水的烧杯中滴加几滴酚酞
试液,然后将一小块(绿豆大小)金属
钠投入小烧杯中,观察实验现象。 注意观察: ① 浮还是沉?
② 运动还是静止?
③ 有何声响?
④ 溶液颜色变化? 思
考
与
交
流 保山一中 朱智荣 现象: 钠块浮在水面上,迅速熔化成一个闪亮的小球,
在水面上四处游动,并发出“嘶嘶”的响声,
最后消失,溶液变成了红色。保山一中 朱智荣3、钠与酸的反应2Na + 2HCl == 2NaCl + H2↑ 2Na + H2SO4 == Na 2SO4 + H2↑思考与讨论6:
金属钠能否从硫酸铜溶液中置换出单质铜?
推测可能出现的现象。 钠无论是跟水还是跟酸反应,实际上都是与H+反应4、钠与盐溶液反应保山一中 朱智荣结果:产生气体和蓝色沉淀 向一只盛有CuSO4的大烧杯中加入
一小块金属钠,观察实验现象。反应: 2Na + 2H2O === 2NaOH + H2 2NaOH + CuSO4=== Cu(OH)2 + Na2SO42Na + 2H2O + CuSO4=== Cu(OH)2 + Na2SO4 + H2 讨
论保山一中 朱智荣二.
钠
的
物
理
性
质
质软,可用小刀切割。银白色金属光泽固体颜色:状态:硬度:密度:比煤油大,比水小 (0.97g/cm3) 熔沸:低 (97.81°C,沸点882.9°C)传导性:热和电的良导体三. 钠的存在与保存Na的存在自然界以化合态很活泼Na的保存Na着火在煤油中隔绝空气与水用干沙土扑灭保山一中 朱智荣1.钠与非金属反应常温下//加热 (2) 钠与氯气反应:(1) 钠与氧气反应:2.钠与水反应 3. 钠与酸或其他盐溶液的反应(二). 钠的化学性质:(一). 钠的物理性质颜色:状态:硬度: 密度: 课
堂
小
结一. 钠----先与水反应(三). 钠的存在与保存保山一中 朱智荣第三章 金属及其化合物一. 钠第一节 金属的化学性质(第二课时)保山一中 朱智荣1.钠与非金属反应常温下//加热 (2) 钠与氯气反应:(1) 钠与氧气反应:2.钠与水反应 3. 钠与酸或其他盐溶液的反应(二). 钠的化学性质:(一). 钠的物理性质颜色:状态:硬度: 密度: 温
故一. 钠----先与水反应,
再与盐溶液
反应(三). 钠的存在与保存化合态:元素在化
合物中的存在形态游离态:元素以单
质的形态存在保山一中 朱智荣第三章 金属及其化合物一. 钠二. 铁第一节 金属的化学性质想一想N a与FeCl3溶液反应的现象?保山一中 朱智荣3.与盐: Fe+CuSO4==FeSO4+Cu2.与酸:Fe+H2SO4==FeSO4+H2 1.与氧气:4Fe+3O2==2Fe2O3二. 铁 思
考
与
交
流 我们学过铁的那些化学反应: 3Fe+2O2==Fe3O4点燃铁与水能反应吗?保山一中 朱智荣实验装置设计思路:
水蒸气的产生装置→
水蒸气与铁粉的反应装置→
气体产物检验装置科学探究1 -----铁与水蒸气反应保山一中 朱智荣4. 铁与水蒸气反应3Fe+4H2O(g)== Fe3O4+4H2 保山一中 朱智荣第三章 金属及其化合物一. 钠二. 铁第一节 金属的化学性质三. 铝保山一中 朱智荣 实验:用坩锅钳夹住一小块铝箔(箔厚约0.1mm),
在酒精灯上加热至熔化,轻轻晃动。仔细观察. 现象: 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着。 解释:这是因为铝表面的氧化膜保护了铝。构成薄膜的Al2O3的熔点(2050度)高于铝的熔点(660度),包在铝的外面,所以熔化了的液态铝不会落下来。科学探究2 -----加热铝箔保山一中 朱智荣 实验:再取一块铝箔用砂纸仔细打磨,除去表面
保护膜,再加热至熔化。又有什么现象呢? 现象: 熔化的铝仍不滴落。 原因: 铝很活泼,磨去原来的氧化膜后,在空气中又会很快地生成一层新的氧化膜。科学探究3 1.与氧气反应:铝是一种活泼金属。-----加热去氧化膜的铝箔保山一中 朱智荣结论:金属活动性顺序表中(H) 前面的金属
与酸反应产生H2 。
金属越活泼,与酸反应越剧烈。金属与酸的反应思考: 能与酸反应是活泼和较活泼金属的通性, 那么金属能不能与碱反应呢?2.与酸反应:2Al+6HCl==2AlCl3 +3H2保山一中 朱智荣实验:取2支试管,分别加入几片(用砂纸去掉氧化膜)
铝片,然后再分别加入2mL 盐酸和2mLNaOH溶液
观察实验现象。科学探究4 -----铝与 NaOH溶液反应从守恒角度考虑:反应所产生的气体可能是什么?铝的特殊性:既能跟酸反应产生H2,
又能跟强碱溶液反应产生H2。保山一中 朱智荣2Al + 2NaOH + 2H2O== 2NaAlO2 + 3H2↑偏铝酸钠3.与强碱溶液反应:离子方程式:2Al + 2OH -+ 2H2O=2AlO2- + 3H2↑保山一中 朱智荣铝和氧化铝(铝的保护膜,也能与酸、碱反应)能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性的食物。化学与生活 资料表明:铝盐可能导致人的记忆力丧失(老年痴呆)。世界卫生组织提出人体每天的摄铝量不应超过1mg/kg体重,一般情况下,一个人每天摄取的铝量绝不会超过这个量。保山一中 朱智荣【小结】金属单质在发生化学反应时,容易 电子,化合价 ,被 。一般都作为 剂,表现出 性。失去升高氧化还原还原Na
Fe
Al化
学
性
质→1.与氧气反应2.与酸反应3.与盐反应4.活泼金属与水反应5.Al与强碱溶液反应第一节 金属的化学性质保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(1)
-----钠的重要化合物 (第三课时)保山一中 朱智荣Na2O + H2O = 2NaOH1.溶于水并与水反应Na2O + 2HCl= 2NaCl + H2O2.氧化钠与盐酸反应:
(一 ) .氧化钠(Na2O)属于碱性氧化物-2一 .氧化物保山一中 朱智荣(二)过氧化钠 (Na2O2) 颜色:淡黄色
状态:粉末状固体 思考:溶解度 Na2O2是否也会与水发生化学反应呢?1.物理性质-1保山一中 朱智荣 2 Na2O2 + 2H2O === 4NaOH + O2↑ 既是氧化剂,又是还原剂。那么Na2O2在这个反应中充当了什么角色呢? 有哪些元素发生了化合价的变化了呢? 只有氧元素;2.化学性质(1).跟水反应 (2).与二氧化碳的反应2Na2O2 + 2CO2 == 2Na2CO3 + O23.用途供氧剂:氧化剂 漂白剂呼吸面具保山一中 朱智荣思考:通过滴加酚酞的对比实验,
能说明一个什么问题?Na2CO3 NaHCO3 >二.钠盐俗 名 纯碱或苏打 小苏打探究(1)溶解性和溶液酸碱性溶解性:溶液显碱性碱性:Na2CO3 NaHCO3 >保山一中 朱智荣思考:1.在Na2CO3饱和溶液中通入CO2后有沉淀析出,
为什么?[解析]1、将CO2通入Na2CO3溶液中,发生如下反应:
Na2CO3+H2O+CO2=2NaHCO3
2、生成的NaHCO3的溶解度比Na2CO3的溶解度小。2. 把Na2CO3溶液和NaHCO3溶液分别滴入稀盐酸中,
会有什么现象?为什么?保山一中 朱智荣有无色气体产生
有无色气体产(反应较剧烈)Na2CO3与盐酸反应一开始没有气泡,继续滴加有气泡产生;
NaHCO3溶液中滴入盐酸立刻有气泡产生。
探究(2)Na2CO3、NaHCO3与酸的反应: CO32 - + H+ = HCO3 -保山一中 朱智荣Na2CO3、NaHCO3与某些的性质 回
顾溶解性:Na2CO3 NaHCO3 >溶液碱性Na2CO3 NaHCO3 >与同浓度H+反应剧烈程度Na2CO3 NaHCO3<保山一中 朱智荣 Na2CO3 + CaCl2==CaCO3 + 2NaCl NaHCO3 + CaCl2 不反应 探究(3)分别取少量碳酸钠和碳酸氢钠溶液于两支
试管中,加入氯化钙溶液(3)Na2CO3、NaHCO3与某些盐的反应 探究(4)继续向盛有碳酸氢钠溶液的试管中加入
氢氧化钠溶液 再加入NaOH溶液,有白色沉淀生成 HCO3- + OH - = CO3 2- +H2O 保山一中 朱智荣 (4)Na2CO3、NaHCO3与某些碱的反应HCO3- + OH - = CO3 2- +H2OCO3 2-与OH – 不反应保山一中 朱智荣 加热
碳酸钠固体和
碳酸氢钠固体(5)Na2CO3、NaHCO3的热稳定性探究(5)现象: 碳酸钠受热没有变化。 碳酸氢钠受热,试管壁有无色
液滴,放出无色气体,该气体使石灰水变浑浊。2NaHCO3 == Na2CO3 + H2O + CO2△ 热稳定性:Na2CO3 > NaHCO3保山一中 朱智荣1号试管: 澄 清石灰水变浑浊2号试管: 澄 清石灰水不变浑浊(1)(2)探究(5)---- Na2CO3、NaHCO3的热稳定性保山一中 朱智荣3.用 途制玻璃制 皂造 纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制 药抗酸药反应原理保山一中 朱智荣三. 焰色反应含义:某些金属或其化合物灼烧时使
火焰呈现出特殊的颜色(2) 操作:(P57: 实验3-6)(3) 结论: 钠:黄色
钾:紫色(透过蓝色钴玻璃观察)(4) 应用:离子检验,物质鉴别。-----物理变化保山一中 朱智荣一、钠的化合物 课 堂
小 结1.钠的氧化物碱性氧化物Na2ONa2O2强氧化性2.Na2CO3和NaHCO3 > >√√√① CO2+H2O② H+①固,△ ② OH- >×保山一中 朱智荣1.有一包白色碳酸钠粉末,如何证明里面是否混有碳酸氢钠?如果有碳酸氢钠,如何除去? 答:加热,产生气体,而且气体能使澄清石灰水变
混浊则证明碳酸钠粉末中含有碳酸氢钠。
加热直到没有气体放出,碳酸氢钠就已除尽。讨论题2.有一瓶无色的碳酸氢钠溶液,如何证明碳酸氢钠溶液
中是否混有碳酸钠? 答:加入可溶性的钙盐和钡盐,生成白色的沉淀。保山一中 朱智荣3.怎样鉴别碳酸钠和碳酸氢钠 ⑴ 加热固体。产生能使石灰水变浑浊的无色气体
的是碳酸氢钠。2NaHCO3 == Na2CO3 + H2O + CO2△ ⑶ 在固体中加入相同浓度的盐酸,反应剧烈的是
碳酸氢钠。Na2CO3 + CaCl2 = 2NaCl + CaCO3 ⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(2)
-----铝的重要化合物(第四课时)保山一中 朱智荣二. 铝的重要化合物: 颜色和状态:白色固体溶解性:难溶于水熔点:高(一)氧化铝----Al2O31.物理性质铝以化合态存在于自然界保山一中 朱智荣(1)与酸溶液反应Al2O3 + 6HCl = 2AlCl3 + 3H2OAl2O3 + 6H+ = 2Al3+ + 3H2O两性氧化物:既能与酸反应,又能与碱反应氧化物。
Al2O3是两性氧化物2.化学性质(2)与强碱溶液反应保山一中 朱智荣金属氧化物一定是碱性氧化物吗?
碱性氧化物一定是金属氧化物吗? 金属氧化物不一定是碱性氧化物
(如Al2O3是两性氧化物)
碱性氧化物一定是金属氧化物。 思
考
与
交
流 保山一中 朱智荣3.用途用耐磨的
Al2O3做成的轴承 用耐高温的
Al2O3制成的坩埚耐火材料。如:耐火管、耐火坩埚等实验仪器是冶炼金属铝的原料保山一中 朱智荣(二) 氢氧化铝-----Al(OH)31.化学性质:(1)与酸溶液反应Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+ = Al3++3H2O (2)与强碱溶液反应Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+ OH-=AlO2-+2H2O两性氢氧化物:既能与酸反应,又能与碱反应氢氧化物
Al(OH)3是两性氢氧化物(3)加热分解
探究
(1)
探究
(2)
探究
(3)
保山一中 朱智荣为什么不用氢氧化钠溶液与硫酸铝溶液
反应制备氢氧化铝?氢氧化铝可溶解在氢氧化钠溶液中:
当氢氧化钠不足时,铝离子沉淀不完全,
Al3++3OH-=Al(OH)3↓;
当氢氧化钠过量时,铝离子会转化为AlO2-。 Al(OH)3+OH-=AlO2-+2H2O,2.制备:可溶性铝盐 + 氨水 思
考
与
交
流 Al2(SO4)3+ 6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4白色胶状沉淀Al3++ 3NH3·H2O= Al(OH)3 ↓ + 3NH4+保山一中 朱智荣能凝聚水中的悬浮物,并能吸附色素溶解性:难溶于水 颜色和状态:白色胶状物质治疗胃酸4.用途 思
考
与
交
流 某胃病患者胃酸过多,如果你是医生,
你用什么药物治疗胃酸过多?用小苏打(NaHCO3)或氢氧化铝[Al(OH)3],
如果该患者有胃溃疡,还能用小苏打吗?
为什么?3.物理性质保山一中 朱智荣[商品名称]斯达舒
[成份]本品每粒含氢氧化铝140毫克,维生素U50
毫克,颠茄提取物10毫克,辅料: 淀粉 。
[药理作用]本品中氢氧化铝为抗酸药,能中和胃酸
并保护溃疡面;维生素U能促进肉芽发
育和黏膜再生;颠茄流浸膏可抑制腺体
分泌,解除平滑痉挛引起的疼痛。保山一中 朱智荣 (1)向Al2 (SO4)3溶液里滴加NaOH溶液至过量Al(OH)3+NaOH=NaAlO2+2H2OAl2 (SO4)3+6NaOH=2Al(OH)3 ↓ +3Na2SO4(2)向NaOH溶液里滴加Al2 (SO4)3溶液至过量现象:先产生白色沉淀,然后沉淀逐渐溶解。现象:开始无沉淀,过一会儿产生白色沉淀且不溶解科学探究4:不加任何试剂怎样鉴别标签丢失的硫酸铝
溶液和氢氧化钠溶液?保山一中 朱智荣KAl(SO4)2·12H2O KAl(SO4)2 == K++Al3++2SO42-(三)明矾无色晶体,易溶于水Al3+ + 3H2O ==Al(OH)3 + 3H+(胶体)浑浊水清水保山一中 朱智荣1、晶体中含有水的实验为___________。
2、晶体中含有Al3+的实验为_________。
3、晶体中含有SO42-的实验为________。
4、溶液是否有胶体存在的实验为_____。 设计实验证明明矾的成分和性质
探究
(5)
保山一中 朱智荣
课 堂
小 结
二. 铝的重要化合物 (一)氧化铝物理性质化学性质:用途两性氧化物(二) 氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(三)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(第五课时)
铁的重要化合物绵阳中学高一化学备课组 蔡世通保山一中 朱智荣1、铁的氧化物三、铁的重要化合物保山一中 朱智荣FeO+2H+ ==
Fe2+ + H2O Fe2O3 + 6H+==
2Fe3++ 3H2O ------1、铁的氧化物磁铁矿与H+反应 与CO反应溶解性 不溶于水 不溶于水 不溶于水 保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物三、铁的重要化合物 思
考
与
交
流 如何制取
Fe(OH)2 和 Fe(OH)3 ?
可溶性铁盐和可溶性亚铁盐与碱溶液反应 保山一中 朱智荣我
来
试
一
试反应原理: Fe3+ + 3OH-== Fe(OH)3 ↓Fe(OH)3 沉淀保山一中 朱智荣Fe(OH)2 不稳定,在空气中易被氧化成 Fe(OH)3 思
考
与
交
流 4Fe(OH)2 +O2+ 2H2O == 4Fe(OH)3我
也
来
试
一
试反应原理: Fe2+ + 2OH-== Fe(OH)2 ↓保山一中 朱智荣[方法]: Fe(OH)2 不稳定,容易被空气中的O2 、或者溶液中溶解的O2所氧化,那么我们有没有办法观察到白色Fe(OH)2沉淀?
想一想 议一议在溶液上加入保护层(例如植物油)将胶头滴管尖端插入试管底部用煮沸过的蒸馏水配制溶液
……
保山一中 朱智荣2、铁的氢氧化物Fe(OH)2 + 2H+ ==
Fe 2+ +2 H2O Fe(OH)3 + 3H+ ==
Fe3+ + 3H2O 高温不稳定
2Fe(OH) 3
Fe2O3 +3H2O
不稳定易氧化
4 Fe(OH)2 +O2 +2H2O
== 4Fe(OH)3溶解性 不溶于水 不溶于水 与H+反应稳 定 性保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
三、铁的重要化合物(1)Fe3+的检验3.铁盐与亚铁盐我
来
说
一
说保山一中 朱智荣[观察现象]:
溶液呈现血红色。[观察现象]:
没有明显变化。
保山一中 朱智荣(1).检验方法NaOH溶液 白→灰绿→红褐色 红褐色KSCN溶液无明显变化 红色溶液颜色 浅绿色 黄色保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
三、铁的重要化合物(1)Fe3+的检验3.铁盐与亚铁盐(2)Fe2+和Fe3+的相互转化保山一中 朱智荣保山一中 朱智荣1.铁的氧化物
2.铁的氢氧化物
(1)制备
(2)性质
3.铁盐与亚铁盐
(1)Fe3+的检验
(2)Fe2+和Fe3+的相互转化三、铁的重要化合物Fe 2+Fe 3+O2、Cl2、HNO3等保山一中 朱智荣黄色溶液变为浅绿色。还原铁粉FeCl3 溶液(2)Fe2+和Fe3+的相互转化Fe 2+Fe 3+O2、Cl2、HNO3等Fe等保山一中 朱智荣三、铁的重要化合物Fe 2+Fe 3+ 课 堂
小 结氧化剂1.铁的氧化物2.铁的氢氧化物3.铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水碱性氧化物:与H+反应不溶于水与H+反应稳 定 性还原剂保山一中 朱智荣 2. 要除去FeCl2溶液中的少量FeCl3,可行的办法是
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉 ( B)( D) ( B ) 学 以 致 用下列物质跟铁反应后的生成物,能跟KSCN溶液
作用生成红色溶液的是
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸3 .苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,
现榨的苹果汁在空气中由淡绿色变为棕黄色(Fe3+)
若榨汁时加入维生素C,可有效防止这种现象发生。
这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性保山一中 朱智荣( C ) 学 以 致 用4. ?要证明某溶液中不含Fe 3+而可能含有Fe 2+进行如下
实验操作时最佳顺序为
① 加入足量氯水?? ② 加入足量NaOH溶液??
③ 加入少量KSCN溶液
A. ① ③??? B. ③ ②??? C. ③ ①??? D. ① ② ③保山一中 朱智荣5. 下列离子方程式书写正确的是( )
A. 稀硫酸滴在铁片上:Fe + 2H+== Fe3+ + H2↑
B. 足量盐酸滴在石灰石上:
CaCO3 + 2H+==== Ca2+ + CO2↑+ H2O
C. 三氯化铁溶液中加入铁粉:Fe3+ + Fe==2Fe2+ D. FeCl2溶液跟Cl2反应:2Fe2+ + Cl2= 2Fe3+ + 2Cl- BD 学 以 致 用保山一中 朱智荣第三章 金属及其化合物第二节 几种重要的金属化合物(第六课时)
(归纳与整理)
一、钠的化合物二. 铝的重要化合物 三、铁的重要化合物氧化物氢氧化铝盐保山一中 朱智荣一、钠的化合物1.钠的氧化物碱性氧化物---与H2O、H+反应Na2ONa2O2强氧化性---2.Na2CO3和NaHCO3 > >√√√① CO2+H2O② H+①固,△ ② OH- >×强氧化性---与H2O、H+反应② H+保山一中 朱智荣二. 铝的重要化合物 (一)氧化铝物理性质化学性质:用途两性氧化物(二) 氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(三)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣三、铁的重要化合物Fe 2+Fe 3+氧化剂1.铁的氧化物2.铁的氢氧化物3.铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水碱性氧化物:与H+反应不溶于水与H+反应稳 定 性还原剂 习题:P105(变-4)、例-4保山一中 朱智荣四. 焰色反应物理变化应用:物质鉴别如: Na+ 、K+保山一中 朱智荣钠及其重要化合物CO2保山一中 朱智荣
AlO2? Al(OH)3 Al3+ AlAl2O3① O2② OH_③ H+④ OH_⑨ H+⑩ H+⑧ OH_⑦ OH_⑤ H+铝及其重要化合物⑥ 加热3113保山一中 朱智荣FeFe3O4FeCl3Fe(OH)2Fe(OH)3
红褐色FeCl2①②③Cl2④⑤⑥⑦⑧⑨铁及其重要化合物 潮湿的空气中与氧气作用氧化铁Fe2O3保山一中 朱智荣第三章 金属及其化合物第三节 用途广泛的金属材料(第八课时)保山一中 朱智荣1、合金:一种金属跟其他一种或几种金属
(或非金属)一起熔合而成的具有
金属特性的物质
低大2、合金的特性:熔点一般比成分金属的
硬度比成分金属的硬度一、常见的合金保山一中 朱智荣(1).铜合金青铜:主要含铜和锡----我国使用最早的合金
黄铜:主要含铜和锌
白铜:主要含铜和镍3.常见合金保山一中 朱智荣(2).铁合金① 生铁与钢的比较保山一中 朱智荣② 钢---用量最大,用途最广的合金保山一中 朱智荣(3).其它几种常见合金的组成、性质和用途保山一中 朱智荣1.人类使用材料的进化顺序石器时代铜器时代铁器时代材 料金属材料非金属材料合成高分子材料二、正确选用金属材料保山一中 朱智荣 2. 选用材料的因素:主要用途、外观、物理性质、
化学性质、价格、加工难度、
日常维护、对环境的影响等。保山一中 朱智荣K金是在黄金中添加少量银、铜、锌等金属,以增强黄金的强度和韧性。 K金白金是黄金与钯、镍、银和锌
等金属的白色合金 生活中的合金 24K金纯度为99.9%保山一中 朱智荣形状记忆合金原形 放入热水后?? 再放入冷水 记忆合金制
作的眼镜架 记忆合金用
于骨骼固定保山一中 朱智荣未来的金属:钛和钛合金保山一中 朱智荣
第三章 金属及其化合物(复习)
一 .金属的化学性质三. 金属及其化合物的重要应用Na及其化合物Al及其化合物Fe及其化合物二.重要的金属及其化合物保山一中 朱智荣化
学
性
质→1.与氧气等非金属单质反应:如O2、Cl2、S2.与酸( H+)反应:如盐酸、稀硫酸3.与盐反应:(反应条件)4.活泼金属与水反应:5.Al与强碱溶液反应:一 .金属的化学性质金属单质在发生化学反应时,容易 电子,化合价 ,被 。一般都作为 剂,表现
出 性。 失去升高 氧化 还原还原保山一中 朱智荣常温下//加热与O2反应:与盐溶液反应化学性质1. 钠二. 钠及其化合物先与水反应物理性质----特殊性存在与保存2.钠的化合物(1)氧化物Na2O碱性氧化物---与H2O、H+反应Na2O2强氧化性---与H2O、CO2反应 供氧剂、漂白剂保山一中 朱智荣(2)钠盐溶解性溶液碱性与H+反应与碱反应热稳定性Na2CO3NaHCO3保山一中 朱智荣 3. 钠的化合物相互关系 《名师》 : P 114保山一中 朱智荣常温下//点燃与O2反应:与强碱溶液(OH- )反应化学性质1.铝三.铝及其化合物物理性质----特殊性存在2. 铝的化合物(1)氧化铝---两性氧化物与H+反应与强碱溶液(OH- )反应耐火材料保山一中 朱智荣(2)氢氧化铝制备:两性氢氧化物 物理性质 化学性质:用途(3)明矾 KAl(SO4)2 == K+ + Al3+ + 2SO42-Al3++ 3NH3·H2O保山一中 朱智荣
AlO2? Al(OH)3 Al3+ AlAl2O3① O2② OH_③ H+④ OH_⑨ H+⑩ H+⑧ OH_⑦ OH_⑤ H+⑥ 加热 3.铝的化合物相互关系保山一中 朱智荣常温下//加热与O2反应:化学性质1.铁四. 铁及其化合物物理性质----特殊性存在2. 铁的化合物(1)氧化物---碱性氧化物:与H+反应FeO
Fe2O3
Fe3O4保山一中 朱智荣Fe 2+Fe 3+氧化剂(2)氢氧化物(3)铁盐与亚铁盐制备: Fe 3+和Fe 2+与碱溶液反应性质Fe3+的检验Fe2+和Fe3+的转化不溶于水与H+反应 稳 定 性还原剂保山一中 朱智荣FeFe3O4FeCl3Fe(OH)2Fe(OH)3FeCl2Fe2O3①②③④⑤⑥⑦⑧⑨ 3. 铁的化合物相互关系保山一中 朱智荣1. 焰色反应物理变化应用:物质鉴别如: Na+ 、K+五. 金属及其化合物的重要应用3. 常见合金2.铝盐和铁盐的净水作用:在水中形成Fe(OH)3胶体Al(OH)3胶体 概念特性 用途4. 铜及其化合物六. 物质的量在化学方程式计算中的应用
