6.2.1化学反应的速率 课件.pptx
文档属性
| 名称 | 6.2.1化学反应的速率 课件.pptx |

|
|
| 格式 | zip | ||
| 文件大小 | 80.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-01 10:43:49 | ||
图片预览






文档简介
(共17张PPT)
吴 彦
化学反应的速率
第六章 化学反应与能量
第2节 化学反应的速率与限度
弗里茨·哈伯
卡尔·博施
格哈德·埃特尔
三位德国化学家哈伯、博施、埃特尔分别于1918年、1931年、2007年在合成氨领域研究获诺贝尔奖。
课题引入
1908年7月德国化学家弗里茨·哈伯在实验室用氮气和氢气合成出氨,产率仅有2%,却是人工合成氨技术的重大突破。1918年哈伯“由于从单质合成氨的研究”获诺贝尔化学奖。
课题引入
1931年,德国化学家卡尔·博施“由于发明和发展化学高压技术”获得诺贝尔化学奖,他改进了合成氨的方法(哈伯-博施法)。
2007 年,德国化学家格哈德·埃特尔“由于他对固体表面化学领域作出开拓性贡献”获得诺贝尔化学奖,他的研究揭示了哈伯-博施合成氨法的原理。
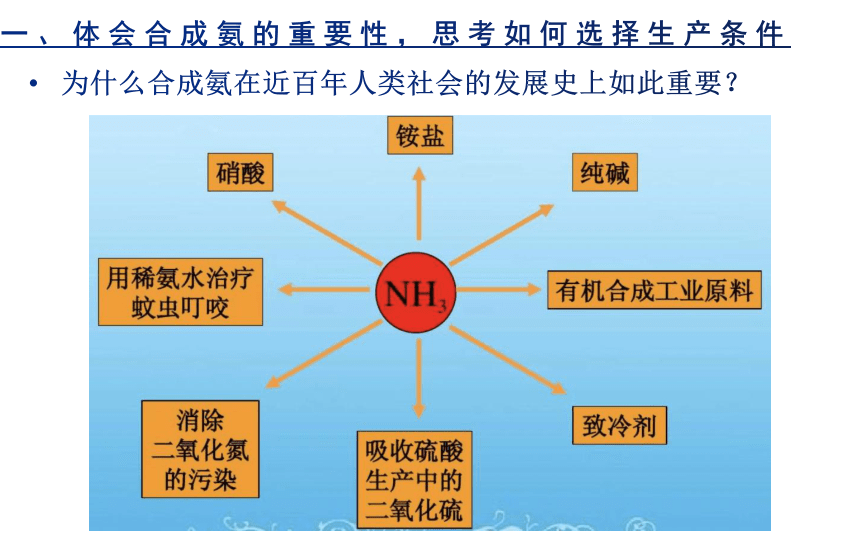
一、体会合成氨的重要性,思考如何选择生产条件
为什么合成氨在近百年人类社会的发展史上如此重要?
二、实验探究影响化学反应速率的常见因素
如果在座的各位同学是某合成氨化工厂的工程师,如何才能选择到最适宜的合成氨反应条件呢?
人们是如何控制反应速率的?影响反应速率的因素有哪些?
如何减缓食物腐败变质?
如何在实验室更快地制取氢气?
为何红热的铁可以与水蒸气发生反应?
如何加快粮食发酵酿酒?
温度
催化剂
浓度
接触面积
二、实验探究影响化学反应速率的常见因素
如何设计实验验证温度、浓度对化学反应速率的影响呢?应该选择有什么样特征的化学反应?
有明显实验现象的化学反应
[实验原理]
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
二、实验探究影响化学反应速率的常见因素
【实验用品】烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、10% H2O2溶液、1 mol/L FeCl3溶液、MnO2粉末、蒸馏水。
[实验原理]
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
二、实验探究影响化学反应速率的常见因素
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol/L Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入水的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 出现浑浊所用的时间(s)
1 2 0 2
2 1 1 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
二、实验探究影响化学反应速率的常见因素
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol/L Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 水浴温度 出现浑浊所用的时间(s)
1 2 2
2 2 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
二、实验探究影响化学反应速率的常见因素
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol/L Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入水的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 出现浑浊所用的时间(s)
1 2 0 2
2 1 1 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
在其他条件相同时,Na2S2O3溶液的浓度越大反应速率越大
二、实验探究影响化学反应速率的常见因素
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol/L Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 水浴温度 出现浑浊所用的时间(s)
1 2 2
2 2 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
在其他条件相同时,升高温度,反应速率增大
二、实验探究影响化学反应速率的常见因素
真实的化工生产中,工程师监测的往往是气体的压强而不是物质的量浓度,二者之间有联系吗?
压强又是如何影响化学反应速率的?
压强增大
气体浓度增大
三、学习化学反应速率的表示方法和计算表达式
如何定量描述反应的快慢?
三、学习化学反应速率的表示方法和计算表达式
化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值)。浓度常以mol/L为单位,时间常以min(分)或s(秒)为单位,化学反应速率的单位相应为mol/(L·min)或mol/(L·s)。
mA(g)+nB(g) pC(g)+gD(g)
v(A)=
v(B)=
v(C)=
v(D)=
三、学习化学反应速率的表示方法和计算表达式
某温度下,在一容积为2L的密闭容器中,加入1mol N2和3mol H2,发生反应∶N2+3H2 2NH3,在2s末时,测得容器中含有0.4mol NH3,求该反应的化学反应速率。
△n(A):△n(B):△n(C):△n(D)=m:n:p:g
N2 + 3H2 2NH3
起始量(mol/L)
0.5
1.5
变化量(mol/L)
2s末时量(mol/L)
0
0.2
0.2
0.3
0.1
0.4
1.2
v(N2)===0.05mol/(L·s)
v(H2)===0.15mol/(L·s)
v(NH3)===0.1mol/(L·s)
v(A):v(B):v(C):v(D)=m:n:p:g
吴 彦
化学反应的速率
第六章 化学反应与能量
第2节 化学反应的速率与限度
弗里茨·哈伯
卡尔·博施
格哈德·埃特尔
三位德国化学家哈伯、博施、埃特尔分别于1918年、1931年、2007年在合成氨领域研究获诺贝尔奖。
课题引入
1908年7月德国化学家弗里茨·哈伯在实验室用氮气和氢气合成出氨,产率仅有2%,却是人工合成氨技术的重大突破。1918年哈伯“由于从单质合成氨的研究”获诺贝尔化学奖。
课题引入
1931年,德国化学家卡尔·博施“由于发明和发展化学高压技术”获得诺贝尔化学奖,他改进了合成氨的方法(哈伯-博施法)。
2007 年,德国化学家格哈德·埃特尔“由于他对固体表面化学领域作出开拓性贡献”获得诺贝尔化学奖,他的研究揭示了哈伯-博施合成氨法的原理。
一、体会合成氨的重要性,思考如何选择生产条件
为什么合成氨在近百年人类社会的发展史上如此重要?
二、实验探究影响化学反应速率的常见因素
如果在座的各位同学是某合成氨化工厂的工程师,如何才能选择到最适宜的合成氨反应条件呢?
人们是如何控制反应速率的?影响反应速率的因素有哪些?
如何减缓食物腐败变质?
如何在实验室更快地制取氢气?
为何红热的铁可以与水蒸气发生反应?
如何加快粮食发酵酿酒?
温度
催化剂
浓度
接触面积
二、实验探究影响化学反应速率的常见因素
如何设计实验验证温度、浓度对化学反应速率的影响呢?应该选择有什么样特征的化学反应?
有明显实验现象的化学反应
[实验原理]
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
二、实验探究影响化学反应速率的常见因素
【实验用品】烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、10% H2O2溶液、1 mol/L FeCl3溶液、MnO2粉末、蒸馏水。
[实验原理]
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
二、实验探究影响化学反应速率的常见因素
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol/L Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入水的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 出现浑浊所用的时间(s)
1 2 0 2
2 1 1 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
二、实验探究影响化学反应速率的常见因素
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol/L Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 水浴温度 出现浑浊所用的时间(s)
1 2 2
2 2 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
二、实验探究影响化学反应速率的常见因素
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 mol/L Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入水的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 出现浑浊所用的时间(s)
1 2 0 2
2 1 1 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
在其他条件相同时,Na2S2O3溶液的浓度越大反应速率越大
二、实验探究影响化学反应速率的常见因素
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 mol/L Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 mol/L H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
实验编号 加入0.1mol/L Na2S2O3溶液的体积(ml) 加入0.1mol/L H2SO4溶液的体积(ml) 水浴温度 出现浑浊所用的时间(s)
1 2 2
2 2 2
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
在其他条件相同时,升高温度,反应速率增大
二、实验探究影响化学反应速率的常见因素
真实的化工生产中,工程师监测的往往是气体的压强而不是物质的量浓度,二者之间有联系吗?
压强又是如何影响化学反应速率的?
压强增大
气体浓度增大
三、学习化学反应速率的表示方法和计算表达式
如何定量描述反应的快慢?
三、学习化学反应速率的表示方法和计算表达式
化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值)。浓度常以mol/L为单位,时间常以min(分)或s(秒)为单位,化学反应速率的单位相应为mol/(L·min)或mol/(L·s)。
mA(g)+nB(g) pC(g)+gD(g)
v(A)=
v(B)=
v(C)=
v(D)=
三、学习化学反应速率的表示方法和计算表达式
某温度下,在一容积为2L的密闭容器中,加入1mol N2和3mol H2,发生反应∶N2+3H2 2NH3,在2s末时,测得容器中含有0.4mol NH3,求该反应的化学反应速率。
△n(A):△n(B):△n(C):△n(D)=m:n:p:g
N2 + 3H2 2NH3
起始量(mol/L)
0.5
1.5
变化量(mol/L)
2s末时量(mol/L)
0
0.2
0.2
0.3
0.1
0.4
1.2
v(N2)===0.05mol/(L·s)
v(H2)===0.15mol/(L·s)
v(NH3)===0.1mol/(L·s)
v(A):v(B):v(C):v(D)=m:n:p:g
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
