7.1认识有机化合物 课件.pptx
文档属性
| 名称 | 7.1认识有机化合物 课件.pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-01 10:46:45 | ||
图片预览








文档简介
(共23张PPT)
吴 彦
有机化合物中
碳原子的成键特点
第七章 有机化合物
第1节 认识有机物
一、创设情境,引出课题
CH4
C2H6O
C2H4
C2H4O2
有机物在组成上有什么特点?
有机物种类为什么如此繁多呢?
二、原子成键数目探究
碳原子要达到稳定结构,应该如何成键?
①画出碳原子结构示意图,小组讨论碳原子形成共价键的特点,探讨达到稳定结构的成键方式。
②选用1个碳原子、1个氯原子,氢原子数目任选,搭建出合理的有机物分子模型,并说明理由。
③选用1个碳原子,氢原子数目任选,搭建出你认为合理的有机物分子模型,并展示作品说明理由。
①碳原子最外层有4个电子,可以通过共用4对电子达到稳定结构。
②碳原子可以与氢原子、氯原子、氧原子等原子形成共价键。
③使用球棍模型可以将微观的分子结构直观呈现出来——模型法。
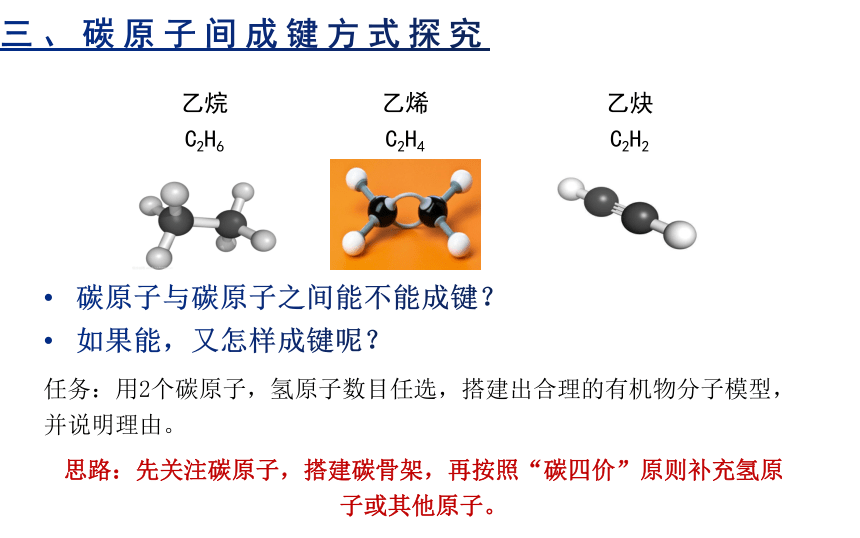
三、碳原子间成键方式探究
碳原子与碳原子之间能不能成键?
如果能,又怎样成键呢?
任务:用2个碳原子,氢原子数目任选,搭建出合理的有机物分子模型,并说明理由。
乙烷C2H6
乙烯C2H4
乙炔C2H2
思路:先关注碳原子,搭建碳骨架,再按照“碳四价”原则补充氢原子或其他原子。
四、碳骨架的结合方式探究
由更多碳原子形成的碳骨架又有那些结合方式呢?
①用3个碳原子,以碳碳单键相连,搭建合理的有机物的碳骨架。
②用4个碳原子,以碳碳单键相连,搭建合理的有机物的链状碳骨架。
③给含4个碳原子的碳骨架补充氢原子,并书写分子式。
丙烷C3H8
丁烷C4H10
环丙烷C3H6
环丁烷C4H8
正丁烷
异丁烷
甲基环丙烷?
同分异构现象
直链
支链
五、小结归纳,练习巩固
甲烷分子是正四面体还是平行四边形?
分析以碳为骨架的有机物种类繁多的原因。
碳氢键角109.28°
有机物种类繁多的原因是:
碳原子间的成键方式有单键、双键、三键
多个碳原子间的结合方式有链状、环状,其中链状又分直链、支链
有机物碳骨架立体构型(分子中各原子的空间位置关系)
归纳总结
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
最简式 乙烷(C2H6)的 最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子;②由最简式可求最简式量
电子式 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①能反映物质的结构;②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构 简式 CH3CH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用,是结构式的简便写法,着重突出结构特点(官能团)
键线式 正丁烷 ( ) 省略碳、氢元素符号,用线段或折线表示分子中键的连接情况的式子
球棍 模型 小球表示原子,小棍表示价键,用于表示分子的空间结构(立体形状)
空间填充 模型 ①用不同体积的小球表示不同大小的原子
②用于表示分子中各原子的相对大小和结合顺序
学习笔记p.73
烷 烃
可燃冰的化学成分是什么?
为什么对我国能源生产具有非常重要的意义?
一、创设情境,引入课题
可燃冰主要是甲烷和水在高压低温的条件下形成的类冰状的结晶化合物,是世界公认的一种清洁高效的未来替代能源。
二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
乙烷、丙烷、丁烷的分子式和结构式是怎样的呢?通式?
结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
什么叫烷烃?烷烃在结构上具有什么共同特征?
使碳原子的化合价都达到“饱和”的有机化合物称为饱和烃,也称为烷烃。
二、提炼归纳演绎,形成概念
有机化合物 乙烷 丙烷 丁烷
分子式
结构式
烷烃通式 二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
丁烷的两种结构式有何不同?
碳骨架为直链的称为正丁烷,为支链的称为异丁烷。
像这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象,具有同分异构现象的化合物互称为同分异构体。
正丁烷
异丁烷
三、自学资料,寻找规律
名称 熔点(℃) 沸点(℃) 相对密度(水=1)
甲烷 -182.5 -161.5 0.42(l)
乙烷 -183.3 -88.60 0.45(l)
丙烷 -187.6 -42.09 0.5005(l)
正丁烷 -138.4 -0.50 0.58(l)
正戊烷 -129.8 36.1 0.63
癸烷 -29.7 174.1 0.73
十一烷 -26 196 0.74
十五烷 8.5—10 268 0.7690
十六烷 18.2 286.9 0.7734
十七烷 22—24 292 0.7767
二十烷 36.8 343.4 0.7886
你发现烷烃在熔沸点、密度、状态上有何相似性和递变性
相似性 递变性(随分子中碳原子数增加)
熔、沸点 较低 逐渐升高
密度 比水小 逐渐增大
状态 气态→液态→固态,常温常压下分子中碳原子数n≤4的烷烃为气态
三、自学资料,寻找规律
难溶于水
通常情况下比较稳定
熔沸点随温度升高而增大
p.63
四、宏观辨识,微观探析
【实验7-1】
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
为什么光照时试管内气体的颜色会逐渐变浅?
为什么试管内水面会上升
为什么试管内会出现油状液滴?
四、宏观辨识,微观探析
反应中氯气浓度不断下降
生成了液态的二氯甲烷、三氯甲烷和四氯甲烷
生成的HCl溶于水造成生成物气体的体积减小,试管内压强降低
油状液滴是啥?
演示过程?
四、宏观辨识,微观探析
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应。
甲烷和氯气反应微观上,该反应中化学键是如何断裂和形成的?
五、迁移运用,归纳整理
例题:烷烃在通常情况下比较稳定,在一定条件下也会发生反应,请书写下列练习中的化学方程式,并归纳烷烃的化学性质。
(1)丙烷在氧气中充分燃烧;
(2)甲烷高温分解生成碳和氢气;
(3)乙烷和氯气在光照时发生反应生成一氯乙烷和氯化氢。
通过书写上述化学方程式,烷烃的化学性质主要有哪些
在空气中完全燃烧生成二氧化碳和水,并放出大量的热;
在高温时会分解成含碳原子数更少的其他有机物;
在一定条件下和某些卤素单质可发生取代反应。
CH4+2O2→CO2+2H2O
点燃
CH4→C+2H2
高温
CH4+Cl2→CH3Cl+HCl
点燃
课堂小结
碳骨架
碳原子的成键方式
碳骨架的基本类型
单键
双键
三键
链状结构
环状结构
直链
支链
课堂小结
烷 烃
1.烷烃的分子结构(同系物、同分异构体)
2.烷烃的物理性质
3.烷烃的化学性质
(1)氧化反应
可燃性:
稳定性——不能被酸性KMnO4溶液氧化
(2)受热分解:
(3)取代反应:
4.烷烃的用途
CH4+2O2→CO2+2H2O
点燃
CH4→C+2H2
高温
CH4+Cl2→CH3Cl+HCl
点燃
今日作业
1.梳理课堂笔记。
2.【练透】
吴 彦
有机化合物中
碳原子的成键特点
第七章 有机化合物
第1节 认识有机物
一、创设情境,引出课题
CH4
C2H6O
C2H4
C2H4O2
有机物在组成上有什么特点?
有机物种类为什么如此繁多呢?
二、原子成键数目探究
碳原子要达到稳定结构,应该如何成键?
①画出碳原子结构示意图,小组讨论碳原子形成共价键的特点,探讨达到稳定结构的成键方式。
②选用1个碳原子、1个氯原子,氢原子数目任选,搭建出合理的有机物分子模型,并说明理由。
③选用1个碳原子,氢原子数目任选,搭建出你认为合理的有机物分子模型,并展示作品说明理由。
①碳原子最外层有4个电子,可以通过共用4对电子达到稳定结构。
②碳原子可以与氢原子、氯原子、氧原子等原子形成共价键。
③使用球棍模型可以将微观的分子结构直观呈现出来——模型法。
三、碳原子间成键方式探究
碳原子与碳原子之间能不能成键?
如果能,又怎样成键呢?
任务:用2个碳原子,氢原子数目任选,搭建出合理的有机物分子模型,并说明理由。
乙烷C2H6
乙烯C2H4
乙炔C2H2
思路:先关注碳原子,搭建碳骨架,再按照“碳四价”原则补充氢原子或其他原子。
四、碳骨架的结合方式探究
由更多碳原子形成的碳骨架又有那些结合方式呢?
①用3个碳原子,以碳碳单键相连,搭建合理的有机物的碳骨架。
②用4个碳原子,以碳碳单键相连,搭建合理的有机物的链状碳骨架。
③给含4个碳原子的碳骨架补充氢原子,并书写分子式。
丙烷C3H8
丁烷C4H10
环丙烷C3H6
环丁烷C4H8
正丁烷
异丁烷
甲基环丙烷?
同分异构现象
直链
支链
五、小结归纳,练习巩固
甲烷分子是正四面体还是平行四边形?
分析以碳为骨架的有机物种类繁多的原因。
碳氢键角109.28°
有机物种类繁多的原因是:
碳原子间的成键方式有单键、双键、三键
多个碳原子间的结合方式有链状、环状,其中链状又分直链、支链
有机物碳骨架立体构型(分子中各原子的空间位置关系)
归纳总结
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
最简式 乙烷(C2H6)的 最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子;②由最简式可求最简式量
电子式 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①能反映物质的结构;②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构 简式 CH3CH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用,是结构式的简便写法,着重突出结构特点(官能团)
键线式 正丁烷 ( ) 省略碳、氢元素符号,用线段或折线表示分子中键的连接情况的式子
球棍 模型 小球表示原子,小棍表示价键,用于表示分子的空间结构(立体形状)
空间填充 模型 ①用不同体积的小球表示不同大小的原子
②用于表示分子中各原子的相对大小和结合顺序
学习笔记p.73
烷 烃
可燃冰的化学成分是什么?
为什么对我国能源生产具有非常重要的意义?
一、创设情境,引入课题
可燃冰主要是甲烷和水在高压低温的条件下形成的类冰状的结晶化合物,是世界公认的一种清洁高效的未来替代能源。
二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
乙烷、丙烷、丁烷的分子式和结构式是怎样的呢?通式?
结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
什么叫烷烃?烷烃在结构上具有什么共同特征?
使碳原子的化合价都达到“饱和”的有机化合物称为饱和烃,也称为烷烃。
二、提炼归纳演绎,形成概念
有机化合物 乙烷 丙烷 丁烷
分子式
结构式
烷烃通式 二、提炼归纳演绎,形成概念
乙烷
丙烷
丁烷
丁烷的两种结构式有何不同?
碳骨架为直链的称为正丁烷,为支链的称为异丁烷。
像这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象,具有同分异构现象的化合物互称为同分异构体。
正丁烷
异丁烷
三、自学资料,寻找规律
名称 熔点(℃) 沸点(℃) 相对密度(水=1)
甲烷 -182.5 -161.5 0.42(l)
乙烷 -183.3 -88.60 0.45(l)
丙烷 -187.6 -42.09 0.5005(l)
正丁烷 -138.4 -0.50 0.58(l)
正戊烷 -129.8 36.1 0.63
癸烷 -29.7 174.1 0.73
十一烷 -26 196 0.74
十五烷 8.5—10 268 0.7690
十六烷 18.2 286.9 0.7734
十七烷 22—24 292 0.7767
二十烷 36.8 343.4 0.7886
你发现烷烃在熔沸点、密度、状态上有何相似性和递变性
相似性 递变性(随分子中碳原子数增加)
熔、沸点 较低 逐渐升高
密度 比水小 逐渐增大
状态 气态→液态→固态,常温常压下分子中碳原子数n≤4的烷烃为气态
三、自学资料,寻找规律
难溶于水
通常情况下比较稳定
熔沸点随温度升高而增大
p.63
四、宏观辨识,微观探析
【实验7-1】
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
为什么光照时试管内气体的颜色会逐渐变浅?
为什么试管内水面会上升
为什么试管内会出现油状液滴?
四、宏观辨识,微观探析
反应中氯气浓度不断下降
生成了液态的二氯甲烷、三氯甲烷和四氯甲烷
生成的HCl溶于水造成生成物气体的体积减小,试管内压强降低
油状液滴是啥?
演示过程?
四、宏观辨识,微观探析
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应。
甲烷和氯气反应微观上,该反应中化学键是如何断裂和形成的?
五、迁移运用,归纳整理
例题:烷烃在通常情况下比较稳定,在一定条件下也会发生反应,请书写下列练习中的化学方程式,并归纳烷烃的化学性质。
(1)丙烷在氧气中充分燃烧;
(2)甲烷高温分解生成碳和氢气;
(3)乙烷和氯气在光照时发生反应生成一氯乙烷和氯化氢。
通过书写上述化学方程式,烷烃的化学性质主要有哪些
在空气中完全燃烧生成二氧化碳和水,并放出大量的热;
在高温时会分解成含碳原子数更少的其他有机物;
在一定条件下和某些卤素单质可发生取代反应。
CH4+2O2→CO2+2H2O
点燃
CH4→C+2H2
高温
CH4+Cl2→CH3Cl+HCl
点燃
课堂小结
碳骨架
碳原子的成键方式
碳骨架的基本类型
单键
双键
三键
链状结构
环状结构
直链
支链
课堂小结
烷 烃
1.烷烃的分子结构(同系物、同分异构体)
2.烷烃的物理性质
3.烷烃的化学性质
(1)氧化反应
可燃性:
稳定性——不能被酸性KMnO4溶液氧化
(2)受热分解:
(3)取代反应:
4.烷烃的用途
CH4+2O2→CO2+2H2O
点燃
CH4→C+2H2
高温
CH4+Cl2→CH3Cl+HCl
点燃
今日作业
1.梳理课堂笔记。
2.【练透】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
