第4节 常见的碱(2课时)
图片预览










文档简介
(共37张PPT)
用化学方程式表示:
①用盐酸与大理石反应产生大量汽包
②用盐酸除铁锈、硫酸除铁锈
③用氯化钡检验硫酸的存在和盐酸与鸡蛋壳反应
④用硝酸银检验盐酸的存在
Al(OH)3+3HCl=AlCl3+3H2O
6HCl+Fe2O3=2FeCl3+3H2O
BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3+HCl=AgCl↓+HNO3
碱性食物:
大豆
香蕉
菠菜
碱性药物:
氢氧化镁和氢氧化铝
可以治疗胃酸过多症
碱性物质:
洗涤剂
生活中的碱
性物质
实验室里几种常见的碱
NaOH
KOH
Ca(OH)2
Cu(OH)2
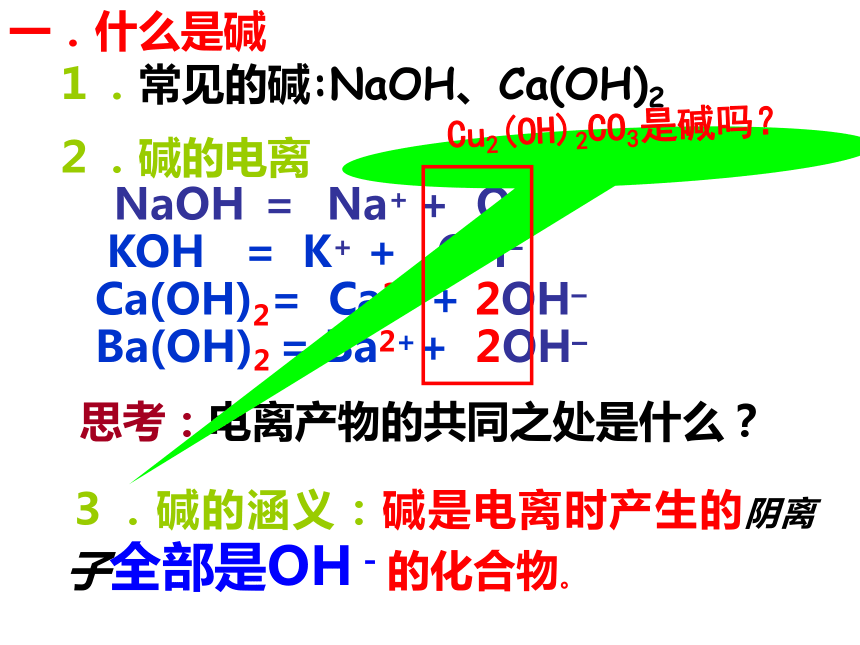
思考:电离产物的共同之处是什么?
NaOH = Na+ + OH–
Ca(OH)2= Ca2+ + 2OH–
Ba(OH)2 = Ba2++ 2OH–
KOH = K+ + OH–
3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。
2.碱的电离
一.什么是碱
1.常见的碱:NaOH、Ca(OH)2
Cu2(OH)2CO3是碱吗?
变化
性质
用途
在研究了酸的性质后,我们知道认识物质有一定的方法,例如,对一类物质中的典型物质进行分析,用对比试验的方法寻找物质的特性,从物质的变化归纳其性质,从物质的性质推测其用途,在研究碱时我们也可以这样。
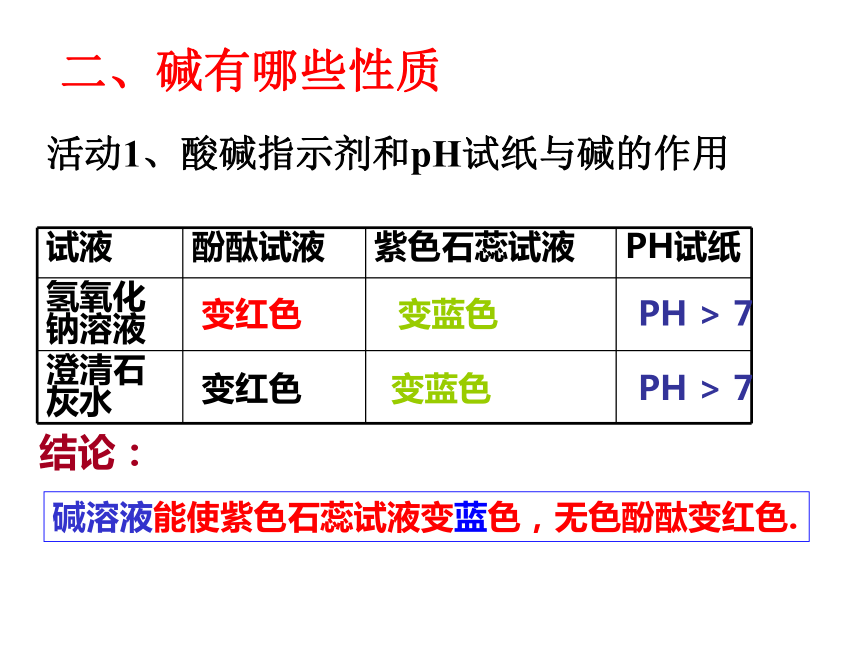
试液 酚酞试液 紫色石蕊试液 PH试纸
氢氧化
钠溶液
澄清石灰水
变红色
变蓝色
PH > 7
变红色
变蓝色
PH > 7
碱溶液能使紫色石蕊试液变蓝色,无色酚酞变红色.
结论:
二、碱有哪些性质
活动1、酸碱指示剂和pH试纸与碱的作用
活动2:氢氧化钠溶液与酸反应
1、在2支分别盛有少量氢氧化钠稀溶液的试管里,各滴入1滴酚酞试液,溶液变( ),分别向2支试管里逐滴加稀盐酸和稀硫酸,边滴边振荡,直到( )刚好消失。
2、颜色的变化说明了什么问题?
红色
红色
2.碱能与酸反应(补充)
氢氧化钠与稀盐酸、稀硫酸反应
3、请分别写出化学方程式:
化学方程式:
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
2、碱能跟酸反应
结论:
通式: 碱+ 酸 = 盐 + 水
3、二氧化硫与氢氧化钠反应。
根据这样性质,氢氧化钠有什么用途?
SO2+2NaOH=Na2SO3+H2O
吸收工厂排放废气中的二氧化硫等酸性气体,防止污染大气。
[实验]
向一支盛有澄清石灰水的试管中通入二氧化碳,观察发生了什么现象:
[化学反应方程式]:
澄清石灰水变浑浊。
这一反应常被用来检验二氧化碳的存在。
CO2 + Ca(OH)2 = CaCO3↓+ H2O
1、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞,而是用橡皮塞或木塞?
SiO2+2NaOH=Na2SiO3+H2O
2、氢氧化钠固体或氢氧化钠溶液不能敞口放置,这是为什么?
CO2+2NaOH=Na2CO3+H2O
结论:非金属氧化物+碱 = 盐 + 水
分析得出:
思考:
[实验]
1、在2支试管中分别注入2-3毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?
氯化铜溶液显蓝色,氯化铁溶液显黄色。
2、在上述2支试管中分别滴加1毫升氢氧化钠溶液,试管中发生了什么变化?
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
蓝色 无色 蓝色絮状沉淀
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
黄色 红褐色絮状沉淀
[化学方程式]:
结论:碱 +盐= 另一种碱 + 另一种盐
碱具有哪些共性?
1、碱的水溶液能使紫色石蕊变蓝,无色酚酞变红.
2、碱跟酸作用生成盐和水
3、碱跟非金属氧化物反应生成盐和水
4、碱和盐反应生成另一种碱 和另一种盐
碱具有共性的本质是什么?
OH-
(可溶性碱)
二、碱的化学性质
1、碱性物质能使酸碱指示剂呈一定的颜色;
(碱能使紫色石蕊试液变蓝色,使无色酚酞试液变红)
2、碱能跟酸作用生成盐和水,即发生中和反应;
3、碱能和某些非金属氧化物反应生成盐和水;
4、碱能和某些盐反应生成另一种碱和另一种盐。
一、碱的涵义:
1.下列物质不属于碱类物质的是( )
A.纯碱(Na2CO3)
B.氢氧化铁[Fe(OH)3]
C.氢氧化钡[Ba(OH)2]
D.消石灰[Ca(OH)2]
A
2、由下列各组中的三种元素组成的化合物,属于碱的一组是( )
A· Na、S、O
B· Cu、O、H
C· C、H、O
D· S、O、H
B
3.为了鉴别氢氧化钠、水、稀硫酸三种无色溶液,最简单的方法是分别各取少量的液体,滴入( )
A、碳酸钠溶液
B、紫色石蕊试液
C、氯化钡溶液
D、无色酚酞试液
B
4.在氢氧化钠溶液里加入1~2滴酚酞试液,然后逐渐滴入稀盐酸,直到反应完成.在整个过程中溶液的颜色变化为( )
A.红色→无色→红色
B.红色→无色→无色
C.无色→红色→无色
D.无色→蓝色→无色
C
5、可以用来区别氢氧化钠和氢氧化钙的是( )
A 紫色石蕊试液 B 无色酚酞试液
C 二氧化碳气体 D 氯化钠溶液
C
6、下列关于碱的性质的叙述,错误的是( )
A 碱溶液中滴入紫色石蕊试液变蓝色。
B 非金属氧化物都能跟碱反应生成盐和水。
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应。
D、 碱溶液只能跟某些盐发生反应。
B
一、氢氧化钠(化学式:NaOH )
1、俗名:烧碱、火碱和苛性钠
2、氢氧化钠用途
烧 碱
1、用药匙取出少许NaOH固体
放在表面皿上如图观察刚取出的NaOH颜色、状态、表面干燥情况,放置几分钟后表面状态有什么变化?
白色固体、能吸收空气中的水分而潮解。
可见:氢氧化钠固体也可以作某些气体(如H2、O2、N2 )的干燥剂。
物质暴露在空气中因吸收空气中的水分,表面潮湿并逐渐溶解的现象叫潮解
实验
现象 性质 用途
氢氧化钠是一种碱性干燥剂
干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)
注意:不能干燥酸性气体
(HCl、CO2、SO2、H2S等)
2、 将玻璃皿中的NaOH移入试管中,加入少量水(3ml左右),用手触摸试管底部,注意温度有什么变化。
极易溶于水、溶解时放出大量的热。
4、 1) 用玻璃棒沾取少量溶液。
2) 将得到的溶液抹在纸上,过一会儿观察到什么现象?
具有强烈的腐蚀性
3、把一小撮兔毛放入盛有烧碱溶液的试管中,加热煮沸后观察现象:
兔毛溶解
羊毛在碱性条件下易发生水解即不耐碱。
一、氢氧化钠的个性(NaOH)
① 白色片状固体;
② 能吸收空气中的水分而潮解;
③ 极易溶于水,溶解时放出大量的热;
④ 具有强烈的腐蚀性;能溶解有机物,使用时必须十分小心。
在使用时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。
二、氢氧化钙的个性
① 白色粉末状固体;
②微溶于水,它的溶液俗称石灰水;
③具有腐蚀性。
氢氧化钙对皮肤、衣服等有腐蚀作用。
俗名:熟石灰、消石灰
实验
1)氢氧化钙溶液中滴入盐酸和稀硫酸溶液,观察有什么变化发生?
化学反应方程式:
Ca(OH )2 + 2HCl= Ca Cl2+ 2H2O
Ca(OH )2 + H2SO4= Ca SO4+2H2O
碱 + 酸 = 盐 + 水
2)在碳酸钠溶液和氯化铁溶液中滴加
氢氧化钙溶液,有何变化?
产生白色沉淀和红褐色沉淀
化学反应方程式:
Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH
3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2
碱 + 盐 =另一种碱 + 另一种盐
氢氧化钠
氢氧化钙
俗称
物理性质
化学性质
指示剂
非金属氧化物
酸
盐溶液
火碱、烧碱、苛性钠
消石灰、熟石灰
___色____体,_____溶于水,放出_____、易__可以用作______.
____色粉末,____溶于水,它的水溶液俗称______.
使石蕊试液变——色,使酚酞试液变——色
蓝
红
使石蕊试液变——色
使酚酞试液变——色
蓝
红
CO2+NaOH——
SO2+NaOH——
CO2+Ca(OH)2 ——
NaOH+HCl——
NaOH+H2SO4——
Ca(OH)2 +HCl——
CuCl2+NaOH——
FeCl3 +NaOH——
Na2CO3+Ca(OH)2——
小结:氢氧化钠、氢氧化钙的性质的比较
3、下列对氢氧化钠的描述中,不正确的是( )
A、NaOH固体极易溶于水,溶解时吸收大量的热
B、其水溶液有涩味和滑腻感
C、对皮肤、衣服都有强烈的腐蚀性
D、其水溶液能使紫色石蕊试液变蓝色
2、用一种试剂就能区别盐酸、食盐溶液、澄清石灰水,这种试剂是( )
A、酚酞 B、石蕊试液 C、氯化铁溶液 D、氢氧化钠
B
A
4.用天平称量固体氢氧化钠时,应把氢氧化钠放在( )
A.天平的托盘上 B.滤纸上 C.小烧杯内 D.试管中
C
5:下列物质暴露在空气中,质量增加且变质的是( )
(A)浓硫酸 (B)火碱 (C)水 (D)浓盐酸
B
1.下列属于同一物质的是( )
A.纯碱.烧碱.火碱 B.氢氧化钙.熟石灰.消石灰
C.盐酸.氯化氢.食盐 D.石灰石.生石灰.熟石灰
B
6、某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是 ( )
A. B. C. D.
盐酸
酚酞
石蕊
二氧化碳
D
7.装氢氧化钙溶液的试剂瓶内壁常有一层白色物质,该物质是 ,写出形成的化学方程式: ,并写出除去它的化学方程式: .
碳酸钙(CaCO3)
Ca(OH)2+CO2=CaCO3↓+H2O
2HCl+CaCO3=CaCl2+H2O+CO2↑
8.下列各组物质,要借助酸碱指示剂才能判断反应能否进行的是( )
A.石灰石与盐酸 B.Ba(OH)2+H2SO4
C.Fe2O3+HCl D.NaOH+HCl
A.反应有气体产生:CaCO3+2HCl=CaCl2+CO2 +H2O
B.反应有沉淀产生: Ba(OH)2+H2SO4 =BaSO4 +2H2O
C.反应有黄色溶液产生: Fe2O3+6HCl =2FeCl3 +3H2O
D.反应前后均为无色溶液: NaOH+HCl =NaCl +H2O
D
1、下列关于碱的性质的叙述中,错误的是( )
A、碱溶液中滴入紫色石蕊试液变蓝色
B、非金属氧化物都能跟碱反应生成盐和水
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应
D、只有某些盐能跟碱溶液反应
B
2、下列物质不能与氢氧化钠反应生成盐和水的是
A三氧化硫 B、二氧化硫 C、氧化镁 D硫酸
C
3、下列气体可用氢氧化钠干燥的是( )
A、氯化氢B、氧气 C、二氧化碳 D、二氧化硫
B
1.有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了,在此过程中发生了哪些化学变化 写出有关的化学方程式:
C+O2==CO2
点燃
Ca(OH)2+CO2=CaCO3↓+H2O
2.将集满CO2的大试管倒插入滴有酚酞的石灰水中,看到的现象是 .
原因是 .
红色逐渐消失,石灰水变浑浊,试管液面上升
CO2与石灰水反应生成CaCO3沉淀,碱性消失,且管内气压降低
3.实验室欲制取干燥的CO2,所需药品是( )
A.碳酸钙.稀硫酸.浓硫酸 B.大理石.稀盐酸.浓硫酸
C.石灰石.稀盐酸.苛性钠 D.碳酸钠.稀盐酸.生石灰
B
4.食品公司通常在“**雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下:
干燥剂 DESICCANT
请勿食用 DO NOT EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用 (3)万一误入眼睛,请先用水清洗后,求诊于医师 (4)请慎防取玩
请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是 .(2)“请勿食用”是因为干燥剂吸水后具 .(3)如果误食入口应该 。
CaO+H2O==Ca(OH)2
腐蚀性
服用食醋并大量饮水
6.除去括号内的杂质,写出化学方程式:
(1)NaOH(Ca(OH)2)
(2)NaCl(Na2CO3)
(3)CaO(CaCO3)
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CaCO3==CaO+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
5.如何用纯碱.石灰石.水为原料制烧碱,写出化学方程式并注明反应类型
CaCO3==CaO+CO2↑
CaO+H2O==Ca(OH)2
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
分解反应
化合反应
复分解反应
6、下列关于碱的性质的叙述中,错误的是( )
A、碱溶液中滴入紫色石蕊试液变蓝色
B、非金属氧化物都能跟碱反应生成盐和水
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应
D、只有某些盐能跟碱溶液反应
B
7、下列物质不能与氢氧化钠反应生成盐和水的是
A三氧化硫 B、二氧化硫 C、氧化镁 D硫酸
C
4、下列气体可用氢氧化钠干燥的是( )
A、氯化氢B、氧气 C、二氧化碳 D、二氧化硫
B
8、20克硫酸铜溶液与10克氢氧化钠溶液混合后恰好完全反应,得到1.96克沉淀,求:
(1)生成硫酸钠的质量。
(2)硫酸铜溶液和氢氧化钠溶液的质量分数。
答案:(1)、2·84克
(2)、16%、16%
用化学方程式表示:
①用盐酸与大理石反应产生大量汽包
②用盐酸除铁锈、硫酸除铁锈
③用氯化钡检验硫酸的存在和盐酸与鸡蛋壳反应
④用硝酸银检验盐酸的存在
Al(OH)3+3HCl=AlCl3+3H2O
6HCl+Fe2O3=2FeCl3+3H2O
BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3+HCl=AgCl↓+HNO3
碱性食物:
大豆
香蕉
菠菜
碱性药物:
氢氧化镁和氢氧化铝
可以治疗胃酸过多症
碱性物质:
洗涤剂
生活中的碱
性物质
实验室里几种常见的碱
NaOH
KOH
Ca(OH)2
Cu(OH)2
思考:电离产物的共同之处是什么?
NaOH = Na+ + OH–
Ca(OH)2= Ca2+ + 2OH–
Ba(OH)2 = Ba2++ 2OH–
KOH = K+ + OH–
3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。
2.碱的电离
一.什么是碱
1.常见的碱:NaOH、Ca(OH)2
Cu2(OH)2CO3是碱吗?
变化
性质
用途
在研究了酸的性质后,我们知道认识物质有一定的方法,例如,对一类物质中的典型物质进行分析,用对比试验的方法寻找物质的特性,从物质的变化归纳其性质,从物质的性质推测其用途,在研究碱时我们也可以这样。
试液 酚酞试液 紫色石蕊试液 PH试纸
氢氧化
钠溶液
澄清石灰水
变红色
变蓝色
PH > 7
变红色
变蓝色
PH > 7
碱溶液能使紫色石蕊试液变蓝色,无色酚酞变红色.
结论:
二、碱有哪些性质
活动1、酸碱指示剂和pH试纸与碱的作用
活动2:氢氧化钠溶液与酸反应
1、在2支分别盛有少量氢氧化钠稀溶液的试管里,各滴入1滴酚酞试液,溶液变( ),分别向2支试管里逐滴加稀盐酸和稀硫酸,边滴边振荡,直到( )刚好消失。
2、颜色的变化说明了什么问题?
红色
红色
2.碱能与酸反应(补充)
氢氧化钠与稀盐酸、稀硫酸反应
3、请分别写出化学方程式:
化学方程式:
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
2、碱能跟酸反应
结论:
通式: 碱+ 酸 = 盐 + 水
3、二氧化硫与氢氧化钠反应。
根据这样性质,氢氧化钠有什么用途?
SO2+2NaOH=Na2SO3+H2O
吸收工厂排放废气中的二氧化硫等酸性气体,防止污染大气。
[实验]
向一支盛有澄清石灰水的试管中通入二氧化碳,观察发生了什么现象:
[化学反应方程式]:
澄清石灰水变浑浊。
这一反应常被用来检验二氧化碳的存在。
CO2 + Ca(OH)2 = CaCO3↓+ H2O
1、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞,而是用橡皮塞或木塞?
SiO2+2NaOH=Na2SiO3+H2O
2、氢氧化钠固体或氢氧化钠溶液不能敞口放置,这是为什么?
CO2+2NaOH=Na2CO3+H2O
结论:非金属氧化物+碱 = 盐 + 水
分析得出:
思考:
[实验]
1、在2支试管中分别注入2-3毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?
氯化铜溶液显蓝色,氯化铁溶液显黄色。
2、在上述2支试管中分别滴加1毫升氢氧化钠溶液,试管中发生了什么变化?
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
蓝色 无色 蓝色絮状沉淀
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
黄色 红褐色絮状沉淀
[化学方程式]:
结论:碱 +盐= 另一种碱 + 另一种盐
碱具有哪些共性?
1、碱的水溶液能使紫色石蕊变蓝,无色酚酞变红.
2、碱跟酸作用生成盐和水
3、碱跟非金属氧化物反应生成盐和水
4、碱和盐反应生成另一种碱 和另一种盐
碱具有共性的本质是什么?
OH-
(可溶性碱)
二、碱的化学性质
1、碱性物质能使酸碱指示剂呈一定的颜色;
(碱能使紫色石蕊试液变蓝色,使无色酚酞试液变红)
2、碱能跟酸作用生成盐和水,即发生中和反应;
3、碱能和某些非金属氧化物反应生成盐和水;
4、碱能和某些盐反应生成另一种碱和另一种盐。
一、碱的涵义:
1.下列物质不属于碱类物质的是( )
A.纯碱(Na2CO3)
B.氢氧化铁[Fe(OH)3]
C.氢氧化钡[Ba(OH)2]
D.消石灰[Ca(OH)2]
A
2、由下列各组中的三种元素组成的化合物,属于碱的一组是( )
A· Na、S、O
B· Cu、O、H
C· C、H、O
D· S、O、H
B
3.为了鉴别氢氧化钠、水、稀硫酸三种无色溶液,最简单的方法是分别各取少量的液体,滴入( )
A、碳酸钠溶液
B、紫色石蕊试液
C、氯化钡溶液
D、无色酚酞试液
B
4.在氢氧化钠溶液里加入1~2滴酚酞试液,然后逐渐滴入稀盐酸,直到反应完成.在整个过程中溶液的颜色变化为( )
A.红色→无色→红色
B.红色→无色→无色
C.无色→红色→无色
D.无色→蓝色→无色
C
5、可以用来区别氢氧化钠和氢氧化钙的是( )
A 紫色石蕊试液 B 无色酚酞试液
C 二氧化碳气体 D 氯化钠溶液
C
6、下列关于碱的性质的叙述,错误的是( )
A 碱溶液中滴入紫色石蕊试液变蓝色。
B 非金属氧化物都能跟碱反应生成盐和水。
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应。
D、 碱溶液只能跟某些盐发生反应。
B
一、氢氧化钠(化学式:NaOH )
1、俗名:烧碱、火碱和苛性钠
2、氢氧化钠用途
烧 碱
1、用药匙取出少许NaOH固体
放在表面皿上如图观察刚取出的NaOH颜色、状态、表面干燥情况,放置几分钟后表面状态有什么变化?
白色固体、能吸收空气中的水分而潮解。
可见:氢氧化钠固体也可以作某些气体(如H2、O2、N2 )的干燥剂。
物质暴露在空气中因吸收空气中的水分,表面潮湿并逐渐溶解的现象叫潮解
实验
现象 性质 用途
氢氧化钠是一种碱性干燥剂
干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)
注意:不能干燥酸性气体
(HCl、CO2、SO2、H2S等)
2、 将玻璃皿中的NaOH移入试管中,加入少量水(3ml左右),用手触摸试管底部,注意温度有什么变化。
极易溶于水、溶解时放出大量的热。
4、 1) 用玻璃棒沾取少量溶液。
2) 将得到的溶液抹在纸上,过一会儿观察到什么现象?
具有强烈的腐蚀性
3、把一小撮兔毛放入盛有烧碱溶液的试管中,加热煮沸后观察现象:
兔毛溶解
羊毛在碱性条件下易发生水解即不耐碱。
一、氢氧化钠的个性(NaOH)
① 白色片状固体;
② 能吸收空气中的水分而潮解;
③ 极易溶于水,溶解时放出大量的热;
④ 具有强烈的腐蚀性;能溶解有机物,使用时必须十分小心。
在使用时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。
二、氢氧化钙的个性
① 白色粉末状固体;
②微溶于水,它的溶液俗称石灰水;
③具有腐蚀性。
氢氧化钙对皮肤、衣服等有腐蚀作用。
俗名:熟石灰、消石灰
实验
1)氢氧化钙溶液中滴入盐酸和稀硫酸溶液,观察有什么变化发生?
化学反应方程式:
Ca(OH )2 + 2HCl= Ca Cl2+ 2H2O
Ca(OH )2 + H2SO4= Ca SO4+2H2O
碱 + 酸 = 盐 + 水
2)在碳酸钠溶液和氯化铁溶液中滴加
氢氧化钙溶液,有何变化?
产生白色沉淀和红褐色沉淀
化学反应方程式:
Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH
3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2
碱 + 盐 =另一种碱 + 另一种盐
氢氧化钠
氢氧化钙
俗称
物理性质
化学性质
指示剂
非金属氧化物
酸
盐溶液
火碱、烧碱、苛性钠
消石灰、熟石灰
___色____体,_____溶于水,放出_____、易__可以用作______.
____色粉末,____溶于水,它的水溶液俗称______.
使石蕊试液变——色,使酚酞试液变——色
蓝
红
使石蕊试液变——色
使酚酞试液变——色
蓝
红
CO2+NaOH——
SO2+NaOH——
CO2+Ca(OH)2 ——
NaOH+HCl——
NaOH+H2SO4——
Ca(OH)2 +HCl——
CuCl2+NaOH——
FeCl3 +NaOH——
Na2CO3+Ca(OH)2——
小结:氢氧化钠、氢氧化钙的性质的比较
3、下列对氢氧化钠的描述中,不正确的是( )
A、NaOH固体极易溶于水,溶解时吸收大量的热
B、其水溶液有涩味和滑腻感
C、对皮肤、衣服都有强烈的腐蚀性
D、其水溶液能使紫色石蕊试液变蓝色
2、用一种试剂就能区别盐酸、食盐溶液、澄清石灰水,这种试剂是( )
A、酚酞 B、石蕊试液 C、氯化铁溶液 D、氢氧化钠
B
A
4.用天平称量固体氢氧化钠时,应把氢氧化钠放在( )
A.天平的托盘上 B.滤纸上 C.小烧杯内 D.试管中
C
5:下列物质暴露在空气中,质量增加且变质的是( )
(A)浓硫酸 (B)火碱 (C)水 (D)浓盐酸
B
1.下列属于同一物质的是( )
A.纯碱.烧碱.火碱 B.氢氧化钙.熟石灰.消石灰
C.盐酸.氯化氢.食盐 D.石灰石.生石灰.熟石灰
B
6、某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是 ( )
A. B. C. D.
盐酸
酚酞
石蕊
二氧化碳
D
7.装氢氧化钙溶液的试剂瓶内壁常有一层白色物质,该物质是 ,写出形成的化学方程式: ,并写出除去它的化学方程式: .
碳酸钙(CaCO3)
Ca(OH)2+CO2=CaCO3↓+H2O
2HCl+CaCO3=CaCl2+H2O+CO2↑
8.下列各组物质,要借助酸碱指示剂才能判断反应能否进行的是( )
A.石灰石与盐酸 B.Ba(OH)2+H2SO4
C.Fe2O3+HCl D.NaOH+HCl
A.反应有气体产生:CaCO3+2HCl=CaCl2+CO2 +H2O
B.反应有沉淀产生: Ba(OH)2+H2SO4 =BaSO4 +2H2O
C.反应有黄色溶液产生: Fe2O3+6HCl =2FeCl3 +3H2O
D.反应前后均为无色溶液: NaOH+HCl =NaCl +H2O
D
1、下列关于碱的性质的叙述中,错误的是( )
A、碱溶液中滴入紫色石蕊试液变蓝色
B、非金属氧化物都能跟碱反应生成盐和水
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应
D、只有某些盐能跟碱溶液反应
B
2、下列物质不能与氢氧化钠反应生成盐和水的是
A三氧化硫 B、二氧化硫 C、氧化镁 D硫酸
C
3、下列气体可用氢氧化钠干燥的是( )
A、氯化氢B、氧气 C、二氧化碳 D、二氧化硫
B
1.有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了,在此过程中发生了哪些化学变化 写出有关的化学方程式:
C+O2==CO2
点燃
Ca(OH)2+CO2=CaCO3↓+H2O
2.将集满CO2的大试管倒插入滴有酚酞的石灰水中,看到的现象是 .
原因是 .
红色逐渐消失,石灰水变浑浊,试管液面上升
CO2与石灰水反应生成CaCO3沉淀,碱性消失,且管内气压降低
3.实验室欲制取干燥的CO2,所需药品是( )
A.碳酸钙.稀硫酸.浓硫酸 B.大理石.稀盐酸.浓硫酸
C.石灰石.稀盐酸.苛性钠 D.碳酸钠.稀盐酸.生石灰
B
4.食品公司通常在“**雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下:
干燥剂 DESICCANT
请勿食用 DO NOT EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用 (3)万一误入眼睛,请先用水清洗后,求诊于医师 (4)请慎防取玩
请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是 .(2)“请勿食用”是因为干燥剂吸水后具 .(3)如果误食入口应该 。
CaO+H2O==Ca(OH)2
腐蚀性
服用食醋并大量饮水
6.除去括号内的杂质,写出化学方程式:
(1)NaOH(Ca(OH)2)
(2)NaCl(Na2CO3)
(3)CaO(CaCO3)
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CaCO3==CaO+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
5.如何用纯碱.石灰石.水为原料制烧碱,写出化学方程式并注明反应类型
CaCO3==CaO+CO2↑
CaO+H2O==Ca(OH)2
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
分解反应
化合反应
复分解反应
6、下列关于碱的性质的叙述中,错误的是( )
A、碱溶液中滴入紫色石蕊试液变蓝色
B、非金属氧化物都能跟碱反应生成盐和水
C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应
D、只有某些盐能跟碱溶液反应
B
7、下列物质不能与氢氧化钠反应生成盐和水的是
A三氧化硫 B、二氧化硫 C、氧化镁 D硫酸
C
4、下列气体可用氢氧化钠干燥的是( )
A、氯化氢B、氧气 C、二氧化碳 D、二氧化硫
B
8、20克硫酸铜溶液与10克氢氧化钠溶液混合后恰好完全反应,得到1.96克沉淀,求:
(1)生成硫酸钠的质量。
(2)硫酸铜溶液和氢氧化钠溶液的质量分数。
答案:(1)、2·84克
(2)、16%、16%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
