江苏省六校2022-2023学年高二下学期5月联考化学试题(含答案)
文档属性
| 名称 | 江苏省六校2022-2023学年高二下学期5月联考化学试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-31 10:14:41 | ||
图片预览



文档简介
江苏省六校2022-2023学年高二下学期5月联考
化学试题(5月26日)
试卷满分:100分 考试时长:75分钟
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Se 79
单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.核酸可以看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子。下列不属于核酸组成元素的是
A.氮 B.氧 C.磷 D.硫
2.与在一定条件下反应能生成.下列说法正确的是
A.醛基的电子式为: B.中只含非极性键
C.的球棍模型为 D.是极性分子
3.磷元素有白磷、红磷等单质,白磷()分子结构及晶胞如下图所示,白磷和红磷转化的热化学方程式为(白磷,s)(红磷,s) ;下列说法正确的是
A.分子中的P-P-P键角为109°28'
B.白磷和红磷互为同位素
C.白磷晶体中1个分子周围有8个紧邻的分子
D.白磷和红磷在中充分燃烧生成等量(s),白磷放出的热量更多
阅读下列材料,完成4~5题:
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的。和均为两性氢氧化物,溶于强碱形成。BeO和都具有难溶于水、高熔点等性质。和在气态时通常以二聚体的形式存在,的结构如图所示。B和Si均能溶于NaOH溶液生成盐和氢气。工业上用焦炭和石英砂(主要成分为)在高温条件下反应制得粗硅。硼酸()和硅酸都是弱酸,硼酸晶体有类似于石墨的片层状结构,常用作医用消毒剂、润滑剂等。
4.下列说法正确的是
A.中含有配位键 B.的空间结构为平面正方形
C.中的0-Si-0键角为120° D.晶体中存在的作用力只有共价键
5.下列有关物质的性质与用途具有对应关系的是
A.氧化铍熔点较高,可用作耐火材料 B.硼酸具有弱酸性,可用作润滑剂
C.金属铝质地柔软,可用于冶炼高熔点金属 D.二氧化硅硬度高,可用于制造光导纤维
6.X、Y、Z、W、Q是原子序数依次增大且不超过20的主族元素。X是地壳中含量最多的元素,Y基态原子核外s能级和p能级电子数相等,Z与X同主族,Q的焰色试验呈紫色。下列说法正确的是
A.简单离子半径: B.X的第一电离能比同周期的相邻元素的大
C.Z的简单气态氢化物的热稳定性比W的强 D.Q最高价氧化物对应水化物的碱性比Y的弱
7.、CO共存体系催化加氢是甲烷化的重要反应,总反应可表示为:
.
下列说法正确的是
A.上述反应一定能自发进行
B.上述反应平衡常数表达式
C.上述反应中生成1mol ,转移电子的数目为
D.实际生产中采用适当的高温、合适的催化剂均可提高的平衡产率
8.下列装置或操作能达到目的的是
A.图1分离乙醇和乙酸 B.图2除去甲烷中的乙烯
C.图3除去溴苯中的溴单质 D.图4除去酒精中的乙酸
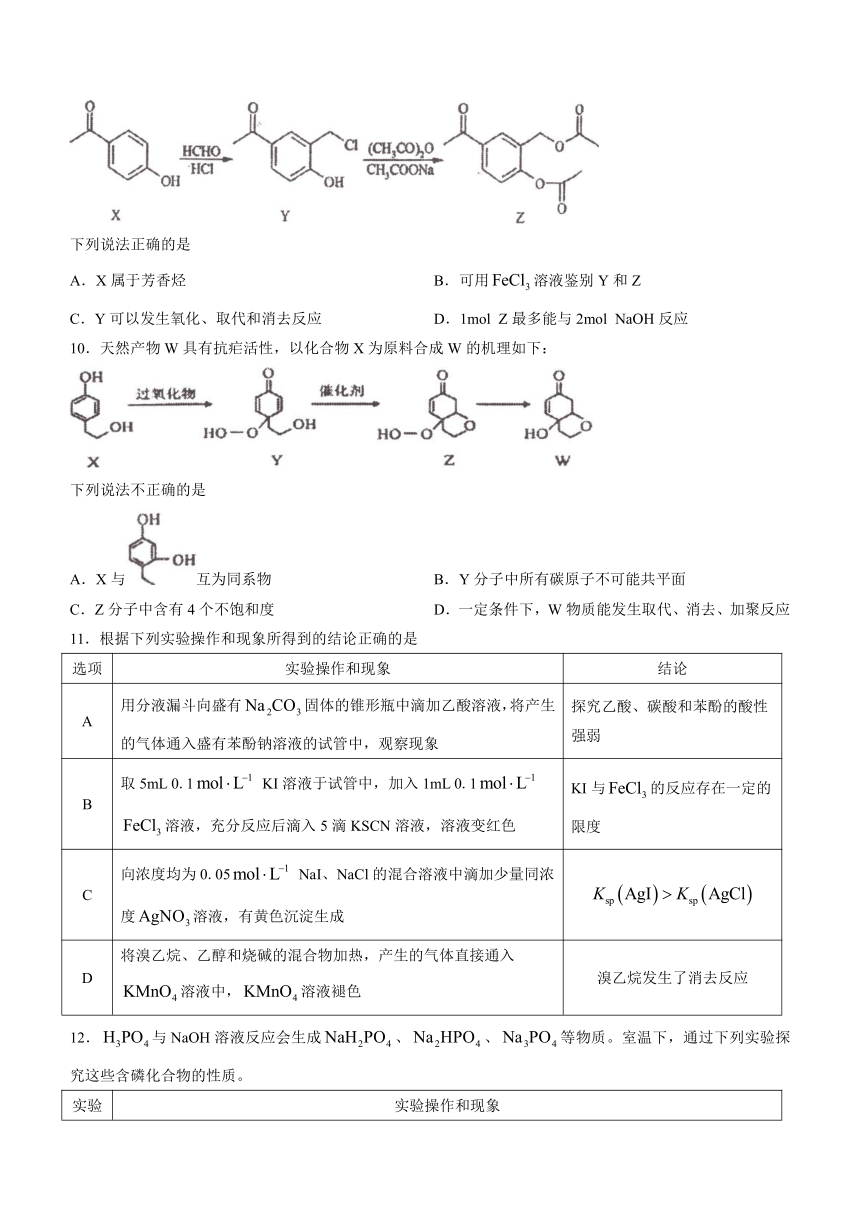
9.化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是
A.X属于芳香烃 B.可用溶液鉴别Y和Z
C.Y可以发生氧化、取代和消去反应 D.1mol Z最多能与2mol NaOH反应
10.天然产物W具有抗疟活性,以化合物X为原料合成W的机理如下:
下列说法不正确的是
A.X与互为同系物 B.Y分子中所有碳原子不可能共平面
C.Z分子中含有4个不饱和度 D.一定条件下,W物质能发生取代、消去、加聚反应
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 用分液漏斗向盛有固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
B 取5mL 0.1 KI溶液于试管中,加入1mL 0.1 溶液,充分反应后滴入5滴KSCN溶液,溶液变红色 KI与的反应存在一定的限度
C 向浓度均为0.05 NaI、NaCl的混合溶液中滴加少量同浓度溶液,有黄色沉淀生成
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体直接通入溶液中,溶液褪色 溴乙烷发生了消去反应
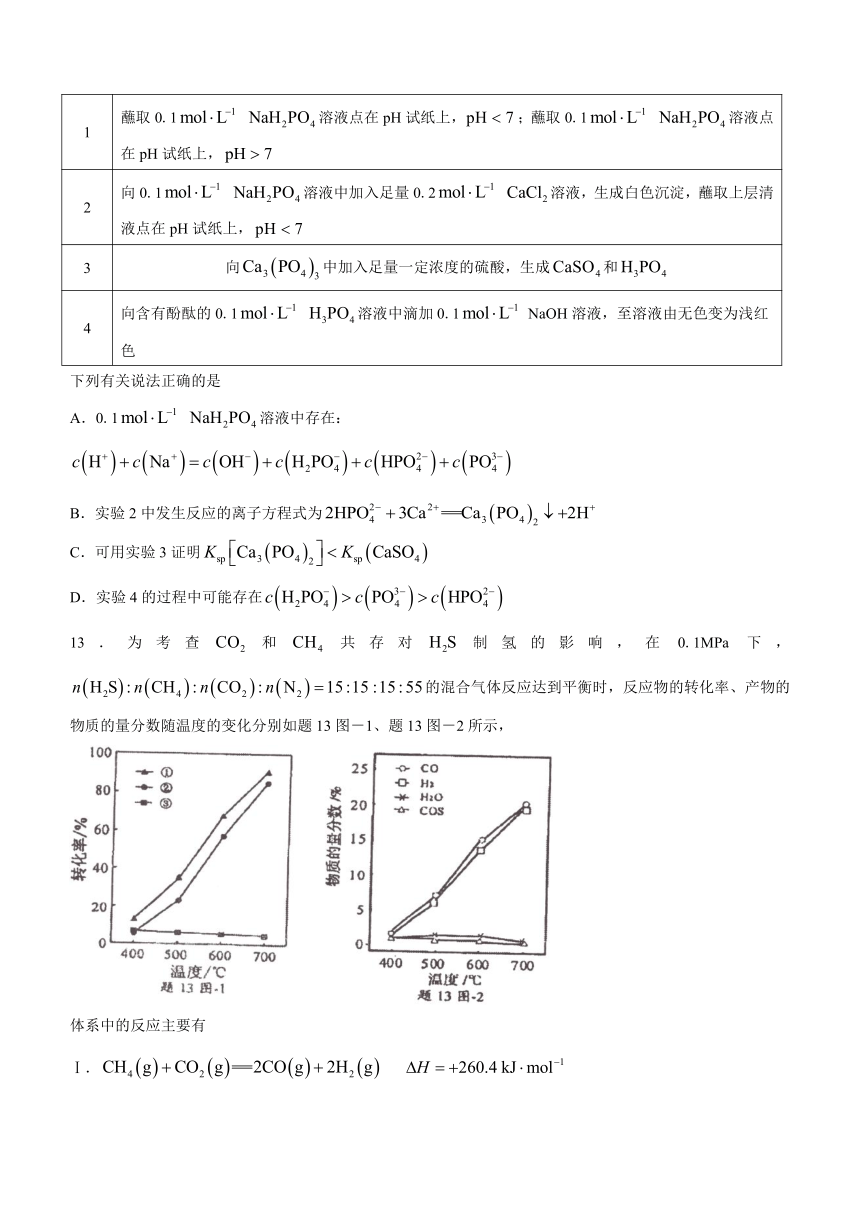
12.与NaOH溶液反应会生成、、等物质。室温下,通过下列实验探究这些含磷化合物的性质。
实验 实验操作和现象
1 蘸取0.1 溶液点在pH试纸上,;蘸取0.1 溶液点在pH试纸上,
2 向0.1 溶液中加入足量0.2 溶液,生成白色沉淀,蘸取上层清液点在pH试纸上,
3 向中加入足量一定浓度的硫酸,生成和
4 向含有酚酞的0.1 溶液中滴加0.1 NaOH溶液,至溶液由无色变为浅红色
下列有关说法正确的是
A.0.1 溶液中存在:
B.实验2中发生反应的离子方程式为
C.可用实验3证明
D.实验4的过程中可能存在
13.为考查和共存对制氢的影响,在0.1MPa下,的混合气体反应达到平衡时,反应物的转化率、产物的物质的量分数随温度的变化分别如题13图-1、题13图-2所示,
体系中的反应主要有
Ⅰ.
Ⅱ.
Ⅲ.
下列说法不正确的是
A.反应
B.题13图-1中曲线①表示转化率随温度的变化
C.温度700℃时,反应Ⅰ是体系中的主要反应
D.反应Ⅲ的平衡常数:
14.(16分)
从铜阳极泥(含有Se、、及少量Au等)中分批提取硒、银、铜、金的过程如下:
已知:
Ⅰ.;
Ⅱ.可与络合:,。
(1)硫原子的核外电子排布中有 个能级。
(2)银的络合离子中存在的化学键有 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键
(3)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是 。
(4)中的空间构型为 。
(5)“沉银”所得AgCl固体可使用溶浸,其原理为,请平衡常数K解释该反应能实现的原因: 。
(6)“还原”得到的Se可用于制备铁硒基电极材料。某铁硒基电极材料晶胞结构如下图所示,其化学式为 。
(7)测定某粗硒样品中硒的含量:准确称量0.2000g粗硒样品,用浓将样品中的Se氧化得到;生成的加入到硫酸酸化的KI溶液中充分反应。用0.4000的标准溶液滴定至终点,消耗溶液20.00mL。计算粗硒样品中硒的质量分数。(写出计算过程)
实验测定原理为:,(未配平)。
。
15.(14分)
化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如下:
(1)化合物E中含氧官能团的名称为 。
(2)化合物A分子中发生、杂化的碳原子数目之比为 。
(3)A→B的反应类型为 。
(4)相同条件下,B的沸点比A的高,其主要原因是 。
(5)B→C的反应中有副产物X()生成,X的结构简式为 。
(6)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4mol NaOH。
16.(14分)
化合物F是一种天然产物合成中的重要中间体,其合成路线如下:
(1)C→D反应的另一种产物为 。
(2)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中含有苯环,碱性条件下能与新制悬浊液反应,生成砖红色沉淀;
②分子中不同化学环境的氢原子数目比为2:2:1。
(3)D→E反应经历D→X→E的过程,D→X发生了加成反应,则X→E反应类型为 。
(4)F含有手性碳原子的数目为 。
(5)设计以和为原料制备的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干) 。
17.(17分)
硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生在大气中发生如下反应:
①
②
写出(g)完全燃烧的热化学方程式 。
(2)工业上可用NaClO碱性溶液吸收。为了提高吸收效率,常用作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对的吸收。该催化过程的示意图如下图所示。也可用于脱硫,且脱硫效果比NaClO更好,原因是 。
(3)氮的氧化物脱除可以利用电化学原理处理,利用下图所示装置可同时吸收和NO。已知:是一种弱酸。
①阴极的电极反应式为 ;
②若无能量损失,相同条件下,和NO的体积比为 时,两种气体都能被完全处理。
(4)已知的反应历程分两步。
第一步:(快反应)
第二步:(慢反应)
用表示的速率方程为;用表示的速率方程为,与分别表示速率常数,
则 。(填数值)
(5)某含磷废水的主要成分是。25℃时,向一定体积的亚磷酸(,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数()与溶液pH的关系如左下图所示。
①的pH 7(填“<”或“>”或“=”)。
②其水解平衡常数 (填数值)。
(6)太阳能光电催化——化学耦合分解的装置如上右图所示。
该太阳能光电催化——化学耦合分解的过程可描述为 。
江苏省六校2022-2023学年高二下学期5月联考
化学参考答案
单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1—5 DCDAA 6—10 ACDBA 11—13 BBD
14.(16分)
(1)5
(2)BCE写对1个得1分,有错不得分,全对得2分
(3)磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高
(4)三角锥形
(5)该反应平衡常数K=5.04x103,反应正向进行的程度较大
(6)KFe2Se2
(7)n(Na2S2O3)=0.4000mol·L-1×20.00mL×10-3L·mL 1=0.008mol
关系式:Se~SeO2~2I2~4Na2S2O3
n(Se)=0.002mol
W=(0.002mol×79g/mol/0.2000g)×100%=79.00%
(计算过程共4分)
15.(14分)
(1)醚键、酰胺键
(2)7:3
(3)还原反应
(4)B分子间存在氢键
(5)
(6)
16.(14分)
(1)HI
(2)
(3)消去反应
(4)1
(5)
(每步1分,全对得5分,条件错熔断)
17.(17分)
(1) QIIUQ :uId: QIIUQ 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=(a+2b)kJ/mol
(2)Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行
(3)① ②1:1
(4)0.5
(5)①< ②10 7.46
(6) OWEYPT :fId: OWEYPT
Fe2+在电极上失电子发生反应Fe2+-e—=Fe3+,生成的Fe3+氧化H2S生成硫单质,离子方程式为,H+通过质子交换膜从a极移向b极,在b极得电子生成H2共
化学试题(5月26日)
试卷满分:100分 考试时长:75分钟
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Se 79
单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.核酸可以看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子。下列不属于核酸组成元素的是
A.氮 B.氧 C.磷 D.硫
2.与在一定条件下反应能生成.下列说法正确的是
A.醛基的电子式为: B.中只含非极性键
C.的球棍模型为 D.是极性分子
3.磷元素有白磷、红磷等单质,白磷()分子结构及晶胞如下图所示,白磷和红磷转化的热化学方程式为(白磷,s)(红磷,s) ;下列说法正确的是
A.分子中的P-P-P键角为109°28'
B.白磷和红磷互为同位素
C.白磷晶体中1个分子周围有8个紧邻的分子
D.白磷和红磷在中充分燃烧生成等量(s),白磷放出的热量更多
阅读下列材料,完成4~5题:
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的。和均为两性氢氧化物,溶于强碱形成。BeO和都具有难溶于水、高熔点等性质。和在气态时通常以二聚体的形式存在,的结构如图所示。B和Si均能溶于NaOH溶液生成盐和氢气。工业上用焦炭和石英砂(主要成分为)在高温条件下反应制得粗硅。硼酸()和硅酸都是弱酸,硼酸晶体有类似于石墨的片层状结构,常用作医用消毒剂、润滑剂等。
4.下列说法正确的是
A.中含有配位键 B.的空间结构为平面正方形
C.中的0-Si-0键角为120° D.晶体中存在的作用力只有共价键
5.下列有关物质的性质与用途具有对应关系的是
A.氧化铍熔点较高,可用作耐火材料 B.硼酸具有弱酸性,可用作润滑剂
C.金属铝质地柔软,可用于冶炼高熔点金属 D.二氧化硅硬度高,可用于制造光导纤维
6.X、Y、Z、W、Q是原子序数依次增大且不超过20的主族元素。X是地壳中含量最多的元素,Y基态原子核外s能级和p能级电子数相等,Z与X同主族,Q的焰色试验呈紫色。下列说法正确的是
A.简单离子半径: B.X的第一电离能比同周期的相邻元素的大
C.Z的简单气态氢化物的热稳定性比W的强 D.Q最高价氧化物对应水化物的碱性比Y的弱
7.、CO共存体系催化加氢是甲烷化的重要反应,总反应可表示为:
.
下列说法正确的是
A.上述反应一定能自发进行
B.上述反应平衡常数表达式
C.上述反应中生成1mol ,转移电子的数目为
D.实际生产中采用适当的高温、合适的催化剂均可提高的平衡产率
8.下列装置或操作能达到目的的是
A.图1分离乙醇和乙酸 B.图2除去甲烷中的乙烯
C.图3除去溴苯中的溴单质 D.图4除去酒精中的乙酸
9.化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是
A.X属于芳香烃 B.可用溶液鉴别Y和Z
C.Y可以发生氧化、取代和消去反应 D.1mol Z最多能与2mol NaOH反应
10.天然产物W具有抗疟活性,以化合物X为原料合成W的机理如下:
下列说法不正确的是
A.X与互为同系物 B.Y分子中所有碳原子不可能共平面
C.Z分子中含有4个不饱和度 D.一定条件下,W物质能发生取代、消去、加聚反应
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 用分液漏斗向盛有固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
B 取5mL 0.1 KI溶液于试管中,加入1mL 0.1 溶液,充分反应后滴入5滴KSCN溶液,溶液变红色 KI与的反应存在一定的限度
C 向浓度均为0.05 NaI、NaCl的混合溶液中滴加少量同浓度溶液,有黄色沉淀生成
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体直接通入溶液中,溶液褪色 溴乙烷发生了消去反应
12.与NaOH溶液反应会生成、、等物质。室温下,通过下列实验探究这些含磷化合物的性质。
实验 实验操作和现象
1 蘸取0.1 溶液点在pH试纸上,;蘸取0.1 溶液点在pH试纸上,
2 向0.1 溶液中加入足量0.2 溶液,生成白色沉淀,蘸取上层清液点在pH试纸上,
3 向中加入足量一定浓度的硫酸,生成和
4 向含有酚酞的0.1 溶液中滴加0.1 NaOH溶液,至溶液由无色变为浅红色
下列有关说法正确的是
A.0.1 溶液中存在:
B.实验2中发生反应的离子方程式为
C.可用实验3证明
D.实验4的过程中可能存在
13.为考查和共存对制氢的影响,在0.1MPa下,的混合气体反应达到平衡时,反应物的转化率、产物的物质的量分数随温度的变化分别如题13图-1、题13图-2所示,
体系中的反应主要有
Ⅰ.
Ⅱ.
Ⅲ.
下列说法不正确的是
A.反应
B.题13图-1中曲线①表示转化率随温度的变化
C.温度700℃时,反应Ⅰ是体系中的主要反应
D.反应Ⅲ的平衡常数:
14.(16分)
从铜阳极泥(含有Se、、及少量Au等)中分批提取硒、银、铜、金的过程如下:
已知:
Ⅰ.;
Ⅱ.可与络合:,。
(1)硫原子的核外电子排布中有 个能级。
(2)银的络合离子中存在的化学键有 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键
(3)数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种原因是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是原因是 。
(4)中的空间构型为 。
(5)“沉银”所得AgCl固体可使用溶浸,其原理为,请平衡常数K解释该反应能实现的原因: 。
(6)“还原”得到的Se可用于制备铁硒基电极材料。某铁硒基电极材料晶胞结构如下图所示,其化学式为 。
(7)测定某粗硒样品中硒的含量:准确称量0.2000g粗硒样品,用浓将样品中的Se氧化得到;生成的加入到硫酸酸化的KI溶液中充分反应。用0.4000的标准溶液滴定至终点,消耗溶液20.00mL。计算粗硒样品中硒的质量分数。(写出计算过程)
实验测定原理为:,(未配平)。
。
15.(14分)
化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如下:
(1)化合物E中含氧官能团的名称为 。
(2)化合物A分子中发生、杂化的碳原子数目之比为 。
(3)A→B的反应类型为 。
(4)相同条件下,B的沸点比A的高,其主要原因是 。
(5)B→C的反应中有副产物X()生成,X的结构简式为 。
(6)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4mol NaOH。
16.(14分)
化合物F是一种天然产物合成中的重要中间体,其合成路线如下:
(1)C→D反应的另一种产物为 。
(2)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中含有苯环,碱性条件下能与新制悬浊液反应,生成砖红色沉淀;
②分子中不同化学环境的氢原子数目比为2:2:1。
(3)D→E反应经历D→X→E的过程,D→X发生了加成反应,则X→E反应类型为 。
(4)F含有手性碳原子的数目为 。
(5)设计以和为原料制备的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干) 。
17.(17分)
硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生在大气中发生如下反应:
①
②
写出(g)完全燃烧的热化学方程式 。
(2)工业上可用NaClO碱性溶液吸收。为了提高吸收效率,常用作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对的吸收。该催化过程的示意图如下图所示。也可用于脱硫,且脱硫效果比NaClO更好,原因是 。
(3)氮的氧化物脱除可以利用电化学原理处理,利用下图所示装置可同时吸收和NO。已知:是一种弱酸。
①阴极的电极反应式为 ;
②若无能量损失,相同条件下,和NO的体积比为 时,两种气体都能被完全处理。
(4)已知的反应历程分两步。
第一步:(快反应)
第二步:(慢反应)
用表示的速率方程为;用表示的速率方程为,与分别表示速率常数,
则 。(填数值)
(5)某含磷废水的主要成分是。25℃时,向一定体积的亚磷酸(,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数()与溶液pH的关系如左下图所示。
①的pH 7(填“<”或“>”或“=”)。
②其水解平衡常数 (填数值)。
(6)太阳能光电催化——化学耦合分解的装置如上右图所示。
该太阳能光电催化——化学耦合分解的过程可描述为 。
江苏省六校2022-2023学年高二下学期5月联考
化学参考答案
单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1—5 DCDAA 6—10 ACDBA 11—13 BBD
14.(16分)
(1)5
(2)BCE写对1个得1分,有错不得分,全对得2分
(3)磷原子的3p轨道电子排布为半充满稳定结构,第一电离能较高
(4)三角锥形
(5)该反应平衡常数K=5.04x103,反应正向进行的程度较大
(6)KFe2Se2
(7)n(Na2S2O3)=0.4000mol·L-1×20.00mL×10-3L·mL 1=0.008mol
关系式:Se~SeO2~2I2~4Na2S2O3
n(Se)=0.002mol
W=(0.002mol×79g/mol/0.2000g)×100%=79.00%
(计算过程共4分)
15.(14分)
(1)醚键、酰胺键
(2)7:3
(3)还原反应
(4)B分子间存在氢键
(5)
(6)
16.(14分)
(1)HI
(2)
(3)消去反应
(4)1
(5)
(每步1分,全对得5分,条件错熔断)
17.(17分)
(1) QIIUQ :uId: QIIUQ 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=(a+2b)kJ/mol
(2)Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行
(3)① ②1:1
(4)0.5
(5)①< ②10 7.46
(6) OWEYPT :fId: OWEYPT
Fe2+在电极上失电子发生反应Fe2+-e—=Fe3+,生成的Fe3+氧化H2S生成硫单质,离子方程式为,H+通过质子交换膜从a极移向b极,在b极得电子生成H2共
同课章节目录
