2023年浙江中考科学三轮冲刺——易错9质量守恒定律 有关化学方程式的计算(含解析)
文档属性
| 名称 | 2023年浙江中考科学三轮冲刺——易错9质量守恒定律 有关化学方程式的计算(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 137.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-06-02 13:24:50 | ||
图片预览



文档简介
2023年浙江中考科学三轮冲刺——易错9质量守恒定律 有关化学方程式的计算
一.书写化学方程式、文字表达式、电离方程式(共3小题)
1.(2023 上城区模拟)工业上用氨气(NH3)制取硝酸(HNO3),工业流程中核心化学反应依次为:
①4NH3+5O24NO+6H2O
②2NO+O2=2NO2
③3NO2+H2O=2HNO3+NO
下列判断不正确的是( )
A.①的生成物均为氧化物
B.三个反应均不属于基本反应类型
C.通常情况下一氧化氮不与水反应
D.制取硝酸过程中产生的NO应循环使用
2.(2023 金华模拟)天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。金属锆具有抗腐蚀性强、熔点高、硬度大等特性,广泛用于航空航天、军工、原子能等领域。
(1)金属锆熔化属于 (填“物理”或“化学”)变化。
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆。该反应的化学方程式为: 。
3.(2023 杭州二模)2020年12月,我国嫦娥五号无人采集月球土壤获得圆满成功。
(1)月球土壤中含有丰富的核聚变的原料3He (元素符号左上角的数字代表该原子中质子数和中子数之和),则3He中的中子数是 ;
(2)月球土壤中存在天然的铁、钛等多种金属矿物质,工业上常用Mg在高温条件下还原TiCl4冶炼金属钛,其化学方程式 。
二.质量守恒定律及其应用(共4小题)
4.(2023 镇海区模拟)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示,下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁
微观示意图
反应前质量/g 32 200 1 0
反应后质量/g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
5.(2023 鹿城区校级一模)“宏观﹣微观﹣符号﹣量”是科学特有的表征物质及其变化的方法。一定条件下,二氧化碳和氢气可在催化剂表面转化成有机清洁燃料甲醇和X,其反应原理如图所示。下列说法错误的是( )
A.从宏观物质看:反应物中含有单质与化合物两类物质
B.从微观构成看:氢气是由氢分子构成的
C.从符号表征看:X的化学式是H2O
D.从量的角度看:反应前后原子和分子数目都不变
6.(2023 鄞州区一模)在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,则下列关于反应的认识,正确的是( )
物质 X Y Z Q
反应前质量(g) 20 2 1 37
反应后质量(g) 待测a 32 待测b 12
A.a的取值范围:0≤a≤16
B.该反应类型一定属于化合反应
C.当a=15时,物质Z在反应中起催化作用
D.当b=1时,反应中X、Q的相对分子质量比为1:5
7.(2023 杭州一模)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精和84消毒液是常用的消毒剂,但若使用不当可能会引发不良后果。
(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是 。
(2)84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,它和洁厕灵混合使用时会发生化学反应:2HCl+NaClO═NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 。
三.根据化学反应方程式的计算(共9小题)
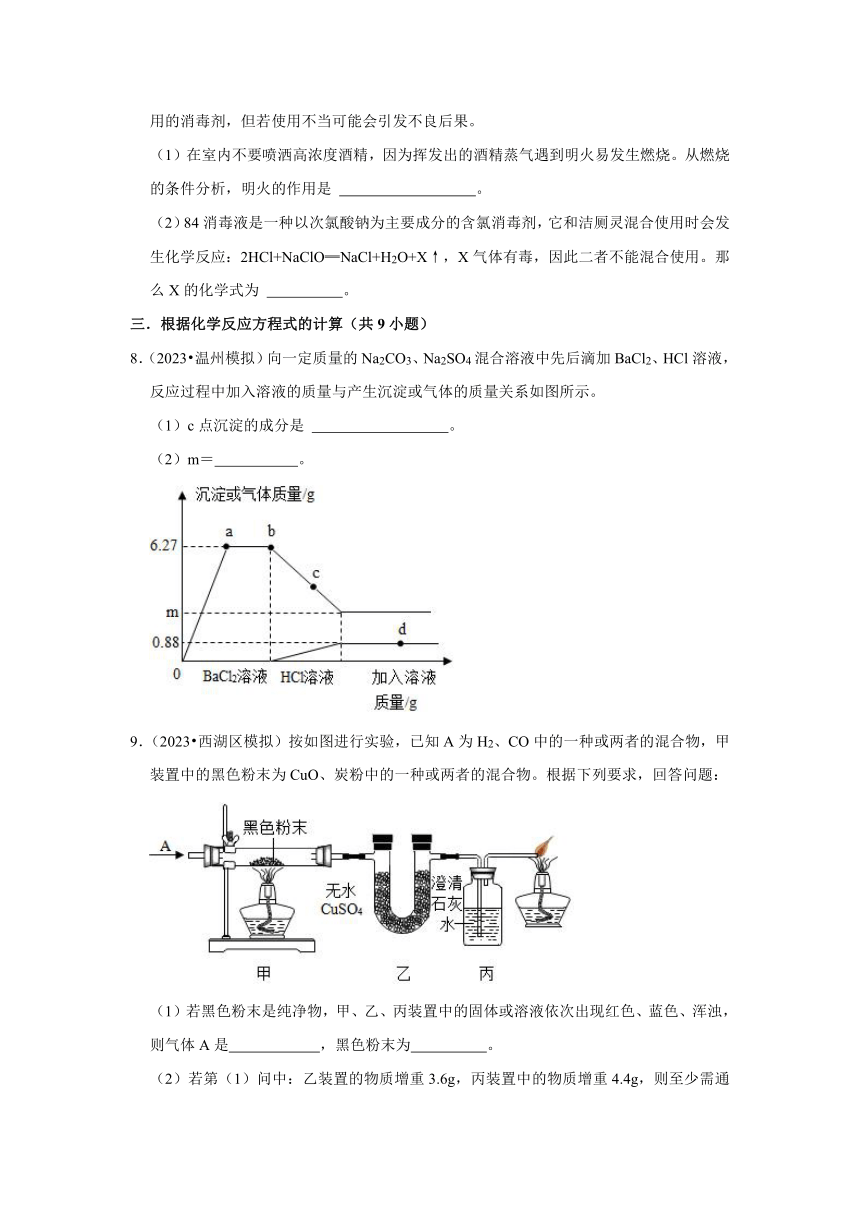
8.(2023 温州模拟)向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)c点沉淀的成分是 。
(2)m= 。
9.(2023 西湖区模拟)按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 ,黑色粉末为 。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入 g气体。
10.(2023 宁波模拟)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 克;
(2)所加稀硫酸的溶质质量分数是 ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
11.(2023 宁波模拟)铜镁合金具有优良的导电性,常用作飞机天线。现欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次数 1 2 3 4
加入稀硫酸质量/g 70 70 70 70
剩余固体质量/g 18.2 16.4 14.6 13.2
(1)合金中铜、镁的质量比。
(2)所加稀硫酸的溶质的质量分数。(写出计算过程)
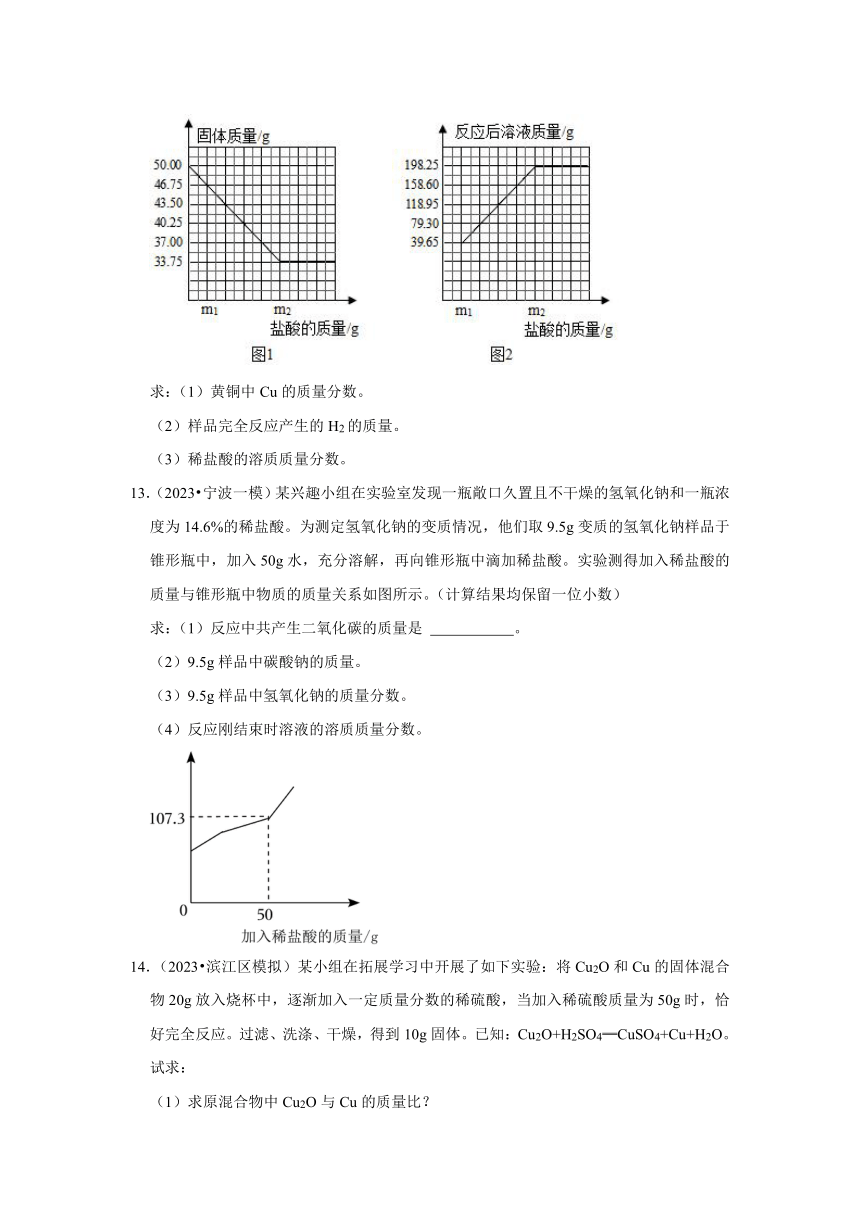
12.(2023 衢江区一模)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图:
求:(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
13.(2023 宁波一模)某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取9.5g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果均保留一位小数)
求:(1)反应中共产生二氧化碳的质量是 。
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
14.(2023 滨江区模拟)某小组在拓展学习中开展了如下实验:将Cu2O和Cu的固体混合物20g放入烧杯中,逐渐加入一定质量分数的稀硫酸,当加入稀硫酸质量为50g时,恰好完全反应。过滤、洗涤、干燥,得到10g固体。已知:Cu2O+H2SO4═CuSO4+Cu+H2O。试求:
(1)求原混合物中Cu2O与Cu的质量比?
(2)稀硫酸的溶质质量分数是多少?
(3)按要求在图中画出实验中铜的质量变化图像。
15.(2023 镇海区模拟)某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。
(1)实验室实验时,我们观察到的CuSO4溶液的颜色为 。
(2)为了测定废液中CuSO4的质量分数,该小组取了50g废液,逐滴加入NaOH溶液至过量。测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如图所示:
①图中的OA段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB段表示氢氧化钠溶液与CuSO4发生反应,反应结束后生成沉淀质量是 克。
②计算50g废液中CuSO4的质量。
16.(2023 杭州模拟)将含有少量硝酸钠的氯化钠样品30g溶于127.4克水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液.实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示.(提示:NaCl+AgNO3=AgCl↓+NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少?(要有解题步骤,结果精确到0.1%)
2023年浙江中考科学三轮冲刺——易错9质量守恒定律 有关化学方程式的计算
参考答案与试题解析
一.书写化学方程式、文字表达式、电离方程式(共3小题)
1.(2023 上城区模拟)工业上用氨气(NH3)制取硝酸(HNO3),工业流程中核心化学反应依次为:
①4NH3+5O24NO+6H2O
②2NO+O2=2NO2
③3NO2+H2O=2HNO3+NO
下列判断不正确的是( )
A.①的生成物均为氧化物
B.三个反应均不属于基本反应类型
C.通常情况下一氧化氮不与水反应
D.制取硝酸过程中产生的NO应循环使用
【解答】解:A.有氧化物的组成可知,①的生成物一氧化氮和水均为均为氧化物,故正确;
B.有反应的方程式可知,三个反应中②2NO+O2=2NO2 属于化合反应,说法不正确;
C.由反应①可知,NO和H2O是化学反应的两种生成物,二者之间不会发生化学反应,说法正确;
D.该三步反应后的生成物中一氧化氮又可在第②步中进行重复使用,所以可以进行物质的重复使用,说法正确。
故选:B。
2.(2023 金华模拟)天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。金属锆具有抗腐蚀性强、熔点高、硬度大等特性,广泛用于航空航天、军工、原子能等领域。
(1)金属锆熔化属于 物理 (填“物理”或“化学”)变化。
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆。该反应的化学方程式为: 2Mg+ZrCl42MgCl2+Zr 。
【解答】解:(1)金属锆熔化,只是状态发生改变,没有新物质生成,属于物理变化;
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆,化学方程式为:2Mg+ZrCl42MgCl2+Zr。
故答案为:(1)物理;
(2)2Mg+ZrCl42MgCl2+Zr。
3.(2023 杭州二模)2020年12月,我国嫦娥五号无人采集月球土壤获得圆满成功。
(1)月球土壤中含有丰富的核聚变的原料3He (元素符号左上角的数字代表该原子中质子数和中子数之和),则3He中的中子数是 1 ;
(2)月球土壤中存在天然的铁、钛等多种金属矿物质,工业上常用Mg在高温条件下还原TiCl4冶炼金属钛,其化学方程式 2Mg+TiCl42MgCl2+Ti 。
【解答】解:(1)月球土壤中含有丰富的核聚变的原料3He,元素符号左上角的数字代表该原子中质子数和中子数之和,氦原子的质子数为2,则中子数=3﹣2=1。
(2)Mg在高温条件下还原TiCl4冶炼金属钛,同时应生成氯化镁,反应的化学方程式为2Mg+TiCl42MgCl2+Ti。
故答案为:
(1)1;
(2)2Mg+TiCl42MgCl2+Ti。
二.质量守恒定律及其应用(共4小题)
4.(2023 镇海区模拟)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示,下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁
微观示意图
反应前质量/g 32 200 1 0
反应后质量/g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
【解答】解:由化学反应的反应物和生成物的微观示意图可知,该反应的方程式是:CH4+2O2CO2+2H2O。
A、由物质的构成可知,甲物质由甲烷分子构成的,故A说法不正确;
B、由物质的构成可知,该反应的生成物是两种化合物,不符合置换反应的特点,故B说法不正确;
C、由方程式可知,参加反应的反应物分子个数比为1:2或2:1,故C说法不正确。
D、由质量守恒定律可知,x+y+z=32+200+1=233,故D说法正确。
故选:D。
5.(2023 鹿城区校级一模)“宏观﹣微观﹣符号﹣量”是科学特有的表征物质及其变化的方法。一定条件下,二氧化碳和氢气可在催化剂表面转化成有机清洁燃料甲醇和X,其反应原理如图所示。下列说法错误的是( )
A.从宏观物质看:反应物中含有单质与化合物两类物质
B.从微观构成看:氢气是由氢分子构成的
C.从符号表征看:X的化学式是H2O
D.从量的角度看:反应前后原子和分子数目都不变
【解答】解:由反应原理微观示意图可知,该反应是在催化剂催化作用和一定条件下,二氧化碳和氢气反应生成甲醇和水,反应的化学方程式:CO2+3H2CH3OH+H2O;
A、由物质的组成可知,反应物中含有单质氢气与化合物二氧化碳两类物质,故A说法正确;
B、由物质的构成可知,氢气是由氢分子构成的,故B说法正确;
C、由分子的模型图可知,X的化学式是H2O,故C说法正确;
D、由方程式的意义可知,反应前后原子数目不变,分子数目发生了变化,故D说法错误。
故选:D。
6.(2023 鄞州区一模)在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,则下列关于反应的认识,正确的是( )
物质 X Y Z Q
反应前质量(g) 20 2 1 37
反应后质量(g) 待测a 32 待测b 12
A.a的取值范围:0≤a≤16
B.该反应类型一定属于化合反应
C.当a=15时,物质Z在反应中起催化作用
D.当b=1时,反应中X、Q的相对分子质量比为1:5
【解答】解:A.依据质量守恒定律可知,20+2+1+37=a+32+b+12,a+b=16,a=16﹣b,b=0时,a=16;b=16时,a=0,则a的取值范围:0≤a≤16;故A正确;
B.分析表中数据可知,Q为反应物,Y为生成物,但X、Z无法确定,则该反应的反应类型无法确定,故B错误;
C.分析表中数据可知,当a=15时,物质Z在反应前后的质量不变,但催化剂特点是反应前后质量和化学性质不变,改变其它反应速率,则物质Z在反应中不一定起催化作用,故C错误;
D.分析表中数据可知,当b=1时,反应中X、Q的质量比为5:25=1:5,无法确定其相对分子质量之比,故D错误;
故选:A。
7.(2023 杭州一模)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精和84消毒液是常用的消毒剂,但若使用不当可能会引发不良后果。
(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是 使可燃物温度达到着火点 。
(2)84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,它和洁厕灵混合使用时会发生化学反应:2HCl+NaClO═NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 Cl2 。
【解答】解:(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是使可燃物温度达到着火点。
(2)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前氢、氯、钠、氧原子个数分别为2、3、1、1,反应后的生成物中氢、氯、钠、氧原子个数分别为2、1、1、1,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2。
故答案为:
(1)使可燃物温度达到着火点;
(2)Cl2。
三.根据化学反应方程式的计算(共9小题)
8.(2023 温州模拟)向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)c点沉淀的成分是 BaCO3、BaSO4 。
(2)m= 2.33 。
【解答】解:(1)由上述分析可知:c点沉淀的成分为BaCO3、BaSO4。
(2)设参加反应的碳酸钡沉淀质量为x,
BaCO3∽CO2
197 44
x 0.88g
x=3.94g
所以m对应的质量为:6.27g﹣3.94g=2.33g。
故答案为:(1)BaCO3、BaSO4;
(2)2.33。
9.(2023 西湖区模拟)按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 H2和CO ,黑色粉末为 CuO 。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入 3.2 g气体。
【解答】解:(1)由题意可知,若黑色粉末是纯净物实验时出现红色,说明了黑色粉末为氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,通入的气体中含有一氧化碳.
故填:H2和CO;CuO;
(2)设氢气的质量为x
H2+CuOCu+H2O
2 18
x 3.6g
,解得:x=0.4g
设一氧化碳的质量为y
CO+CuOCu+CO2↑
28 44
y 4.4g
,解得:y=2.8g
参加反应的气体的质量是:0.4g+2.8g=3.2g
由于反应前和反应后都需要通入气体,故气体的质量要大于3.2g,
故填:3.2.
10.(2023 宁波模拟)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 12.8 克;
(2)所加稀硫酸的溶质质量分数是 9.8% ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
【解答】解:(1)氧化铜能与硫酸反应,铜不能与硫酸反应,所以反应生成铜的质量是12.8克,
(2)木炭与氧化铜的粉末反应完毕剩余氧化铜的质量:16.8g﹣12.8g=4g,
设与4g氧化铜反应消耗硫酸的质量为x则:
CuO+H2SO4═CuSO4+H2O
80 98
4g x
根据:解得:x=4.9g,所以稀硫酸的溶质质量分数是:9.8%;
(3)解:设与木炭反应的氧化铜质量为y,则
C+2CuO2Cu+CO2↑
160 128
y 12.8g
根据:解得:y=16g
则加热前氧化铜的质量为:16g+16.8g﹣12.8g=20g
答:加热前氧化铜的质量为20克。
故答案为:(1)12.8;
(2)9.8%;
(3)20。
11.(2023 宁波模拟)铜镁合金具有优良的导电性,常用作飞机天线。现欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次数 1 2 3 4
加入稀硫酸质量/g 70 70 70 70
剩余固体质量/g 18.2 16.4 14.6 13.2
(1)合金中铜、镁的质量比。
(2)所加稀硫酸的溶质的质量分数。(写出计算过程)
【解答】解:(1)由于镁能与稀硫酸反应铜不与稀硫酸反应,由表中的数据可知。每70g 的稀硫酸能反应镁的质量为1.8g,第四次加入的稀硫酸只反应掉镁的质量是14.6g﹣13.2g=1.4g<1.8g。硫酸有剩余,说明了镁全部参加了反应,剩余固体的质量为铜的质量,所以铜的质量为13.2g,金属镁的质量=20g﹣13.2g=6.8g,合金中铜、镁的质量比=13.2:6.8=33:17;
(2)设与1.8g金属镁反应的稀硫酸的溶质的质量为x。
Mg+H2SO4═MgSO4+H2↑
24 98
1.8g x
解得:x=7.35g
所加稀硫酸的溶质的质量分数100%=10.5%
答:(1)合金中铜、镁的质量比是3:17;(2)所加稀硫酸的溶质的质量分数10.5%。
12.(2023 衢江区一模)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图:
求:(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
【解答】解:(1)根据铜不能与盐酸反应,由图1可得黄铜中铜的质量为33.75g;
黄铜中Cu的质量分数:100%=67.5%;
答:黄铜中Cu的质量分数为67.5%;
(2)黄铜中锌的质量=50.00g﹣33.75g=16.25g
设完全反应产生的H2的质量为x,设完全反应时消耗盐酸的质量为y。
Zn+2HCl═ZnCl2+H2↑
65 73 2
16.25g y x
x=0.5g y=18.25g
答:样品完全反应产生的H2的质量为0.5g;
(3)稀盐酸的溶质质量分数:100%=10%
答:稀盐酸的溶质质量分数为10%。
13.(2023 宁波一模)某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取9.5g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果均保留一位小数)
求:(1)反应中共产生二氧化碳的质量是 2.2g 。
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
【解答】解:(1)由图中数据可知,生成二氧化碳的质量为:(9.5g+50g+50g)﹣107.3g=2.2g;
(2)设9.3g样品中碳酸钠的质量为x,与碳酸钠反应的氯化氢的质量为y。
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 2.2g
x=5.3g
y=3.65g
答:9.3g样品中碳酸钠的质量为5.3g。
(3)与碳酸钠反应的盐酸质量为25g,则与氢氧化钠反应的盐酸为50g﹣25g=25g,设氢氧化钠的质量为m;
NaOH+HCl═NaCl+H2O
40 36.5
m 25g×14.6%
m=4g
则9.5g样品中氢氧化钠的质量分数:100%≈42.1%;
(4)由反应可知,稀盐酸中的氯离子全部转化成氯化钠中的氯离子,则反应的盐酸的物质的量和生成的氯化钠的物质的量相等,
设生成氯化钠的质量为w。
HCl~~~NaCl
36.5 58.5
50g×14.6% w
w=11.7g
反应刚结束时溶液的溶质质量分数为:100%≈10.9%。
答:加入50g稀盐酸时,溶液中溶质的质量分数为10.9%。
故答案为:
(1)2.2g;
(2)5.3g;
(3)42.1%;
(4)10.9%。
14.(2023 滨江区模拟)某小组在拓展学习中开展了如下实验:将Cu2O和Cu的固体混合物20g放入烧杯中,逐渐加入一定质量分数的稀硫酸,当加入稀硫酸质量为50g时,恰好完全反应。过滤、洗涤、干燥,得到10g固体。已知:Cu2O+H2SO4═CuSO4+Cu+H2O。试求:
(1)求原混合物中Cu2O与Cu的质量比?
(2)稀硫酸的溶质质量分数是多少?
(3)按要求在图中画出实验中铜的质量变化图像。
【解答】解:设原混合物中Cu2O的质量为x,参加反应硫酸的质量为y,生成铜的质量为z,
Cu2O+H2SO4═CuSO4+Cu+H2O 固体减少量为△M
144 98 64 80
x y z 20g﹣10g
x=18g y=12.25g z=8g
(1)原混合物中Cu2O与Cu的质量比为18g:(20g﹣18g)=9:1;
(2)稀硫酸的溶质质量分数是100%=24.5%
答:(1)原混合物中Cu2O与Cu的质量比是9:1;(2)稀硫酸的溶质质量分数是24.5%;
(3)通过以上分析可知,原混合物中铜的质量为2g;生成铜的质量为8g,则加入硫酸与铜的质量变化关系如图;故填。
15.(2023 镇海区模拟)某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。
(1)实验室实验时,我们观察到的CuSO4溶液的颜色为 蓝色 。
(2)为了测定废液中CuSO4的质量分数,该小组取了50g废液,逐滴加入NaOH溶液至过量。测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如图所示:
①图中的OA段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB段表示氢氧化钠溶液与CuSO4发生反应,反应结束后生成沉淀质量是 1.96 克。
②计算50g废液中CuSO4的质量。
【解答】解:(1)实验室实验时,我们观察到的CuSO4溶液的颜色为蓝色;
(2)①由图示可知生成沉淀质量是1.96g;
设参加反应的硫酸铜的质量为x
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
160 98
x 1.96g
x=3.2g
答:50g废液中CuSO4的质量是3.2g。
故答案为:(1)蓝色;
(2)①1.96;
②3.2g。
16.(2023 杭州模拟)将含有少量硝酸钠的氯化钠样品30g溶于127.4克水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液.实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示.(提示:NaCl+AgNO3=AgCl↓+NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 57.4 g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少?(要有解题步骤,结果精确到0.1%)
【解答】解:(1)由图中信息可知,恰好完全反应时生成沉淀质量为57.4g;
(2)设氯化钠样品中氯化钠的质量为x,生成硝酸钠的质量为y,
NaCl+AgNO3═AgCl↓+NaNO3
58.5 170 143.5 85
x 57.4g y
x=23.4g
y=34g
硝酸钠溶液中硝酸钠的质量分数为:100%=20.3%.
故答案为:(1)57.4;
(2)20.3%.
一.书写化学方程式、文字表达式、电离方程式(共3小题)
1.(2023 上城区模拟)工业上用氨气(NH3)制取硝酸(HNO3),工业流程中核心化学反应依次为:
①4NH3+5O24NO+6H2O
②2NO+O2=2NO2
③3NO2+H2O=2HNO3+NO
下列判断不正确的是( )
A.①的生成物均为氧化物
B.三个反应均不属于基本反应类型
C.通常情况下一氧化氮不与水反应
D.制取硝酸过程中产生的NO应循环使用
2.(2023 金华模拟)天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。金属锆具有抗腐蚀性强、熔点高、硬度大等特性,广泛用于航空航天、军工、原子能等领域。
(1)金属锆熔化属于 (填“物理”或“化学”)变化。
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆。该反应的化学方程式为: 。
3.(2023 杭州二模)2020年12月,我国嫦娥五号无人采集月球土壤获得圆满成功。
(1)月球土壤中含有丰富的核聚变的原料3He (元素符号左上角的数字代表该原子中质子数和中子数之和),则3He中的中子数是 ;
(2)月球土壤中存在天然的铁、钛等多种金属矿物质,工业上常用Mg在高温条件下还原TiCl4冶炼金属钛,其化学方程式 。
二.质量守恒定律及其应用(共4小题)
4.(2023 镇海区模拟)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示,下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁
微观示意图
反应前质量/g 32 200 1 0
反应后质量/g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
5.(2023 鹿城区校级一模)“宏观﹣微观﹣符号﹣量”是科学特有的表征物质及其变化的方法。一定条件下,二氧化碳和氢气可在催化剂表面转化成有机清洁燃料甲醇和X,其反应原理如图所示。下列说法错误的是( )
A.从宏观物质看:反应物中含有单质与化合物两类物质
B.从微观构成看:氢气是由氢分子构成的
C.从符号表征看:X的化学式是H2O
D.从量的角度看:反应前后原子和分子数目都不变
6.(2023 鄞州区一模)在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,则下列关于反应的认识,正确的是( )
物质 X Y Z Q
反应前质量(g) 20 2 1 37
反应后质量(g) 待测a 32 待测b 12
A.a的取值范围:0≤a≤16
B.该反应类型一定属于化合反应
C.当a=15时,物质Z在反应中起催化作用
D.当b=1时,反应中X、Q的相对分子质量比为1:5
7.(2023 杭州一模)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精和84消毒液是常用的消毒剂,但若使用不当可能会引发不良后果。
(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是 。
(2)84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,它和洁厕灵混合使用时会发生化学反应:2HCl+NaClO═NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 。
三.根据化学反应方程式的计算(共9小题)
8.(2023 温州模拟)向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)c点沉淀的成分是 。
(2)m= 。
9.(2023 西湖区模拟)按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 ,黑色粉末为 。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入 g气体。
10.(2023 宁波模拟)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 克;
(2)所加稀硫酸的溶质质量分数是 ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
11.(2023 宁波模拟)铜镁合金具有优良的导电性,常用作飞机天线。现欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次数 1 2 3 4
加入稀硫酸质量/g 70 70 70 70
剩余固体质量/g 18.2 16.4 14.6 13.2
(1)合金中铜、镁的质量比。
(2)所加稀硫酸的溶质的质量分数。(写出计算过程)
12.(2023 衢江区一模)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图:
求:(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
13.(2023 宁波一模)某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取9.5g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果均保留一位小数)
求:(1)反应中共产生二氧化碳的质量是 。
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
14.(2023 滨江区模拟)某小组在拓展学习中开展了如下实验:将Cu2O和Cu的固体混合物20g放入烧杯中,逐渐加入一定质量分数的稀硫酸,当加入稀硫酸质量为50g时,恰好完全反应。过滤、洗涤、干燥,得到10g固体。已知:Cu2O+H2SO4═CuSO4+Cu+H2O。试求:
(1)求原混合物中Cu2O与Cu的质量比?
(2)稀硫酸的溶质质量分数是多少?
(3)按要求在图中画出实验中铜的质量变化图像。
15.(2023 镇海区模拟)某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。
(1)实验室实验时,我们观察到的CuSO4溶液的颜色为 。
(2)为了测定废液中CuSO4的质量分数,该小组取了50g废液,逐滴加入NaOH溶液至过量。测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如图所示:
①图中的OA段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB段表示氢氧化钠溶液与CuSO4发生反应,反应结束后生成沉淀质量是 克。
②计算50g废液中CuSO4的质量。
16.(2023 杭州模拟)将含有少量硝酸钠的氯化钠样品30g溶于127.4克水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液.实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示.(提示:NaCl+AgNO3=AgCl↓+NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少?(要有解题步骤,结果精确到0.1%)
2023年浙江中考科学三轮冲刺——易错9质量守恒定律 有关化学方程式的计算
参考答案与试题解析
一.书写化学方程式、文字表达式、电离方程式(共3小题)
1.(2023 上城区模拟)工业上用氨气(NH3)制取硝酸(HNO3),工业流程中核心化学反应依次为:
①4NH3+5O24NO+6H2O
②2NO+O2=2NO2
③3NO2+H2O=2HNO3+NO
下列判断不正确的是( )
A.①的生成物均为氧化物
B.三个反应均不属于基本反应类型
C.通常情况下一氧化氮不与水反应
D.制取硝酸过程中产生的NO应循环使用
【解答】解:A.有氧化物的组成可知,①的生成物一氧化氮和水均为均为氧化物,故正确;
B.有反应的方程式可知,三个反应中②2NO+O2=2NO2 属于化合反应,说法不正确;
C.由反应①可知,NO和H2O是化学反应的两种生成物,二者之间不会发生化学反应,说法正确;
D.该三步反应后的生成物中一氧化氮又可在第②步中进行重复使用,所以可以进行物质的重复使用,说法正确。
故选:B。
2.(2023 金华模拟)天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。金属锆具有抗腐蚀性强、熔点高、硬度大等特性,广泛用于航空航天、军工、原子能等领域。
(1)金属锆熔化属于 物理 (填“物理”或“化学”)变化。
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆。该反应的化学方程式为: 2Mg+ZrCl42MgCl2+Zr 。
【解答】解:(1)金属锆熔化,只是状态发生改变,没有新物质生成,属于物理变化;
(2)在850℃条件下,镁(Mg)与四氯化锆(ZrCl4)发生置换反应获得金属锆,化学方程式为:2Mg+ZrCl42MgCl2+Zr。
故答案为:(1)物理;
(2)2Mg+ZrCl42MgCl2+Zr。
3.(2023 杭州二模)2020年12月,我国嫦娥五号无人采集月球土壤获得圆满成功。
(1)月球土壤中含有丰富的核聚变的原料3He (元素符号左上角的数字代表该原子中质子数和中子数之和),则3He中的中子数是 1 ;
(2)月球土壤中存在天然的铁、钛等多种金属矿物质,工业上常用Mg在高温条件下还原TiCl4冶炼金属钛,其化学方程式 2Mg+TiCl42MgCl2+Ti 。
【解答】解:(1)月球土壤中含有丰富的核聚变的原料3He,元素符号左上角的数字代表该原子中质子数和中子数之和,氦原子的质子数为2,则中子数=3﹣2=1。
(2)Mg在高温条件下还原TiCl4冶炼金属钛,同时应生成氯化镁,反应的化学方程式为2Mg+TiCl42MgCl2+Ti。
故答案为:
(1)1;
(2)2Mg+TiCl42MgCl2+Ti。
二.质量守恒定律及其应用(共4小题)
4.(2023 镇海区模拟)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示,下列有关该反应的说法正确的是( )
物质 甲 乙 丙 丁
微观示意图
反应前质量/g 32 200 1 0
反应后质量/g 0 x y z
A.甲物质由碳原子和氢原子直接构成
B.该反应属于置换反应
C.参加反应的反应物分子个数比为1:1
D.x+y+z=233
【解答】解:由化学反应的反应物和生成物的微观示意图可知,该反应的方程式是:CH4+2O2CO2+2H2O。
A、由物质的构成可知,甲物质由甲烷分子构成的,故A说法不正确;
B、由物质的构成可知,该反应的生成物是两种化合物,不符合置换反应的特点,故B说法不正确;
C、由方程式可知,参加反应的反应物分子个数比为1:2或2:1,故C说法不正确。
D、由质量守恒定律可知,x+y+z=32+200+1=233,故D说法正确。
故选:D。
5.(2023 鹿城区校级一模)“宏观﹣微观﹣符号﹣量”是科学特有的表征物质及其变化的方法。一定条件下,二氧化碳和氢气可在催化剂表面转化成有机清洁燃料甲醇和X,其反应原理如图所示。下列说法错误的是( )
A.从宏观物质看:反应物中含有单质与化合物两类物质
B.从微观构成看:氢气是由氢分子构成的
C.从符号表征看:X的化学式是H2O
D.从量的角度看:反应前后原子和分子数目都不变
【解答】解:由反应原理微观示意图可知,该反应是在催化剂催化作用和一定条件下,二氧化碳和氢气反应生成甲醇和水,反应的化学方程式:CO2+3H2CH3OH+H2O;
A、由物质的组成可知,反应物中含有单质氢气与化合物二氧化碳两类物质,故A说法正确;
B、由物质的构成可知,氢气是由氢分子构成的,故B说法正确;
C、由分子的模型图可知,X的化学式是H2O,故C说法正确;
D、由方程式的意义可知,反应前后原子数目不变,分子数目发生了变化,故D说法错误。
故选:D。
6.(2023 鄞州区一模)在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,则下列关于反应的认识,正确的是( )
物质 X Y Z Q
反应前质量(g) 20 2 1 37
反应后质量(g) 待测a 32 待测b 12
A.a的取值范围:0≤a≤16
B.该反应类型一定属于化合反应
C.当a=15时,物质Z在反应中起催化作用
D.当b=1时,反应中X、Q的相对分子质量比为1:5
【解答】解:A.依据质量守恒定律可知,20+2+1+37=a+32+b+12,a+b=16,a=16﹣b,b=0时,a=16;b=16时,a=0,则a的取值范围:0≤a≤16;故A正确;
B.分析表中数据可知,Q为反应物,Y为生成物,但X、Z无法确定,则该反应的反应类型无法确定,故B错误;
C.分析表中数据可知,当a=15时,物质Z在反应前后的质量不变,但催化剂特点是反应前后质量和化学性质不变,改变其它反应速率,则物质Z在反应中不一定起催化作用,故C错误;
D.分析表中数据可知,当b=1时,反应中X、Q的质量比为5:25=1:5,无法确定其相对分子质量之比,故D错误;
故选:A。
7.(2023 杭州一模)在抗击新型冠状病毒肺炎中做好消毒至关重要,酒精和84消毒液是常用的消毒剂,但若使用不当可能会引发不良后果。
(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是 使可燃物温度达到着火点 。
(2)84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,它和洁厕灵混合使用时会发生化学反应:2HCl+NaClO═NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 Cl2 。
【解答】解:(1)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧。从燃烧的条件分析,明火的作用是使可燃物温度达到着火点。
(2)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前氢、氯、钠、氧原子个数分别为2、3、1、1,反应后的生成物中氢、氯、钠、氧原子个数分别为2、1、1、1,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2。
故答案为:
(1)使可燃物温度达到着火点;
(2)Cl2。
三.根据化学反应方程式的计算(共9小题)
8.(2023 温州模拟)向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)c点沉淀的成分是 BaCO3、BaSO4 。
(2)m= 2.33 。
【解答】解:(1)由上述分析可知:c点沉淀的成分为BaCO3、BaSO4。
(2)设参加反应的碳酸钡沉淀质量为x,
BaCO3∽CO2
197 44
x 0.88g
x=3.94g
所以m对应的质量为:6.27g﹣3.94g=2.33g。
故答案为:(1)BaCO3、BaSO4;
(2)2.33。
9.(2023 西湖区模拟)按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 H2和CO ,黑色粉末为 CuO 。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入 3.2 g气体。
【解答】解:(1)由题意可知,若黑色粉末是纯净物实验时出现红色,说明了黑色粉末为氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,通入的气体中含有一氧化碳.
故填:H2和CO;CuO;
(2)设氢气的质量为x
H2+CuOCu+H2O
2 18
x 3.6g
,解得:x=0.4g
设一氧化碳的质量为y
CO+CuOCu+CO2↑
28 44
y 4.4g
,解得:y=2.8g
参加反应的气体的质量是:0.4g+2.8g=3.2g
由于反应前和反应后都需要通入气体,故气体的质量要大于3.2g,
故填:3.2.
10.(2023 宁波模拟)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 12.8 克;
(2)所加稀硫酸的溶质质量分数是 9.8% ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
【解答】解:(1)氧化铜能与硫酸反应,铜不能与硫酸反应,所以反应生成铜的质量是12.8克,
(2)木炭与氧化铜的粉末反应完毕剩余氧化铜的质量:16.8g﹣12.8g=4g,
设与4g氧化铜反应消耗硫酸的质量为x则:
CuO+H2SO4═CuSO4+H2O
80 98
4g x
根据:解得:x=4.9g,所以稀硫酸的溶质质量分数是:9.8%;
(3)解:设与木炭反应的氧化铜质量为y,则
C+2CuO2Cu+CO2↑
160 128
y 12.8g
根据:解得:y=16g
则加热前氧化铜的质量为:16g+16.8g﹣12.8g=20g
答:加热前氧化铜的质量为20克。
故答案为:(1)12.8;
(2)9.8%;
(3)20。
11.(2023 宁波模拟)铜镁合金具有优良的导电性,常用作飞机天线。现欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次数 1 2 3 4
加入稀硫酸质量/g 70 70 70 70
剩余固体质量/g 18.2 16.4 14.6 13.2
(1)合金中铜、镁的质量比。
(2)所加稀硫酸的溶质的质量分数。(写出计算过程)
【解答】解:(1)由于镁能与稀硫酸反应铜不与稀硫酸反应,由表中的数据可知。每70g 的稀硫酸能反应镁的质量为1.8g,第四次加入的稀硫酸只反应掉镁的质量是14.6g﹣13.2g=1.4g<1.8g。硫酸有剩余,说明了镁全部参加了反应,剩余固体的质量为铜的质量,所以铜的质量为13.2g,金属镁的质量=20g﹣13.2g=6.8g,合金中铜、镁的质量比=13.2:6.8=33:17;
(2)设与1.8g金属镁反应的稀硫酸的溶质的质量为x。
Mg+H2SO4═MgSO4+H2↑
24 98
1.8g x
解得:x=7.35g
所加稀硫酸的溶质的质量分数100%=10.5%
答:(1)合金中铜、镁的质量比是3:17;(2)所加稀硫酸的溶质的质量分数10.5%。
12.(2023 衢江区一模)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图:
求:(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
【解答】解:(1)根据铜不能与盐酸反应,由图1可得黄铜中铜的质量为33.75g;
黄铜中Cu的质量分数:100%=67.5%;
答:黄铜中Cu的质量分数为67.5%;
(2)黄铜中锌的质量=50.00g﹣33.75g=16.25g
设完全反应产生的H2的质量为x,设完全反应时消耗盐酸的质量为y。
Zn+2HCl═ZnCl2+H2↑
65 73 2
16.25g y x
x=0.5g y=18.25g
答:样品完全反应产生的H2的质量为0.5g;
(3)稀盐酸的溶质质量分数:100%=10%
答:稀盐酸的溶质质量分数为10%。
13.(2023 宁波一模)某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取9.5g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果均保留一位小数)
求:(1)反应中共产生二氧化碳的质量是 2.2g 。
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
【解答】解:(1)由图中数据可知,生成二氧化碳的质量为:(9.5g+50g+50g)﹣107.3g=2.2g;
(2)设9.3g样品中碳酸钠的质量为x,与碳酸钠反应的氯化氢的质量为y。
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 2.2g
x=5.3g
y=3.65g
答:9.3g样品中碳酸钠的质量为5.3g。
(3)与碳酸钠反应的盐酸质量为25g,则与氢氧化钠反应的盐酸为50g﹣25g=25g,设氢氧化钠的质量为m;
NaOH+HCl═NaCl+H2O
40 36.5
m 25g×14.6%
m=4g
则9.5g样品中氢氧化钠的质量分数:100%≈42.1%;
(4)由反应可知,稀盐酸中的氯离子全部转化成氯化钠中的氯离子,则反应的盐酸的物质的量和生成的氯化钠的物质的量相等,
设生成氯化钠的质量为w。
HCl~~~NaCl
36.5 58.5
50g×14.6% w
w=11.7g
反应刚结束时溶液的溶质质量分数为:100%≈10.9%。
答:加入50g稀盐酸时,溶液中溶质的质量分数为10.9%。
故答案为:
(1)2.2g;
(2)5.3g;
(3)42.1%;
(4)10.9%。
14.(2023 滨江区模拟)某小组在拓展学习中开展了如下实验:将Cu2O和Cu的固体混合物20g放入烧杯中,逐渐加入一定质量分数的稀硫酸,当加入稀硫酸质量为50g时,恰好完全反应。过滤、洗涤、干燥,得到10g固体。已知:Cu2O+H2SO4═CuSO4+Cu+H2O。试求:
(1)求原混合物中Cu2O与Cu的质量比?
(2)稀硫酸的溶质质量分数是多少?
(3)按要求在图中画出实验中铜的质量变化图像。
【解答】解:设原混合物中Cu2O的质量为x,参加反应硫酸的质量为y,生成铜的质量为z,
Cu2O+H2SO4═CuSO4+Cu+H2O 固体减少量为△M
144 98 64 80
x y z 20g﹣10g
x=18g y=12.25g z=8g
(1)原混合物中Cu2O与Cu的质量比为18g:(20g﹣18g)=9:1;
(2)稀硫酸的溶质质量分数是100%=24.5%
答:(1)原混合物中Cu2O与Cu的质量比是9:1;(2)稀硫酸的溶质质量分数是24.5%;
(3)通过以上分析可知,原混合物中铜的质量为2g;生成铜的质量为8g,则加入硫酸与铜的质量变化关系如图;故填。
15.(2023 镇海区模拟)某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。
(1)实验室实验时,我们观察到的CuSO4溶液的颜色为 蓝色 。
(2)为了测定废液中CuSO4的质量分数,该小组取了50g废液,逐滴加入NaOH溶液至过量。测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如图所示:
①图中的OA段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB段表示氢氧化钠溶液与CuSO4发生反应,反应结束后生成沉淀质量是 1.96 克。
②计算50g废液中CuSO4的质量。
【解答】解:(1)实验室实验时,我们观察到的CuSO4溶液的颜色为蓝色;
(2)①由图示可知生成沉淀质量是1.96g;
设参加反应的硫酸铜的质量为x
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
160 98
x 1.96g
x=3.2g
答:50g废液中CuSO4的质量是3.2g。
故答案为:(1)蓝色;
(2)①1.96;
②3.2g。
16.(2023 杭州模拟)将含有少量硝酸钠的氯化钠样品30g溶于127.4克水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液.实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示.(提示:NaCl+AgNO3=AgCl↓+NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 57.4 g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少?(要有解题步骤,结果精确到0.1%)
【解答】解:(1)由图中信息可知,恰好完全反应时生成沉淀质量为57.4g;
(2)设氯化钠样品中氯化钠的质量为x,生成硝酸钠的质量为y,
NaCl+AgNO3═AgCl↓+NaNO3
58.5 170 143.5 85
x 57.4g y
x=23.4g
y=34g
硝酸钠溶液中硝酸钠的质量分数为:100%=20.3%.
故答案为:(1)57.4;
(2)20.3%.
同课章节目录
