2022-2023学年鲁科版高中化学必修二 2.1化学键与物质构成(共29张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修二 2.1化学键与物质构成(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 73.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-01 14:32:35 | ||
图片预览





文档简介
(共29张PPT)
化学键与物质构成
118种元素
丰富的物质世界
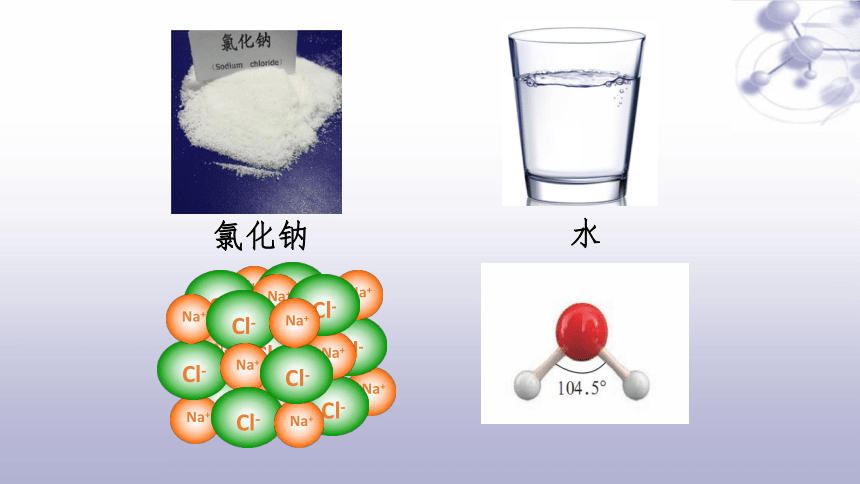
水
氯化钠
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
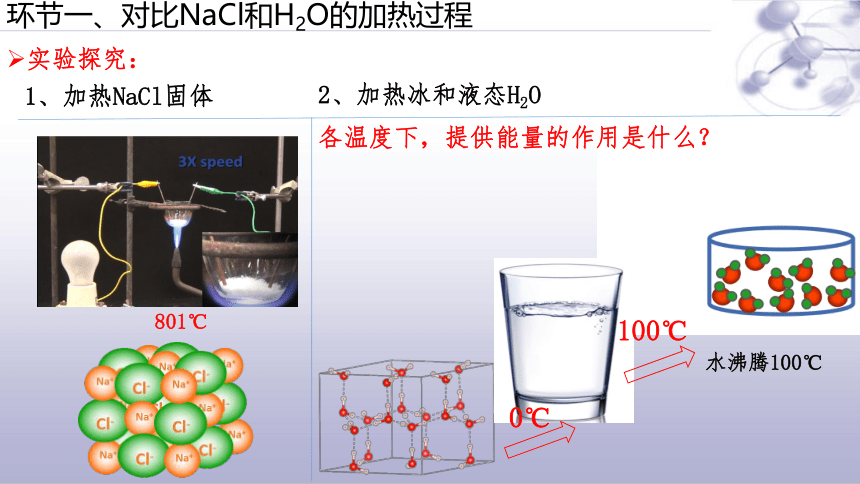
环节一、对比NaCl和H2O的加热过程
801℃
1、加热NaCl固体
实验探究:
环节一、对比NaCl和H2O的加热过程
实验探究:
1、加热NaCl固体
801℃
2、加热冰和液态H2O
水沸腾100℃
0℃
100℃
各温度下,提供能量的作用是什么?
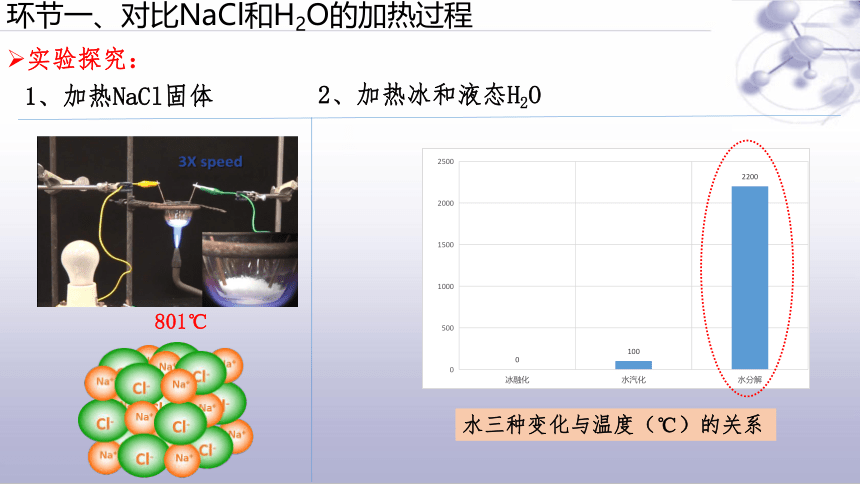
环节一、对比NaCl和H2O的加热过程
实验探究:
水三种变化与温度(℃)的关系
801℃
1、加热NaCl固体
2、加热冰和液态H2O
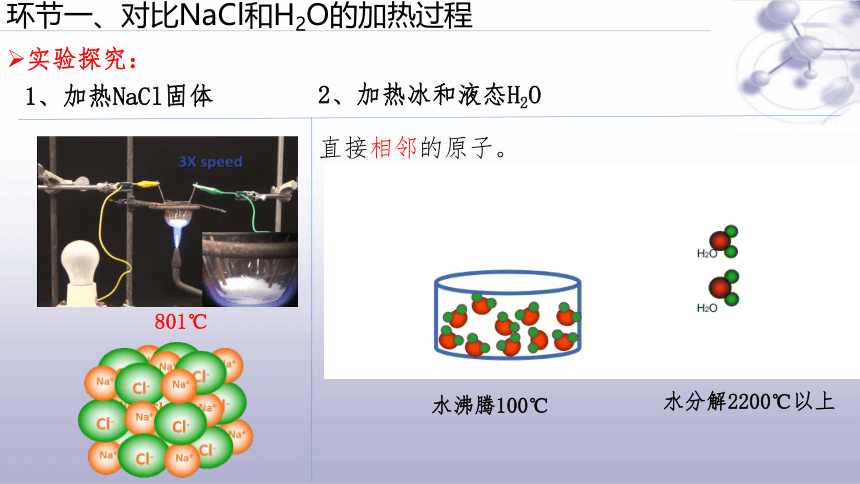
环节一、对比NaCl和H2O的加热过程
实验探究:
水沸腾100℃
水分解2200℃以上
直接相邻的原子。
801℃
1、加热NaCl固体
2、加热冰和液态H2O
环节一、对比NaCl和H2O的加热过程
化学键的定义:相邻原子间的强相互作用称为化学键。
(1)首先必须是直接相邻的原子。
(2)广义的原子。
NaCl熔融801℃
水分解高达2200℃
(3)强相互作用。破坏化学键需要较高的能量。
水沸腾100℃
801℃
水分解2200℃以上
环节二、NaCl和H2O的形成过程
宏观角度
环节二、NaCl和H2O的形成过程
宏观角度
环节二、NaCl和H2O的形成过程
宏观角度
新物质生成
能量变化
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
八隅律
H达2e-稳定结构,其他原子一般达8e-稳定结构。
历史上几位化学家对微粒间结合方式的认识
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
①请在白板上利用小磁铁标出H、Na、O、Cl原子各电子层上的电子。
②根据核外电子排布规律,原子如何满足“八隅律”?
③Na和Cl原子、H和O原子分别如何形成化学键?
【活动探究】NaCl和H2O的成键过程
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
【活动探究】NaCl和H2O的成键过程
阴、阳离子之间通过静电作用形成的化学键称为离子键。
原子间通过共用电子形成的化学键称为共价键。
成键实质:电性作用。
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
共价键
离子键
成键微粒
成键元素
成键方式
成键实质
阴阳离子
活泼金属元素和
活泼非金属元素
得失电子
电性作用
原子
非金属元素与
非金属元素
共用电子
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
利用电子式描述NaCl和H2O的成键过程
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
化学反应 断裂的键 形成的键
2H2+O2 2H2O
H2 + Cl2 2HCl
N2 + 3H2 2NH3
点燃
点燃
氢氧键
氢氢键、氧氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
高温,高压
催化剂
利用展示的比例模型判断下列化学反应化学键的变化。
活动探究
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
化学反应 断裂的键 形成的键
2H2+O2 2H2O
H2 + Cl2 2HCl
N2 + 3H2 2NH3
点燃
点燃
氢氢键、氧氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
高温,高压
催化剂
利用展示的比例模型判断下列化学反应化学键的变化。
活动探究
从化学键的角度如何描述化学反应?
氢氧键
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
断裂旧键和形成新键各自是吸热还是放热?
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
断裂旧键吸收能量、形成新键释放能量。
原子通过化学键形成新物质降低了体系的能量。
这也是原子成键的动力。
≠
环节二、NaCl和H2O的形成过程
小试牛刀
请运用你所学的知识完成下表
物质 形成化学键的微粒 化学键类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
环节二、NaCl和H2O的形成过程
小试牛刀
请运用你所学的知识完成下表
分析思考
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
如果将化合物分为离子化合物、共价化合物应该如何分类?
小试牛刀
请运用你所学的知识完成下表
分析思考
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
如果将化合物分为离子化合物、共价化合物应该如何分类?
共价化合物
离子化合物
离子化合物
离子化合物
环节三、离子化合物共价化合物
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
共价化合物
离子化合物
离子化合物
离子化合物
含有离子键的化合物。
仅含共价键的化合物。
由阴阳离子构成的化合物称为离子化合物。
由原子通过共价键构成的化合物称为共价化合物。
离子化合物
共价化合物
环节三、离子化合物共价化合物
离子化合物
共价化合物
微粒
化学键
环节三、离子化合物共价化合物
氯化钠的主要作用:
1、维持细胞外液的渗透压。
2、参与体内酸碱平衡的调节。
3、氯离子在体内参与胃酸的生成。
4、氯化钠在维持神经和肌肉的正常兴奋性上也有作用。另外,氯化钠可配置成氯化钠溶液,在临床上应用也比较广泛,可用于治疗休克,水电解质紊乱等情况。
试解释离子化合物NaCl为什么固态不导电而熔融态导电?
课堂小结
宏观现象
微观分析
符号表达
化学三重表征
化学键
物质变化
能量变化
组成微粒
电子式
课堂小结
C60
石墨烯制作的单层碳纳米管
金刚石
石墨
强国有我,筑梦青春!
谢谢大家
化学键与物质构成
118种元素
丰富的物质世界
水
氯化钠
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
环节一、对比NaCl和H2O的加热过程
801℃
1、加热NaCl固体
实验探究:
环节一、对比NaCl和H2O的加热过程
实验探究:
1、加热NaCl固体
801℃
2、加热冰和液态H2O
水沸腾100℃
0℃
100℃
各温度下,提供能量的作用是什么?
环节一、对比NaCl和H2O的加热过程
实验探究:
水三种变化与温度(℃)的关系
801℃
1、加热NaCl固体
2、加热冰和液态H2O
环节一、对比NaCl和H2O的加热过程
实验探究:
水沸腾100℃
水分解2200℃以上
直接相邻的原子。
801℃
1、加热NaCl固体
2、加热冰和液态H2O
环节一、对比NaCl和H2O的加热过程
化学键的定义:相邻原子间的强相互作用称为化学键。
(1)首先必须是直接相邻的原子。
(2)广义的原子。
NaCl熔融801℃
水分解高达2200℃
(3)强相互作用。破坏化学键需要较高的能量。
水沸腾100℃
801℃
水分解2200℃以上
环节二、NaCl和H2O的形成过程
宏观角度
环节二、NaCl和H2O的形成过程
宏观角度
环节二、NaCl和H2O的形成过程
宏观角度
新物质生成
能量变化
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
八隅律
H达2e-稳定结构,其他原子一般达8e-稳定结构。
历史上几位化学家对微粒间结合方式的认识
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
①请在白板上利用小磁铁标出H、Na、O、Cl原子各电子层上的电子。
②根据核外电子排布规律,原子如何满足“八隅律”?
③Na和Cl原子、H和O原子分别如何形成化学键?
【活动探究】NaCl和H2O的成键过程
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
【活动探究】NaCl和H2O的成键过程
阴、阳离子之间通过静电作用形成的化学键称为离子键。
原子间通过共用电子形成的化学键称为共价键。
成键实质:电性作用。
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
共价键
离子键
成键微粒
成键元素
成键方式
成键实质
阴阳离子
活泼金属元素和
活泼非金属元素
得失电子
电性作用
原子
非金属元素与
非金属元素
共用电子
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
利用电子式描述NaCl和H2O的成键过程
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
化学反应 断裂的键 形成的键
2H2+O2 2H2O
H2 + Cl2 2HCl
N2 + 3H2 2NH3
点燃
点燃
氢氧键
氢氢键、氧氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
高温,高压
催化剂
利用展示的比例模型判断下列化学反应化学键的变化。
活动探究
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
化学反应 断裂的键 形成的键
2H2+O2 2H2O
H2 + Cl2 2HCl
N2 + 3H2 2NH3
点燃
点燃
氢氢键、氧氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
高温,高压
催化剂
利用展示的比例模型判断下列化学反应化学键的变化。
活动探究
从化学键的角度如何描述化学反应?
氢氧键
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
断裂旧键和形成新键各自是吸热还是放热?
微观解释宏观现象
宏观角度
环节二、NaCl和H2O的形成过程
微观角度
符号表征
模型体验
旧化学键的断裂、新化学键的形成。
原子的重新组合
化学键
宏观现象
微观解释
新物质生成
能量变化
断裂旧键吸收能量、形成新键释放能量。
原子通过化学键形成新物质降低了体系的能量。
这也是原子成键的动力。
≠
环节二、NaCl和H2O的形成过程
小试牛刀
请运用你所学的知识完成下表
物质 形成化学键的微粒 化学键类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
环节二、NaCl和H2O的形成过程
小试牛刀
请运用你所学的知识完成下表
分析思考
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
如果将化合物分为离子化合物、共价化合物应该如何分类?
小试牛刀
请运用你所学的知识完成下表
分析思考
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
如果将化合物分为离子化合物、共价化合物应该如何分类?
共价化合物
离子化合物
离子化合物
离子化合物
环节三、离子化合物共价化合物
物质 形成化学键的微粒 化学键类型 化合物类型
NH3
KCl
NaOH
CaCl2
N、H
Na+、OH-
K+、Cl-
Ca2+、Cl-
共价键
离子键
离子键、共价键
离子键
共价化合物
离子化合物
离子化合物
离子化合物
含有离子键的化合物。
仅含共价键的化合物。
由阴阳离子构成的化合物称为离子化合物。
由原子通过共价键构成的化合物称为共价化合物。
离子化合物
共价化合物
环节三、离子化合物共价化合物
离子化合物
共价化合物
微粒
化学键
环节三、离子化合物共价化合物
氯化钠的主要作用:
1、维持细胞外液的渗透压。
2、参与体内酸碱平衡的调节。
3、氯离子在体内参与胃酸的生成。
4、氯化钠在维持神经和肌肉的正常兴奋性上也有作用。另外,氯化钠可配置成氯化钠溶液,在临床上应用也比较广泛,可用于治疗休克,水电解质紊乱等情况。
试解释离子化合物NaCl为什么固态不导电而熔融态导电?
课堂小结
宏观现象
微观分析
符号表达
化学三重表征
化学键
物质变化
能量变化
组成微粒
电子式
课堂小结
C60
石墨烯制作的单层碳纳米管
金刚石
石墨
强国有我,筑梦青春!
谢谢大家
