福建省泉州科技中学2022-2023学年高一下学期期中考试化学试题(PDF版含答案)
文档属性
| 名称 | 福建省泉州科技中学2022-2023学年高一下学期期中考试化学试题(PDF版含答案) | 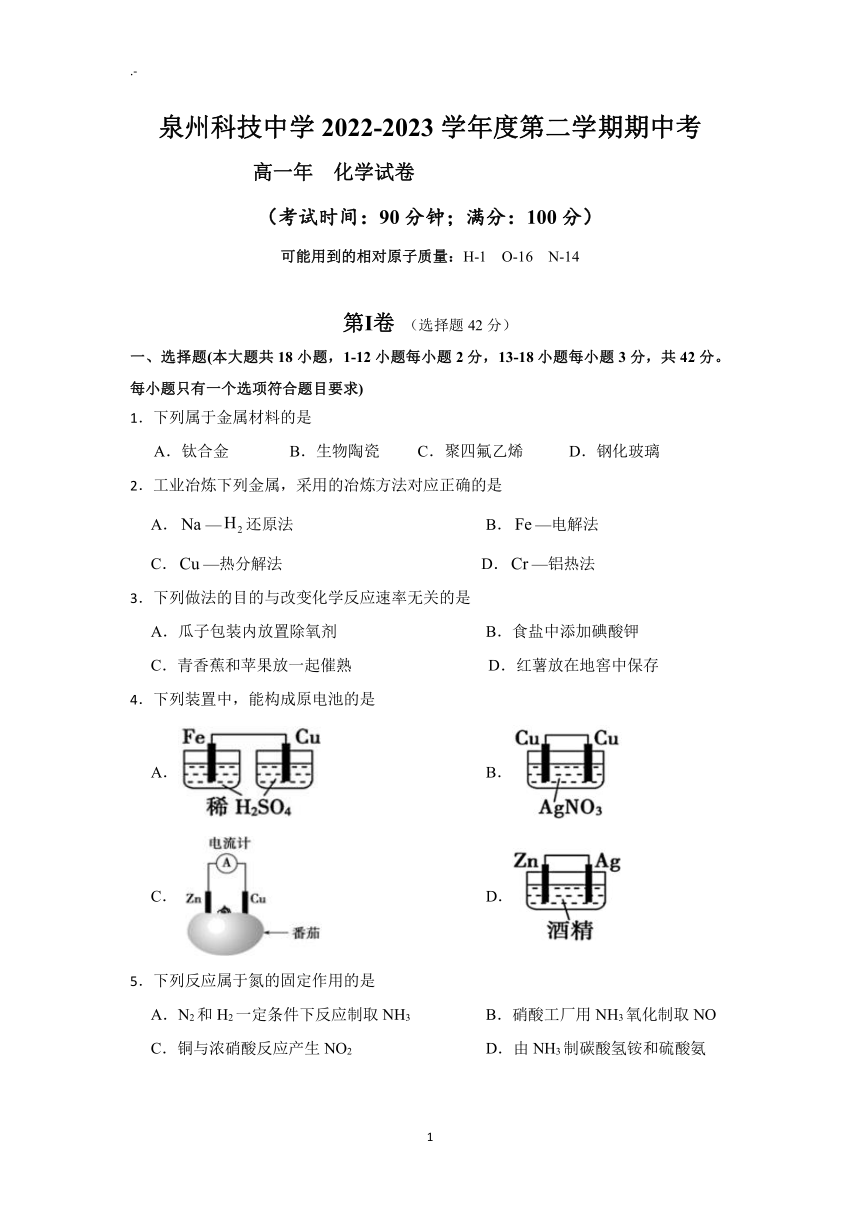 | |
| 格式 | |||
| 文件大小 | 548.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-01 19:51:59 | ||
图片预览




文档简介
.-
泉州科技中学 2022-2023学年度第二学期期中考
高一年 化学试卷
(考试时间:90分钟;满分:100分)
可能用到的相对原子质量:H-1 O-16 N-14
第Ⅰ卷 (选择题 42分)
一、选择题(本大题共 18 小题,1-12小题每小题 2分,13-18小题每小题 3 分,共 42 分。
每小题只有一个选项符合题目要求)
1.下列属于金属材料的是
A.钛合金 B.生物陶瓷 C.聚四氟乙烯 D.钢化玻璃
2.工业冶炼下列金属,采用的冶炼方法对应正确的是
A.Na—H2还原法 B.Fe—电解法
C.Cu—热分解法 D.Cr—铝热法
3.下列做法的目的与改变化学反应速率无关的是
A.瓜子包装内放置除氧剂 B.食盐中添加碘酸钾
C.青香蕉和苹果放一起催熟 D.红薯放在地窖中保存
4.下列装置中,能构成原电池的是
A. B.
C. D.
5.下列反应属于氮的固定作用的是
A.N2和 H2一定条件下反应制取 NH3 B.硝酸工厂用 NH3氧化制取 NO
C.铜与浓硝酸反应产生 NO2 D.由 NH3制碳酸氢铵和硫酸氨
1
.-
6.科技改变生活,下列说法正确的是
A.冬奥会使用的“被动房”利用太阳能和地热能供能,太阳能电池板的主要材料是二
氧化硅
B.天宫课堂“乙酸钠过饱和溶液”结晶形成热冰现象,属于吸热反应
C.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
D.被称为“冰丝带”的国家速滑馆采用二氧化碳超临界制冰技术,比传统制冷剂氟利
昂更加环保
7.下列反应中,既属于氧化还原反应又属于吸热反应的是
A.Ba(OH)2·8H2O与 NH4Cl反应 B.工业合成氨
C.灼热的炭与 CO2反应 D.葡萄糖在人体内生理氧化
8.反应 2NaHCO3 Na 2CO3 H 2O CO 2 可用于食品加工。下列说法正确的是
A.H2O的电子式:
B.Na 的结构示意图为
C.NaHCO3既含离子键又含共价键
D.中子数为 74 的碘原子:74I
9.硝酸是一种重要的化工原料,主要用于化肥、火药、染料、制药、塑料等产品的生产。
下列关于浓硝酸的说法不.正.确.的是
A.露置于空气中溶液浓度降低 B.光照易分解
C.能与碳反应说明其具有强氧化性 D.常温下铜在浓硝酸中发生钝化
10.已知在 1.01×105Pa、298K条件下,2mol 氢气在氧气中燃烧生成水蒸气放出 484kJ
热量。下列热化学方程式正确的是
1
A.H2O(g) = H2(g)+ O2(g)△H=+242kJ·mol-1
2
B.2H2(g)+O2(g)= 2H2O(l) △H=-484kJ·mol-1
1
C.H2(g)+ O2(g)=H2O(g) △H=+242kJ·mol-1
2
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
2
.-
11.下列物质不能由化合反应一步得到的是
A.Cu2S B.FeCl3 C.H2SiO3 D.NO2
12.下列实验过程中,溶液中始终无明显现象的是
A.NO2通入 FeSO4溶液中 B.CO2通入 NaAlO2溶液中
C.Cl2通入 NaOH溶液中 D.SO2通入 Na2SiO3溶液中
13.在 2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
14.设 NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mo1N2和 0.3molH2在一定条件下充分反应,生成的氨气分子数目为 0.2NA
B.34g过氧化氢中含有的极性键数目为 2NA
C.常温常压下,18g2H216O中含有的电子数目为 10NA
D.1molFe溶于过量稀硫酸,转移的电子数目为 3NA
15.如表为元素周期表的一部分。X、Y、Z、W 为短周期元素,其中 Y 元素的原子最外层电
子数是其电子层数的 3 倍。下列说法正确的是
X Y
Z W
T
A.Y 的氢化物的沸点一定比 X 氢化物的沸点高
B.Z 的氧化物对应的水化物酸性比 W 的弱
C.ZY2、XW4与 Na2Z 的化学键类型相同
D.根据元素周期律,可以推测存在 TZ2和 TW4
16.在 100 kPa时,1 mol石墨转化为金刚石,要吸收 1.895 kJ的热能。据此,试判断在
100 kPa压强下,下列结论正确的是
A.石墨和金刚石不能相互转化
B.金刚石比石墨稳定
C.破坏 1mol金刚石中的共价键消耗的能量比石墨多
D.1 mol石墨比 1 mol金刚石的总能量低
3
.-
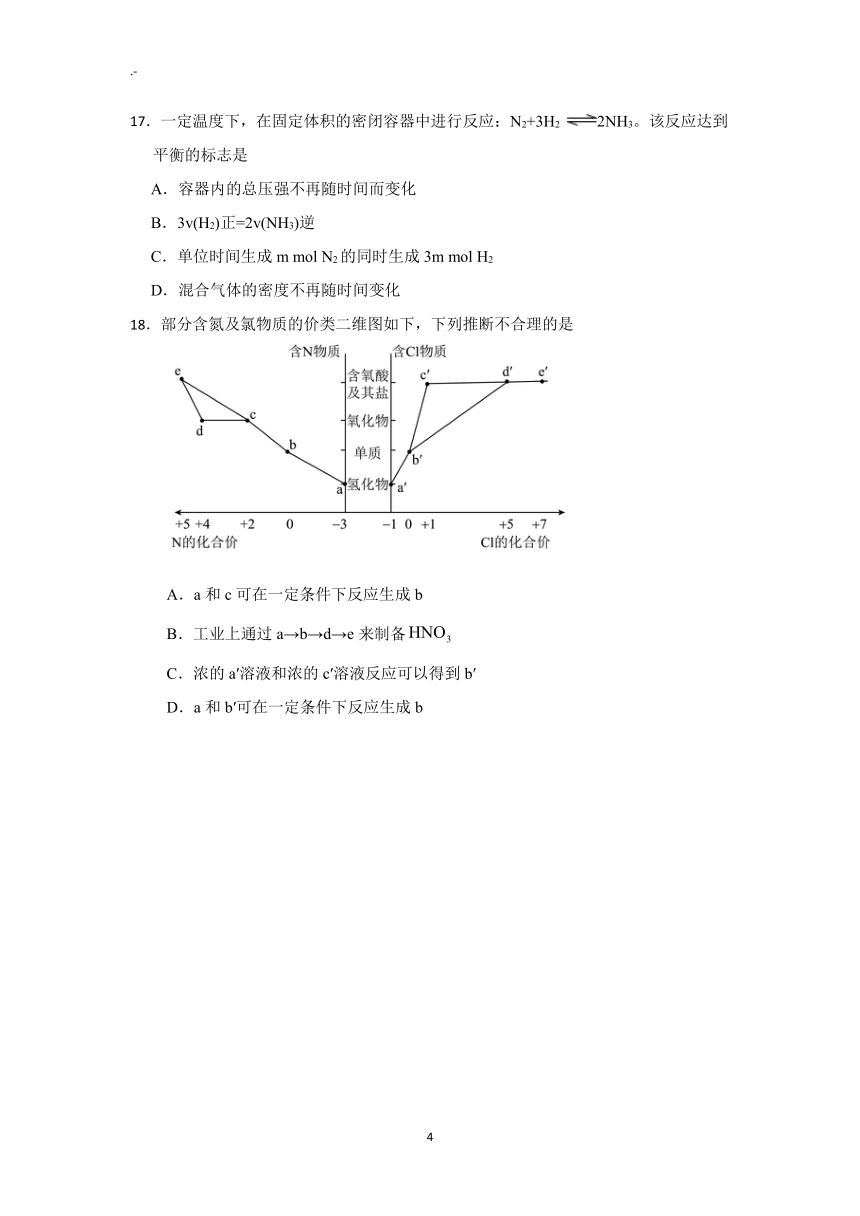
17.一定温度下,在固定体积的密闭容器中进行反应:N2+3H2 2NH3。该反应达到
平衡的标志是
A.容器内的总压强不再随时间而变化
B.3v(H2)正=2v(NH3)逆
C.单位时间生成 m mol N2的同时生成 3m mol H2
D.混合气体的密度不再随时间变化
18.部分含氮及氯物质的价类二维图如下,下列推断不合理的是
A.a和 c可在一定条件下反应生成 b
B.工业上通过 a→b→d→e来制备HNO3
C.浓的 a′溶液和浓的 c′溶液反应可以得到 b′
D.a和 b′可在一定条件下反应生成 b
4
.-
第Ⅱ卷 非选择题(共 58分)
二、非选择题(本题包括 5小题)
19.(12分)
(1)已知下列数据:
物质 NH3 H2O N2 O2
断裂 1mol化学键所需能量/kJ 391 463 942 496
则 68g氨气完全燃烧生成氮气和气态水放出的热量为 kJ。
(2)Ⅰ.中国科学院天津工业生物技术研究所以二氧化碳和氢气为原料首次实现了二
氧化碳到淀粉的从头合成,其第一步反应利用CO2和H2 在光催化酶作用下可以
高效合成甲醇(CH3OH )。其反应过程中的能量变化情况如图所示:
写出CO2 g 和H2 g 在光催化酶作用下合成甲醇[CH3OH g ]的热化学方程
式 ____________________________ 。
(3)①是没有催化剂、②是有催化剂的能量变化情况,选择适宜的催化剂 (填
“能”或“不能”)改变该反应的反应热。
(4)某温度时,在一个 2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间
的变化曲线如图所示。根据图中数据填空:
①该反应的化学方程式为 。
②反应开始至 2min,以气体 X表示的平均反应速率为 。
5
.-
③ 已知 X、Y、Z均为气体,则下列措施能增大反应速率的是 。
A. 升高温度 B. 降低压强
C. 减小 N的浓度 D. 将反应容器容积缩小
20.(8分)由 A、B、C、D四种金属按下表中装置进行实验。
装置
现象 二价金属 A不断溶解 C的质量增加 A上有气体产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__________________________(金属用对应字母表示)。
(2)装置乙中正极材料是_______(用字母表示)。
(3)装置丙中溶液的氢离子浓度_______(填“变大”“变小”或“不变”)。
(4)四种金属活泼性的强弱顺序是_____________________。
21.(13 分)下图为元素周期表的一部分,请参照元素①~⑦在表中的位置,用化学用
语回答下列问题:
族
ⅠA 0
周期
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ① ② ③
3 ④ ⑤ ⑥ ⑦
(1)③号元素在周期表中的位置是 ;上述元素处于同一主族的
有 和 (用元素符号表示);元素③和④能形成两种化合物,
写出其中既含有离子键又含有共价键的化合物是 。
(2)元素⑤的氧化物既能与②的最高价氧化物对应的水化物反应,也能和④的最
高价氧化物对应的水化物反应,该氧化物是 (填化学式),写出该氧化
物与④的最高价氧化物对应的水化物反应的离子方程式 。
6
.-
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料
(LiCoO2等)。根据下列要求回答问题:
① 63Li
7
和 3Li
7
作核反应堆最佳热载体, 3LiH
7
和 3LiD 用作高温堆减速
剂。下列说法正确的是 。
A 6. 3Li
7
和 3Li 互为同位素
B 6. 3Li
7
和 3Li 属于同种核素
C 7. 3LiH
7
和 3LiD 的化学性质不同
D 7 7. 3LiH 和 3LiD 是同种物质
②下列说法错误的是 。
A. 碱性:Be(OH)2<LiOH<NaOH<KOH
B. 微粒半径:K>Na>Li>Li+
C. 氧化性:Li+<Na+<K+<Rb+<Cs+
D. 金属性:Cs>Rb>K>Na>Li>Be
22.(13 分)某小组同学欲探究 NH3催化氧化反应,按如图所示装置进行实验。
已知装置 A、B 可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
(1)仪器 b 的名称为_______。
(2)装置 A 烧瓶中固体的作用为_______(填字母)。
A.催化剂 B.氧化剂 C.还原剂 D.反应物
(3)仪器 b 中盛放的试剂可以是_______(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.硫酸铜
7
.-
(4)装置 E 中发生反应的化学方程式为___________________________________。
(5)甲、乙两同学分别按上述装置进行实验,一段时间后:
①甲观察到装置 F 中只有白烟生成,白烟的成分是_______(写化学式)。
②乙观察到装置 F 中有红棕色气体,装置 G 中溶液变成蓝色。用离子方程式解释装
置 G 中溶液变成蓝色的原因:___________________________________。
(6)尾气处理装置所需的液体试剂是______________。
23.(12 分)工业上以钛铁矿[主要成分为钛酸亚铁 FeTiO3,含有 MgO、SiO2等杂质]为原料,
2+ 2+
制备金属钛和铁红的工艺流程如下:已知:酸溶时,FeTiO3转化为 Fe 和 TiO ;请回答
下列问题:
(1)FeTiO3中 Ti 元素的化合价为______价,“酸溶”过程,加快酸溶的措施有
(任写一项),滤渣 1 的化学式 。
(2)“酸溶”时,FeTiO3溶解的离子方程式为___ ___。
(3)“沉铁”中,反应温度不宜太高的原因为 _______ 。
(4)“煅烧”反应中,氧化剂和还原剂的物质的量之比为________________。
8
.-
泉州科技中学 2022-2023学年度第二学期期中考
高一化学参考答案及评分标准
第 I卷 (选择题 42分)
一、选择题(本大题共 18 小题,1-12小题每小题 2分,13-18小题每小题 3 分,共 42 分。
每小题只有一个选项符合题目要求)
题号 1 2 3 4 5 6 7 8 9
答案 A D B C A D C C D
题号 10 11 12 13 14 15 16 17 18
答案 A C C B B D D A B
第Ⅱ卷 (非选择题 58分)
二、非选择题(本大题共 5小题,共 58分)
19. (12分,每空 2分)
(1)1260
(2)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-360kJ mol 1
(3)不能
(4)①3X+Y 2Z
②0.075mol·L-1·min-1
③AD
20. (8分,每空 2分)
(1)A-2e-=A2+
(2)C
(3)变小
(4)D>A>B>C
21.(13分)
(1)第二周期ⅥA族(1分);C(1分);Si(1分);Na2O2(2分)
(2)Al2O3(2分);Al2O3+2OH =2AlO -2 +H2O(2 分)
(3)AD(2 分);C(2 分)
9
.-
22. (13分)
(1)干燥管 (1 分) (2)A (2 分) (3) B (2 分)
催化剂
(4) 4NH3+5O2 4NO+6H2O(2 分)
Δ
(5) NH4NO3 (2 分) 3Cu+8H++2NO -3 = 3Cu2++2NO↑+4H2O (2 分)
(6)NaOH 溶液 (2 分)
23.(12 分)
(1)+4 (2分);适当升温、增大反应物浓度、搅拌反应物等合理答案
(说明:“增大硫酸的浓度”也给分)(2分) ; SiO2 (2分)
(2) FeTiO3+4H+===Fe2++TiO2++2H2O (2分)
(3) 防止 NH4HCO3分解 (2分)
(4) 1:4(2分)
10
泉州科技中学 2022-2023学年度第二学期期中考
高一年 化学试卷
(考试时间:90分钟;满分:100分)
可能用到的相对原子质量:H-1 O-16 N-14
第Ⅰ卷 (选择题 42分)
一、选择题(本大题共 18 小题,1-12小题每小题 2分,13-18小题每小题 3 分,共 42 分。
每小题只有一个选项符合题目要求)
1.下列属于金属材料的是
A.钛合金 B.生物陶瓷 C.聚四氟乙烯 D.钢化玻璃
2.工业冶炼下列金属,采用的冶炼方法对应正确的是
A.Na—H2还原法 B.Fe—电解法
C.Cu—热分解法 D.Cr—铝热法
3.下列做法的目的与改变化学反应速率无关的是
A.瓜子包装内放置除氧剂 B.食盐中添加碘酸钾
C.青香蕉和苹果放一起催熟 D.红薯放在地窖中保存
4.下列装置中,能构成原电池的是
A. B.
C. D.
5.下列反应属于氮的固定作用的是
A.N2和 H2一定条件下反应制取 NH3 B.硝酸工厂用 NH3氧化制取 NO
C.铜与浓硝酸反应产生 NO2 D.由 NH3制碳酸氢铵和硫酸氨
1
.-
6.科技改变生活,下列说法正确的是
A.冬奥会使用的“被动房”利用太阳能和地热能供能,太阳能电池板的主要材料是二
氧化硅
B.天宫课堂“乙酸钠过饱和溶液”结晶形成热冰现象,属于吸热反应
C.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
D.被称为“冰丝带”的国家速滑馆采用二氧化碳超临界制冰技术,比传统制冷剂氟利
昂更加环保
7.下列反应中,既属于氧化还原反应又属于吸热反应的是
A.Ba(OH)2·8H2O与 NH4Cl反应 B.工业合成氨
C.灼热的炭与 CO2反应 D.葡萄糖在人体内生理氧化
8.反应 2NaHCO3 Na 2CO3 H 2O CO 2 可用于食品加工。下列说法正确的是
A.H2O的电子式:
B.Na 的结构示意图为
C.NaHCO3既含离子键又含共价键
D.中子数为 74 的碘原子:74I
9.硝酸是一种重要的化工原料,主要用于化肥、火药、染料、制药、塑料等产品的生产。
下列关于浓硝酸的说法不.正.确.的是
A.露置于空气中溶液浓度降低 B.光照易分解
C.能与碳反应说明其具有强氧化性 D.常温下铜在浓硝酸中发生钝化
10.已知在 1.01×105Pa、298K条件下,2mol 氢气在氧气中燃烧生成水蒸气放出 484kJ
热量。下列热化学方程式正确的是
1
A.H2O(g) = H2(g)+ O2(g)△H=+242kJ·mol-1
2
B.2H2(g)+O2(g)= 2H2O(l) △H=-484kJ·mol-1
1
C.H2(g)+ O2(g)=H2O(g) △H=+242kJ·mol-1
2
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
2
.-
11.下列物质不能由化合反应一步得到的是
A.Cu2S B.FeCl3 C.H2SiO3 D.NO2
12.下列实验过程中,溶液中始终无明显现象的是
A.NO2通入 FeSO4溶液中 B.CO2通入 NaAlO2溶液中
C.Cl2通入 NaOH溶液中 D.SO2通入 Na2SiO3溶液中
13.在 2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
14.设 NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mo1N2和 0.3molH2在一定条件下充分反应,生成的氨气分子数目为 0.2NA
B.34g过氧化氢中含有的极性键数目为 2NA
C.常温常压下,18g2H216O中含有的电子数目为 10NA
D.1molFe溶于过量稀硫酸,转移的电子数目为 3NA
15.如表为元素周期表的一部分。X、Y、Z、W 为短周期元素,其中 Y 元素的原子最外层电
子数是其电子层数的 3 倍。下列说法正确的是
X Y
Z W
T
A.Y 的氢化物的沸点一定比 X 氢化物的沸点高
B.Z 的氧化物对应的水化物酸性比 W 的弱
C.ZY2、XW4与 Na2Z 的化学键类型相同
D.根据元素周期律,可以推测存在 TZ2和 TW4
16.在 100 kPa时,1 mol石墨转化为金刚石,要吸收 1.895 kJ的热能。据此,试判断在
100 kPa压强下,下列结论正确的是
A.石墨和金刚石不能相互转化
B.金刚石比石墨稳定
C.破坏 1mol金刚石中的共价键消耗的能量比石墨多
D.1 mol石墨比 1 mol金刚石的总能量低
3
.-
17.一定温度下,在固定体积的密闭容器中进行反应:N2+3H2 2NH3。该反应达到
平衡的标志是
A.容器内的总压强不再随时间而变化
B.3v(H2)正=2v(NH3)逆
C.单位时间生成 m mol N2的同时生成 3m mol H2
D.混合气体的密度不再随时间变化
18.部分含氮及氯物质的价类二维图如下,下列推断不合理的是
A.a和 c可在一定条件下反应生成 b
B.工业上通过 a→b→d→e来制备HNO3
C.浓的 a′溶液和浓的 c′溶液反应可以得到 b′
D.a和 b′可在一定条件下反应生成 b
4
.-
第Ⅱ卷 非选择题(共 58分)
二、非选择题(本题包括 5小题)
19.(12分)
(1)已知下列数据:
物质 NH3 H2O N2 O2
断裂 1mol化学键所需能量/kJ 391 463 942 496
则 68g氨气完全燃烧生成氮气和气态水放出的热量为 kJ。
(2)Ⅰ.中国科学院天津工业生物技术研究所以二氧化碳和氢气为原料首次实现了二
氧化碳到淀粉的从头合成,其第一步反应利用CO2和H2 在光催化酶作用下可以
高效合成甲醇(CH3OH )。其反应过程中的能量变化情况如图所示:
写出CO2 g 和H2 g 在光催化酶作用下合成甲醇[CH3OH g ]的热化学方程
式 ____________________________ 。
(3)①是没有催化剂、②是有催化剂的能量变化情况,选择适宜的催化剂 (填
“能”或“不能”)改变该反应的反应热。
(4)某温度时,在一个 2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间
的变化曲线如图所示。根据图中数据填空:
①该反应的化学方程式为 。
②反应开始至 2min,以气体 X表示的平均反应速率为 。
5
.-
③ 已知 X、Y、Z均为气体,则下列措施能增大反应速率的是 。
A. 升高温度 B. 降低压强
C. 减小 N的浓度 D. 将反应容器容积缩小
20.(8分)由 A、B、C、D四种金属按下表中装置进行实验。
装置
现象 二价金属 A不断溶解 C的质量增加 A上有气体产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__________________________(金属用对应字母表示)。
(2)装置乙中正极材料是_______(用字母表示)。
(3)装置丙中溶液的氢离子浓度_______(填“变大”“变小”或“不变”)。
(4)四种金属活泼性的强弱顺序是_____________________。
21.(13 分)下图为元素周期表的一部分,请参照元素①~⑦在表中的位置,用化学用
语回答下列问题:
族
ⅠA 0
周期
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ① ② ③
3 ④ ⑤ ⑥ ⑦
(1)③号元素在周期表中的位置是 ;上述元素处于同一主族的
有 和 (用元素符号表示);元素③和④能形成两种化合物,
写出其中既含有离子键又含有共价键的化合物是 。
(2)元素⑤的氧化物既能与②的最高价氧化物对应的水化物反应,也能和④的最
高价氧化物对应的水化物反应,该氧化物是 (填化学式),写出该氧化
物与④的最高价氧化物对应的水化物反应的离子方程式 。
6
.-
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料
(LiCoO2等)。根据下列要求回答问题:
① 63Li
7
和 3Li
7
作核反应堆最佳热载体, 3LiH
7
和 3LiD 用作高温堆减速
剂。下列说法正确的是 。
A 6. 3Li
7
和 3Li 互为同位素
B 6. 3Li
7
和 3Li 属于同种核素
C 7. 3LiH
7
和 3LiD 的化学性质不同
D 7 7. 3LiH 和 3LiD 是同种物质
②下列说法错误的是 。
A. 碱性:Be(OH)2<LiOH<NaOH<KOH
B. 微粒半径:K>Na>Li>Li+
C. 氧化性:Li+<Na+<K+<Rb+<Cs+
D. 金属性:Cs>Rb>K>Na>Li>Be
22.(13 分)某小组同学欲探究 NH3催化氧化反应,按如图所示装置进行实验。
已知装置 A、B 可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
(1)仪器 b 的名称为_______。
(2)装置 A 烧瓶中固体的作用为_______(填字母)。
A.催化剂 B.氧化剂 C.还原剂 D.反应物
(3)仪器 b 中盛放的试剂可以是_______(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.硫酸铜
7
.-
(4)装置 E 中发生反应的化学方程式为___________________________________。
(5)甲、乙两同学分别按上述装置进行实验,一段时间后:
①甲观察到装置 F 中只有白烟生成,白烟的成分是_______(写化学式)。
②乙观察到装置 F 中有红棕色气体,装置 G 中溶液变成蓝色。用离子方程式解释装
置 G 中溶液变成蓝色的原因:___________________________________。
(6)尾气处理装置所需的液体试剂是______________。
23.(12 分)工业上以钛铁矿[主要成分为钛酸亚铁 FeTiO3,含有 MgO、SiO2等杂质]为原料,
2+ 2+
制备金属钛和铁红的工艺流程如下:已知:酸溶时,FeTiO3转化为 Fe 和 TiO ;请回答
下列问题:
(1)FeTiO3中 Ti 元素的化合价为______价,“酸溶”过程,加快酸溶的措施有
(任写一项),滤渣 1 的化学式 。
(2)“酸溶”时,FeTiO3溶解的离子方程式为___ ___。
(3)“沉铁”中,反应温度不宜太高的原因为 _______ 。
(4)“煅烧”反应中,氧化剂和还原剂的物质的量之比为________________。
8
.-
泉州科技中学 2022-2023学年度第二学期期中考
高一化学参考答案及评分标准
第 I卷 (选择题 42分)
一、选择题(本大题共 18 小题,1-12小题每小题 2分,13-18小题每小题 3 分,共 42 分。
每小题只有一个选项符合题目要求)
题号 1 2 3 4 5 6 7 8 9
答案 A D B C A D C C D
题号 10 11 12 13 14 15 16 17 18
答案 A C C B B D D A B
第Ⅱ卷 (非选择题 58分)
二、非选择题(本大题共 5小题,共 58分)
19. (12分,每空 2分)
(1)1260
(2)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-360kJ mol 1
(3)不能
(4)①3X+Y 2Z
②0.075mol·L-1·min-1
③AD
20. (8分,每空 2分)
(1)A-2e-=A2+
(2)C
(3)变小
(4)D>A>B>C
21.(13分)
(1)第二周期ⅥA族(1分);C(1分);Si(1分);Na2O2(2分)
(2)Al2O3(2分);Al2O3+2OH =2AlO -2 +H2O(2 分)
(3)AD(2 分);C(2 分)
9
.-
22. (13分)
(1)干燥管 (1 分) (2)A (2 分) (3) B (2 分)
催化剂
(4) 4NH3+5O2 4NO+6H2O(2 分)
Δ
(5) NH4NO3 (2 分) 3Cu+8H++2NO -3 = 3Cu2++2NO↑+4H2O (2 分)
(6)NaOH 溶液 (2 分)
23.(12 分)
(1)+4 (2分);适当升温、增大反应物浓度、搅拌反应物等合理答案
(说明:“增大硫酸的浓度”也给分)(2分) ; SiO2 (2分)
(2) FeTiO3+4H+===Fe2++TiO2++2H2O (2分)
(3) 防止 NH4HCO3分解 (2分)
(4) 1:4(2分)
10
同课章节目录
