四川省德阳市第五高级中学2022-2023学年高二下学期5月月考化学试题(PDF版含答案)
文档属性
| 名称 | 四川省德阳市第五高级中学2022-2023学年高二下学期5月月考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-02 06:52:12 | ||
图片预览


文档简介
德阳五中高 2021级高二下期 5月考试
化学试卷
(总分 100分 答题时间 90分钟)
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 8页。
2.答卷前,考生务必将自己的姓名、考号填写在答题卡上。答卷时,考生务必将答案涂
写在答题卷上,答在试卷上的无效。
3.可能用到的相对原子质量: N-14 O-16 Cl-35.5 Cu-64
第Ⅰ卷(选择题,共 42 分)
注意事项:
1.本题共 14小题,每小题 3分,共 42分。
2.每小题均只.有.一.个.正确答案,请用 2B铅笔将答题卡上对应题目的正确答案标号涂黑。
一、选择题(每小题 3分,共 42分)
1.化学与社会、生产、生活紧切相关。下列说法正确的是
A.煤经过气化和液化等物理变化可转化为清洁燃料
B.施用化肥时,将草木灰与氯化铵混合使用可增加肥效
C.医用消毒酒精中乙醇的浓度(体积分数)为 95%
D.“地沟油”禁止食用,但可以用来制肥皂
2.下列化学用语正确的是
A.丙烯的键线式: B. CH3的电子式:
C.硝基苯的结构简式: D.聚丙烯的结构简式:
3.下列说法不正确的是
A.可用 NaOH溶液鉴别矿物油和花生油
B.可用新制 Cu(OH)2鉴别乙醇、乙酸、葡萄糖溶液
C.某些蛋白质与浓硝酸作用会产生黄色固体物质,可用这一特征检验蛋白质
D.在淀粉水解液中加入 NaOH溶液,再加入碘水,溶液未变蓝,说明淀粉已水解完全
化学试卷 第 1页(共 8页)
4.下列离子方程式书写错误的是
A.用铜作电极电解 AgNO3溶液:4Ag++2H O电解2 4Ag+O2↑+4H+
B.小苏打溶液呈碱性:HCO3-+H2O H2CO3+OH-
C.向 AgCl悬浊液中加入 Na2S固体:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
D.用 K3[Fe(CN)6]检验 Fe2+:2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
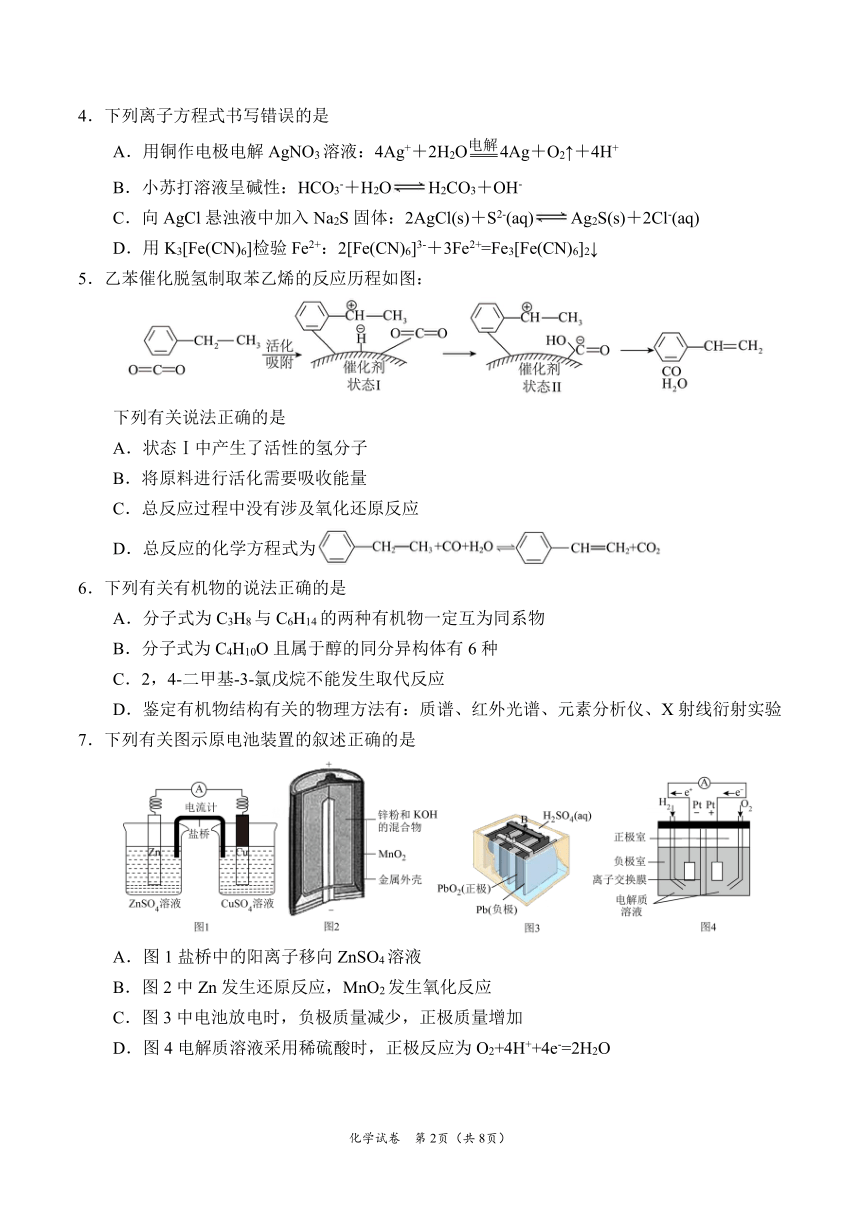
5.乙苯催化脱氢制取苯乙烯的反应历程如图:
下列有关说法正确的是
A.状态Ⅰ中产生了活性的氢分子
B.将原料进行活化需要吸收能量
C.总反应过程中没有涉及氧化还原反应
D.总反应的化学方程式为
6.下列有关有机物的说法正确的是
A.分子式为 C3H8与 C6H14的两种有机物一定互为同系物
B.分子式为 C4H10O且属于醇的同分异构体有 6种
C.2,4-二甲基-3-氯戊烷不能发生取代反应
D.鉴定有机物结构有关的物理方法有:质谱、红外光谱、元素分析仪、X射线衍射实验
7.下列有关图示原电池装置的叙述正确的是
A.图 1盐桥中的阳离子移向 ZnSO4溶液
B.图 2中 Zn发生还原反应,MnO2发生氧化反应
C.图 3中电池放电时,负极质量减少,正极质量增加
D.图 4电解质溶液采用稀硫酸时,正极反应为 O2+4H++4e-=2H2O
化学试卷 第 2页(共 8页)
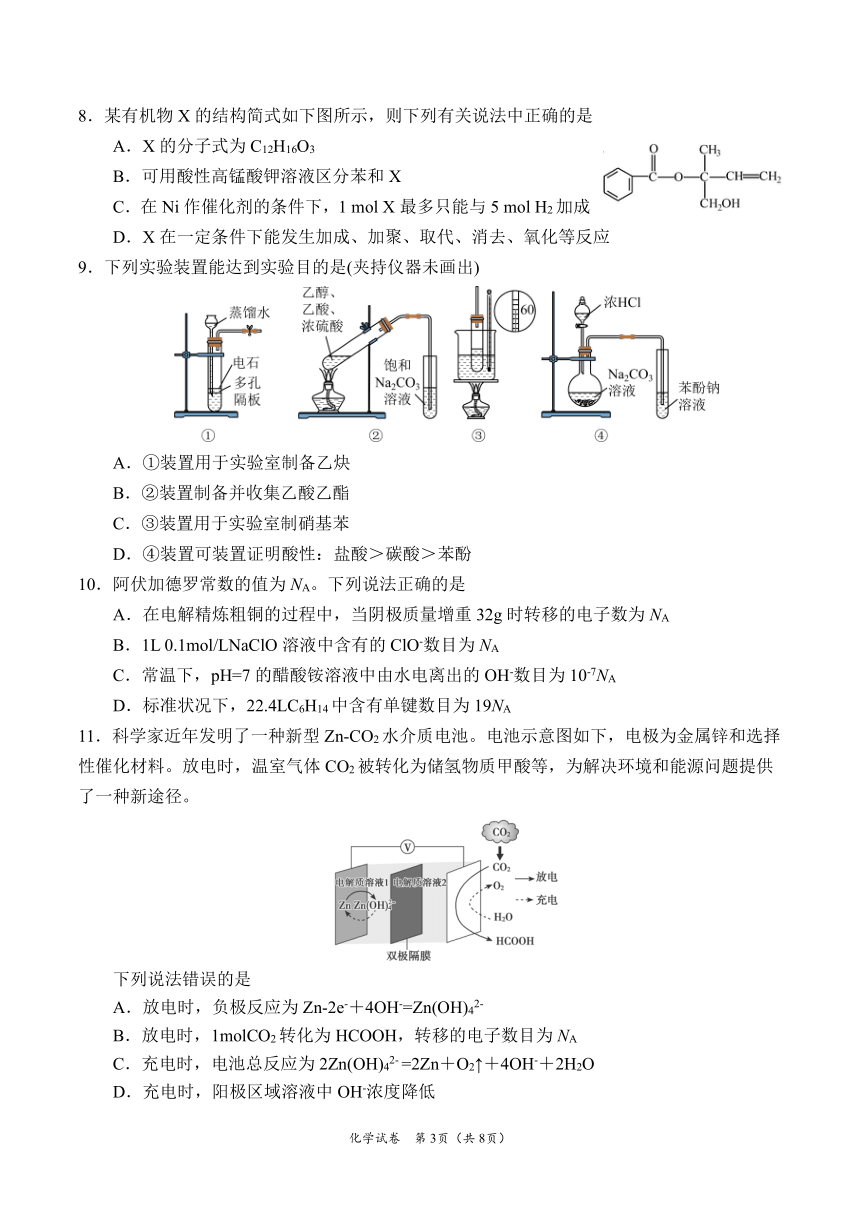
8.某有机物 X的结构简式如下图所示,则下列有关说法中正确的是
A.X的分子式为 C12H16O3
B.可用酸性高锰酸钾溶液区分苯和 X
C.在 Ni作催化剂的条件下,1 mol X最多只能与 5 mol H2加成
D.X在一定条件下能发生加成、加聚、取代、消去、氧化等反应
9.下列实验装置能达到实验目的是(夹持仪器未画出)
A.①装置用于实验室制备乙炔
B.②装置制备并收集乙酸乙酯
C.③装置用于实验室制硝基苯
D.④装置可装置证明酸性:盐酸>碳酸>苯酚
10.阿伏加德罗常数的值为 NA。下列说法正确的是
A.在电解精炼粗铜的过程中,当阴极质量增重 32g时转移的电子数为 NA
B.1L 0.1mol/LNaClO溶液中含有的 ClO-数目为 NA
C.常温下,pH=7的醋酸铵溶液中由水电离出的 OH-数目为 10-7NA
D.标准状况下,22.4LC6H14中含有单键数目为 19NA
11.科学家近年发明了一种新型 Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择
性催化材料。放电时,温室气体 CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供
了一种新途径。
下列说法错误的是
A.放电时,负极反应为 Zn-2e-+4OH-=Zn(OH)42-
B.放电时,1molCO2转化为 HCOOH,转移的电子数目为 NA
C.充电时,电池总反应为 2Zn(OH)42-=2Zn+O2↑+4OH-+2H2O
D.充电时,阳极区域溶液中 OH-浓度降低
化学试卷 第 3页(共 8页)
12.为减轻环境污染,提高资源的利用率,可将钛厂、氯碱厂和甲醇厂联合进行生产。生产工
艺流程如下:
已知:“氯化”过程在高温下进行,且该过程中Ti元素的化合价没有变化。
下列叙述错误的是
A.FeTiO3中Ti为+4价
B.“合成”过程中原子利用率为 100%
C.“氯化”时发生反应的化学方程式为
7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO
D.上述流程中“Mg,Ar”可用“Mg,CO2”代替
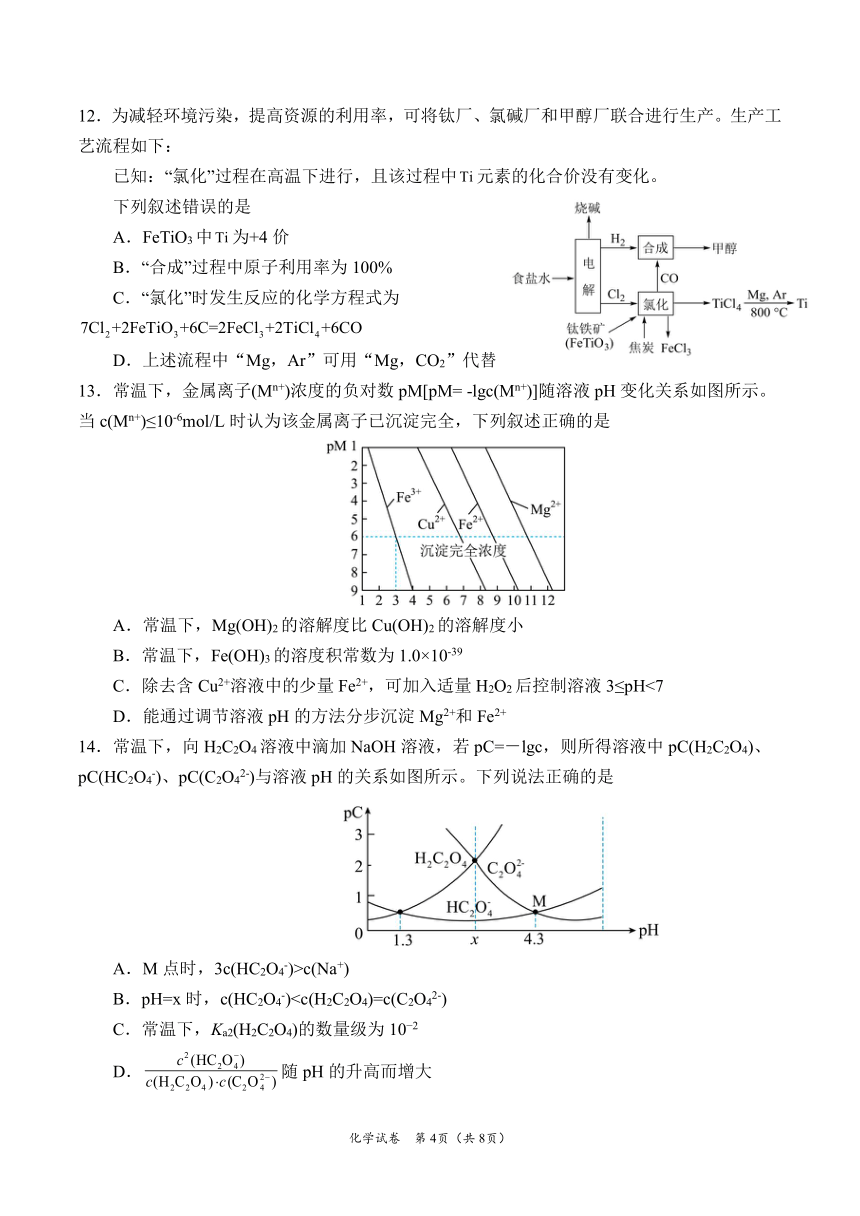
13.常温下,金属离子(Mn+)浓度的负对数 pM[pM= -lgc(Mn+)]随溶液 pH变化关系如图所示。
当 c(Mn+)≤10-6mol/L时认为该金属离子已沉淀完全,下列叙述正确的是
A.常温下,Mg(OH)2的溶解度比 Cu(OH)2的溶解度小
B.常温下,Fe(OH)3的溶度积常数为 1.0×10-39
C.除去含 Cu2+溶液中的少量 Fe2+,可加入适量 H2O2后控制溶液 3≤pH<7
D.能通过调节溶液 pH的方法分步沉淀Mg2+和 Fe2+
14.常温下,向 H2C2O4溶液中滴加 NaOH溶液,若 pC=-lgc,则所得溶液中 pC(H2C2O4)、
pC(HC2O4-)、pC(C2O42-)与溶液 pH的关系如图所示。下列说法正确的是
A.M点时,3c(HC2O4-)>c(Na+)
B.pH=x时,c(HC2O4-)C.常温下,Ka2(H2C2O4)的数量级为 10 2
c2 (HC O
D. 2 4
)
c(H2C2O4 ) c(C
2 随 pH的升高而增大
2O 4 )
化学试卷 第 4页(共 8页)
第 II 卷(非选择题,共 58 分)
注意事项:
主观题答案请用 0.5 毫米黑色墨迹签字笔在答题卷相应的位置作答,不得超出答题区域。
二、填空题(本题包括 5个小题,共 58分)
15.(12分)
(1)书写对应的化学用语:
①氯化铁溶液可作净水剂,用离子方程式解释其原理为 。
②氯碱工业对应的离子方程式为 。
(2)常温下,有下列 4种溶液
a. pH=11的氨水 b. pH=11的氢氧化钠溶液 c. pH=3的醋酸 d. pH=3的盐酸
①在 a和 b中分别加入适量的氯化铵晶体后,两种溶液的 pH均___________(填“增大”“减
小”或“不变”)。
②将溶液 a和 d按比例混合后溶液恰好为中性,所得溶液中离子浓度从大到小排列的顺序
为 。
(3)聚丙烯酸钠、涤纶的结构简式如图:
①合成聚丙烯酸钠的单体的结构简式是 。
②合成涤纶的单体有两种,其中能和 Na2CO3 反应的单体的结构简式是 。
16.(12分)亚硝酰氯(NOCl)是有机物合成中的重要试剂,是一种红褐色液体或黄色气体,遇
水易水解。某化学小组利用 NO和 Cl2在实验室中制备 NOCl,装置如图。
E
已知:沸点 Cl2为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与 O2反应。
回答下列问题:
化学试卷 第 5页(共 8页)
(1)仪器 a的名称: 。
(2)NO和氯气混合前,先关闭 K3,打开 K1、K2,操作的目的为 。
(3)装置 C中长颈漏斗的作用是 。
(4)若不用装置 E对实验有何影响 (用化学方程式说明)。
(5)亚硝酰氯(NOCl)纯度的测定。取 D中所得液体 20g溶于适量的 NaOH溶液中,配制
成250mL溶液;取出25.00mL样品溶液于锥形瓶中,以K2CrO4溶液为指示剂,用 cmol L-1AgNO3
标准溶液滴定至终点,消耗标准溶液的体积为 VmL(已知 Ag2CrO4为砖红色固体)。
①滴定终点的现象:当滴入最后半滴 AgNO3标准溶液后, 。
②亚硝酰氯(NOCl)的质量分数为 (用含 c、V的表达式表示)。
17. (12分)有机物M常做消毒剂、抗氧化剂等,用芳香烃 A制备M的一种合成路线如
E
已知:
(1)A的结构简式为___________;D中官能团的名称为 。
(2)C生成 D的反应类型为___________;G的分子式为 。
(3)由 E与足量氢氧化钠的乙醇溶液反应的化学方程式为 。
(4)M的结构简式为 。
(5)芳香族化合物 H与 C互为同分异构体,且能发生水解反应,则符合要求的 H的结构
共有___________种;写出其中核磁共振氢谱有 4组峰,且峰面积之比为 1:2:2:3的一种复
合条件的结构简式 。
(6)参照上述合成路线和信息,以苯甲酸甲酯和 CH3MgBr 为原料(无机试剂任选)设计制
备 的合成路线 。
化学试卷 第 6页(共 8页)
18.(12分)将 CO2氢化制备 CO的反应称为逆水煤气变换反应 RWGS ,工业上常利用RWGS
反应制备化工原料CO,此举可有效缓解温室效应。涉及反应如下:
RWGS反应 I:CO2(g)+H2(g) CO(g)+H2O(g) △H1= +41.2kJ·mol-1
副反应 II:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H2= -164kJ·mol-1
回答下列问题:
(1)反应 CH4(g)+H2O(g) CO(g)+3H2(g) △H=____________kJ·mol-1。
(2)相比 RWGS反应,副反应 II 在化学热力学上进行的趋势很大,原因为
。
(3)研究表明由不同的方法制备得到的 Ni-CO2催化剂对 RWGS反应的催化活性和选择
性不同。在某恒压密闭容器中充入一定量 CO2(g)和 H2(g),在不同的温度下反应相同的时间,
实验测得 CO2转化率、CH4的选择性与反应温度的关系分别如图 1和图 2所示:
600℃时,为提高 CO的产率,适宜选择的催化剂为____________(填“Ni CeO2 IM800”
或“Ni CeO2 CP800 ”),原因为 。
(4)T℃时,在某刚性密闭容器中充入1molCO2(g)和 2molH2(g),发生反应 I和反应 II,
达到平衡时测得 CO2转化率为 40%,生成 0.2mol CH4。平衡时,该温度下 RWGS反应的平衡
常数为____________。
(5)对于反应Ⅰ和反应Ⅱ同时发生的体系,在投料比一定时测得CO2的平衡转化率与压
强(0.1MPa、1MPa、10MPa)、温度的关系如图所示。L1、L2、L3三条曲线中表征压强是 0.1MPa
的是____________(填“L1”“L2”或“L3”)。
化学试卷 第 7页(共 8页)
19.(10分)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为 NiFe2O4(铁酸镍)、
NiO、FeO、CaO、SiO2等]中回收 NiSO4的工艺流程如下:
已知(NH4)2SO4在 350℃分解生成 NH3和 H2SO4,回答下列问题:
(1)焙烧前将矿渣与(NH4)2SO4粉碎研磨,粉碎的目的是 。
(2)“浸渣”的成分有 Fe2O3、FeO(OH)、SiO2外,还含有___________(化学式)。
(3)矿渣中部分 FeO有氧焙烧时与 H2SO4反应生成 Fe2(SO4)3的化学方程式为
。
(4)已知除钙后溶液中 c(Ca2+)=1.0×10-5mol·L-1,则此时溶液中的 c(F-)=
mol·L-1 Ksp CaF2 4.0 10
11 。
(5)以 Fe、Ni为电极制取 Na2FeO4的原理如图所示(a与 b是离子交换膜)。通电后,在
铁电极附近生成紫红色的 FeO42-。
①电解时阳极的电极反应式为 。
②离子交换膜 b为___________(填“阴”或“阳”)离子交换膜。
化学试卷 第 8页(共 8页)
德阳五中高 2021级高二下期 5月考试
化学参考答案
一、选择题(每小题 3分,共 42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D B D A B A D B C A B D B A
二、非选择题(共 58分)
15.(本题 12分,每空 2分)
3
(1)①Fe +3H2O Fe(OH)3 3H ② 2Cl-+ 2H2O 2NaOH + H2↑ + Cl2↑
+ - + -
(2)①减小 ② c(NH4 )=c(Cl )>c(H )=c(OH )
(3)① ②
16.(本题 12分,除标注外每空 2分)
(1)蒸馏烧瓶(1分)
(2)排出装置中的空气,防止 NOCl、NO与空气中的 O2反应
(3)平衡体系内外压强,避免 C中压强过大
(4)-34℃<T≤-6℃
(5)NOCl + H2O = HNO2+ HCl
(6)溶液中产生砖红色沉淀,且半分钟内不消失(1分)
3.275cV%(列出表达式也得分)
17.(本题 12分)
(1) (1分) 羧基、氯原子(1分)
(2) 取代反应(1分) C10H16O2(1分)
C2H5OH
(3) +2NaOH +NaCl+2H2O(2分)
化学参考答案 第 1页(共 1页)
(4) (1分)
(5) 6(2分) (或 或 )(1分)
(6) (2分)
18.(本题 12分,每空 2分)
(1) +205.2 (2)反应 II 为放热量较大的反应
(3) Ni-CO2-CP800 CO2的转化率高,CH4的选择性相差不大
(4)0.2 (5)L1
19.(本题 10分,除标注外每空 2分)
(1)增大反应物接触面积,加快化学反应速率,使反应更充分
(2) CaSO4 (1分) (3)4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O
(4)2.0×10-3
(5)①Fe-6e-+8OH-=FeO 2 4 +4H2O ② 阴(1分)
说明:其它合理答案,可参照评分标准适当给分。
化学参考答案 第 2页(共 1页)
化学试卷
(总分 100分 答题时间 90分钟)
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 8页。
2.答卷前,考生务必将自己的姓名、考号填写在答题卡上。答卷时,考生务必将答案涂
写在答题卷上,答在试卷上的无效。
3.可能用到的相对原子质量: N-14 O-16 Cl-35.5 Cu-64
第Ⅰ卷(选择题,共 42 分)
注意事项:
1.本题共 14小题,每小题 3分,共 42分。
2.每小题均只.有.一.个.正确答案,请用 2B铅笔将答题卡上对应题目的正确答案标号涂黑。
一、选择题(每小题 3分,共 42分)
1.化学与社会、生产、生活紧切相关。下列说法正确的是
A.煤经过气化和液化等物理变化可转化为清洁燃料
B.施用化肥时,将草木灰与氯化铵混合使用可增加肥效
C.医用消毒酒精中乙醇的浓度(体积分数)为 95%
D.“地沟油”禁止食用,但可以用来制肥皂
2.下列化学用语正确的是
A.丙烯的键线式: B. CH3的电子式:
C.硝基苯的结构简式: D.聚丙烯的结构简式:
3.下列说法不正确的是
A.可用 NaOH溶液鉴别矿物油和花生油
B.可用新制 Cu(OH)2鉴别乙醇、乙酸、葡萄糖溶液
C.某些蛋白质与浓硝酸作用会产生黄色固体物质,可用这一特征检验蛋白质
D.在淀粉水解液中加入 NaOH溶液,再加入碘水,溶液未变蓝,说明淀粉已水解完全
化学试卷 第 1页(共 8页)
4.下列离子方程式书写错误的是
A.用铜作电极电解 AgNO3溶液:4Ag++2H O电解2 4Ag+O2↑+4H+
B.小苏打溶液呈碱性:HCO3-+H2O H2CO3+OH-
C.向 AgCl悬浊液中加入 Na2S固体:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
D.用 K3[Fe(CN)6]检验 Fe2+:2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
5.乙苯催化脱氢制取苯乙烯的反应历程如图:
下列有关说法正确的是
A.状态Ⅰ中产生了活性的氢分子
B.将原料进行活化需要吸收能量
C.总反应过程中没有涉及氧化还原反应
D.总反应的化学方程式为
6.下列有关有机物的说法正确的是
A.分子式为 C3H8与 C6H14的两种有机物一定互为同系物
B.分子式为 C4H10O且属于醇的同分异构体有 6种
C.2,4-二甲基-3-氯戊烷不能发生取代反应
D.鉴定有机物结构有关的物理方法有:质谱、红外光谱、元素分析仪、X射线衍射实验
7.下列有关图示原电池装置的叙述正确的是
A.图 1盐桥中的阳离子移向 ZnSO4溶液
B.图 2中 Zn发生还原反应,MnO2发生氧化反应
C.图 3中电池放电时,负极质量减少,正极质量增加
D.图 4电解质溶液采用稀硫酸时,正极反应为 O2+4H++4e-=2H2O
化学试卷 第 2页(共 8页)
8.某有机物 X的结构简式如下图所示,则下列有关说法中正确的是
A.X的分子式为 C12H16O3
B.可用酸性高锰酸钾溶液区分苯和 X
C.在 Ni作催化剂的条件下,1 mol X最多只能与 5 mol H2加成
D.X在一定条件下能发生加成、加聚、取代、消去、氧化等反应
9.下列实验装置能达到实验目的是(夹持仪器未画出)
A.①装置用于实验室制备乙炔
B.②装置制备并收集乙酸乙酯
C.③装置用于实验室制硝基苯
D.④装置可装置证明酸性:盐酸>碳酸>苯酚
10.阿伏加德罗常数的值为 NA。下列说法正确的是
A.在电解精炼粗铜的过程中,当阴极质量增重 32g时转移的电子数为 NA
B.1L 0.1mol/LNaClO溶液中含有的 ClO-数目为 NA
C.常温下,pH=7的醋酸铵溶液中由水电离出的 OH-数目为 10-7NA
D.标准状况下,22.4LC6H14中含有单键数目为 19NA
11.科学家近年发明了一种新型 Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择
性催化材料。放电时,温室气体 CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供
了一种新途径。
下列说法错误的是
A.放电时,负极反应为 Zn-2e-+4OH-=Zn(OH)42-
B.放电时,1molCO2转化为 HCOOH,转移的电子数目为 NA
C.充电时,电池总反应为 2Zn(OH)42-=2Zn+O2↑+4OH-+2H2O
D.充电时,阳极区域溶液中 OH-浓度降低
化学试卷 第 3页(共 8页)
12.为减轻环境污染,提高资源的利用率,可将钛厂、氯碱厂和甲醇厂联合进行生产。生产工
艺流程如下:
已知:“氯化”过程在高温下进行,且该过程中Ti元素的化合价没有变化。
下列叙述错误的是
A.FeTiO3中Ti为+4价
B.“合成”过程中原子利用率为 100%
C.“氯化”时发生反应的化学方程式为
7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO
D.上述流程中“Mg,Ar”可用“Mg,CO2”代替
13.常温下,金属离子(Mn+)浓度的负对数 pM[pM= -lgc(Mn+)]随溶液 pH变化关系如图所示。
当 c(Mn+)≤10-6mol/L时认为该金属离子已沉淀完全,下列叙述正确的是
A.常温下,Mg(OH)2的溶解度比 Cu(OH)2的溶解度小
B.常温下,Fe(OH)3的溶度积常数为 1.0×10-39
C.除去含 Cu2+溶液中的少量 Fe2+,可加入适量 H2O2后控制溶液 3≤pH<7
D.能通过调节溶液 pH的方法分步沉淀Mg2+和 Fe2+
14.常温下,向 H2C2O4溶液中滴加 NaOH溶液,若 pC=-lgc,则所得溶液中 pC(H2C2O4)、
pC(HC2O4-)、pC(C2O42-)与溶液 pH的关系如图所示。下列说法正确的是
A.M点时,3c(HC2O4-)>c(Na+)
B.pH=x时,c(HC2O4-)
c2 (HC O
D. 2 4
)
c(H2C2O4 ) c(C
2 随 pH的升高而增大
2O 4 )
化学试卷 第 4页(共 8页)
第 II 卷(非选择题,共 58 分)
注意事项:
主观题答案请用 0.5 毫米黑色墨迹签字笔在答题卷相应的位置作答,不得超出答题区域。
二、填空题(本题包括 5个小题,共 58分)
15.(12分)
(1)书写对应的化学用语:
①氯化铁溶液可作净水剂,用离子方程式解释其原理为 。
②氯碱工业对应的离子方程式为 。
(2)常温下,有下列 4种溶液
a. pH=11的氨水 b. pH=11的氢氧化钠溶液 c. pH=3的醋酸 d. pH=3的盐酸
①在 a和 b中分别加入适量的氯化铵晶体后,两种溶液的 pH均___________(填“增大”“减
小”或“不变”)。
②将溶液 a和 d按比例混合后溶液恰好为中性,所得溶液中离子浓度从大到小排列的顺序
为 。
(3)聚丙烯酸钠、涤纶的结构简式如图:
①合成聚丙烯酸钠的单体的结构简式是 。
②合成涤纶的单体有两种,其中能和 Na2CO3 反应的单体的结构简式是 。
16.(12分)亚硝酰氯(NOCl)是有机物合成中的重要试剂,是一种红褐色液体或黄色气体,遇
水易水解。某化学小组利用 NO和 Cl2在实验室中制备 NOCl,装置如图。
E
已知:沸点 Cl2为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与 O2反应。
回答下列问题:
化学试卷 第 5页(共 8页)
(1)仪器 a的名称: 。
(2)NO和氯气混合前,先关闭 K3,打开 K1、K2,操作的目的为 。
(3)装置 C中长颈漏斗的作用是 。
(4)若不用装置 E对实验有何影响 (用化学方程式说明)。
(5)亚硝酰氯(NOCl)纯度的测定。取 D中所得液体 20g溶于适量的 NaOH溶液中,配制
成250mL溶液;取出25.00mL样品溶液于锥形瓶中,以K2CrO4溶液为指示剂,用 cmol L-1AgNO3
标准溶液滴定至终点,消耗标准溶液的体积为 VmL(已知 Ag2CrO4为砖红色固体)。
①滴定终点的现象:当滴入最后半滴 AgNO3标准溶液后, 。
②亚硝酰氯(NOCl)的质量分数为 (用含 c、V的表达式表示)。
17. (12分)有机物M常做消毒剂、抗氧化剂等,用芳香烃 A制备M的一种合成路线如
E
已知:
(1)A的结构简式为___________;D中官能团的名称为 。
(2)C生成 D的反应类型为___________;G的分子式为 。
(3)由 E与足量氢氧化钠的乙醇溶液反应的化学方程式为 。
(4)M的结构简式为 。
(5)芳香族化合物 H与 C互为同分异构体,且能发生水解反应,则符合要求的 H的结构
共有___________种;写出其中核磁共振氢谱有 4组峰,且峰面积之比为 1:2:2:3的一种复
合条件的结构简式 。
(6)参照上述合成路线和信息,以苯甲酸甲酯和 CH3MgBr 为原料(无机试剂任选)设计制
备 的合成路线 。
化学试卷 第 6页(共 8页)
18.(12分)将 CO2氢化制备 CO的反应称为逆水煤气变换反应 RWGS ,工业上常利用RWGS
反应制备化工原料CO,此举可有效缓解温室效应。涉及反应如下:
RWGS反应 I:CO2(g)+H2(g) CO(g)+H2O(g) △H1= +41.2kJ·mol-1
副反应 II:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H2= -164kJ·mol-1
回答下列问题:
(1)反应 CH4(g)+H2O(g) CO(g)+3H2(g) △H=____________kJ·mol-1。
(2)相比 RWGS反应,副反应 II 在化学热力学上进行的趋势很大,原因为
。
(3)研究表明由不同的方法制备得到的 Ni-CO2催化剂对 RWGS反应的催化活性和选择
性不同。在某恒压密闭容器中充入一定量 CO2(g)和 H2(g),在不同的温度下反应相同的时间,
实验测得 CO2转化率、CH4的选择性与反应温度的关系分别如图 1和图 2所示:
600℃时,为提高 CO的产率,适宜选择的催化剂为____________(填“Ni CeO2 IM800”
或“Ni CeO2 CP800 ”),原因为 。
(4)T℃时,在某刚性密闭容器中充入1molCO2(g)和 2molH2(g),发生反应 I和反应 II,
达到平衡时测得 CO2转化率为 40%,生成 0.2mol CH4。平衡时,该温度下 RWGS反应的平衡
常数为____________。
(5)对于反应Ⅰ和反应Ⅱ同时发生的体系,在投料比一定时测得CO2的平衡转化率与压
强(0.1MPa、1MPa、10MPa)、温度的关系如图所示。L1、L2、L3三条曲线中表征压强是 0.1MPa
的是____________(填“L1”“L2”或“L3”)。
化学试卷 第 7页(共 8页)
19.(10分)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为 NiFe2O4(铁酸镍)、
NiO、FeO、CaO、SiO2等]中回收 NiSO4的工艺流程如下:
已知(NH4)2SO4在 350℃分解生成 NH3和 H2SO4,回答下列问题:
(1)焙烧前将矿渣与(NH4)2SO4粉碎研磨,粉碎的目的是 。
(2)“浸渣”的成分有 Fe2O3、FeO(OH)、SiO2外,还含有___________(化学式)。
(3)矿渣中部分 FeO有氧焙烧时与 H2SO4反应生成 Fe2(SO4)3的化学方程式为
。
(4)已知除钙后溶液中 c(Ca2+)=1.0×10-5mol·L-1,则此时溶液中的 c(F-)=
mol·L-1 Ksp CaF2 4.0 10
11 。
(5)以 Fe、Ni为电极制取 Na2FeO4的原理如图所示(a与 b是离子交换膜)。通电后,在
铁电极附近生成紫红色的 FeO42-。
①电解时阳极的电极反应式为 。
②离子交换膜 b为___________(填“阴”或“阳”)离子交换膜。
化学试卷 第 8页(共 8页)
德阳五中高 2021级高二下期 5月考试
化学参考答案
一、选择题(每小题 3分,共 42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D B D A B A D B C A B D B A
二、非选择题(共 58分)
15.(本题 12分,每空 2分)
3
(1)①Fe +3H2O Fe(OH)3 3H ② 2Cl-+ 2H2O 2NaOH + H2↑ + Cl2↑
+ - + -
(2)①减小 ② c(NH4 )=c(Cl )>c(H )=c(OH )
(3)① ②
16.(本题 12分,除标注外每空 2分)
(1)蒸馏烧瓶(1分)
(2)排出装置中的空气,防止 NOCl、NO与空气中的 O2反应
(3)平衡体系内外压强,避免 C中压强过大
(4)-34℃<T≤-6℃
(5)NOCl + H2O = HNO2+ HCl
(6)溶液中产生砖红色沉淀,且半分钟内不消失(1分)
3.275cV%(列出表达式也得分)
17.(本题 12分)
(1) (1分) 羧基、氯原子(1分)
(2) 取代反应(1分) C10H16O2(1分)
C2H5OH
(3) +2NaOH +NaCl+2H2O(2分)
化学参考答案 第 1页(共 1页)
(4) (1分)
(5) 6(2分) (或 或 )(1分)
(6) (2分)
18.(本题 12分,每空 2分)
(1) +205.2 (2)反应 II 为放热量较大的反应
(3) Ni-CO2-CP800 CO2的转化率高,CH4的选择性相差不大
(4)0.2 (5)L1
19.(本题 10分,除标注外每空 2分)
(1)增大反应物接触面积,加快化学反应速率,使反应更充分
(2) CaSO4 (1分) (3)4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O
(4)2.0×10-3
(5)①Fe-6e-+8OH-=FeO 2 4 +4H2O ② 阴(1分)
说明:其它合理答案,可参照评分标准适当给分。
化学参考答案 第 2页(共 1页)
同课章节目录
