2023年人教版高中化学必修二 1-2-2 元素周期律PPT 课件(共18张PPT)
文档属性
| 名称 | 2023年人教版高中化学必修二 1-2-2 元素周期律PPT 课件(共18张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-02 09:44:55 | ||
图片预览





文档简介
(共18张PPT)
第一章 第二节 元素周期律
第2课时 元素周期律
2023年人教版高中化学必修二
电子层数(n):1 2 3 4 5 6 7 … … n
电子层符号 :K L M N O P Q … …
离核距离 : 由近 远
电子能量 : 由低 高
电子层
2、最多容纳电子数:2 8 18 32 …… 2n2
3、最外层最多容纳 8 个电子(若K层为最外层最多容纳2个电子);
次外层最多容纳 18 个电子;倒数第三层最多容纳 32 个电子。
核外电子排布的规律
1、电子总是优先排布在能量最低的电子层里。
知识回顾
思考:元素原子核外电子排布、原子半径和主要化合价的变化规律
随原子序数的递增,元素原子最外层电子排布呈现由1到8的
周期性变化(H、He除外)
一、元素周期律
科学探究
教材P14--P15表格
1. 核外电子排布的规律
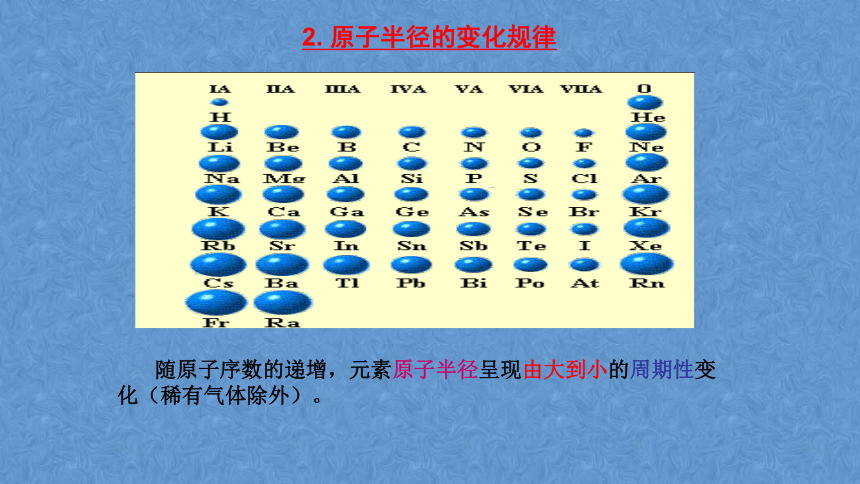
2. 原子半径的变化规律
随原子序数的递增,元素原子半径呈现由大到小的周期性变化(稀有气体除外)。
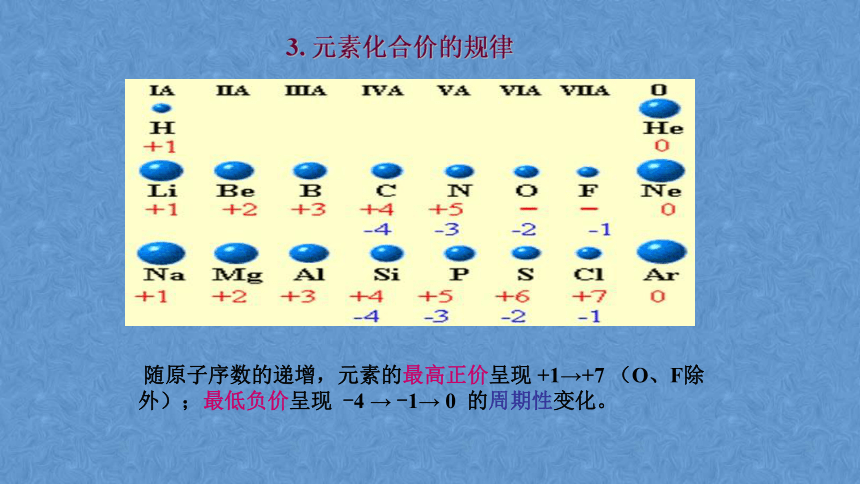
3. 元素化合价的规律
随原子序数的递增,元素的最高正价呈现 +1→+7 (O、F除外);最低负价呈现 -4 → -1→ 0 的周期性变化。
注意: ① 金属元素无负价。 ② O、F化合价的特殊性。
结论:随原子序数的递增,元素原子的电子层排布,原
子半径和化合价均呈现周期性的变化。
最高正价 = 最外层电子数
最低负价 = 最外层电子数- 8 (H为2)
最高正价 + 最低负价 = 8 (H为2)
判断元素化合价的一般规律:
二、微粒半径比较的一般规律:
1、同种元素的不同微粒:
核外电子数越多,半径越大。
讨论:比较 r H 、 r H+ 、r H-
r H+ < r H < r H-
2、不同种元素的微粒:
(1)电子层数相同的原子:
核电荷数越大,原子半径减小。
例如:rNa >rMg>rAl
(2)最外层电子数相同的原子:
电子层数越多,半径越大。
例如:rLi(3)具有相同电子层结构的离子:
核电荷数越大,离子半径减小。
+
+
-
-
>
>
>
2
2
Ca
K
Cl
S
r
r
r
r
例如:
微粒半径主要是由核电荷数、电子层数和核外电子数决定。
讨论:比较
+
+
-
2
Mg
Na
F
r
r
r
+
+
-
>
>
2
Mg
Na
F
r
r
r
1、X元素阳离子与Y元素阴离子具有相
同电子层结构,下列叙述中正确的是( )
A.X原子比Y原子最外层电子数多
B.X原子序数比Y原子序数小
C.X离子半径比Y离子半径大
D.X原子半径比Y原子半径大
D
3、 X元素的阴离子,Y元素的阴离子和Z元素的阳离子具有相同的电子层结构,已知X的原子序数比Y的大,则X、Y、Z的三种离子半径大小的顺序是(分别用r1、r2、r3表示)( )
A. r1 >r2>r3 B. r2 > r1 >r3 C. r3>r1 >r2 D. r3>r2> r1
B
B
6.两元素X、Y均为18号以前的元素, 它们可以形成化学式为X2Y和X2Y2 两种化合物,已知X原子半径大于 Y,则这两种元素的原子序数之和可能为( )
A. 9 B. 18 C. 19 D. 39
4.有18号以前的X、Y两种元素,已知ZX2+ 比Y2-少8个电子,则Y的原子序数为( )
A. Z + 2 B. Z + 4 C. Z + 6 D. Z + 8
C
B
5.下列各组指定原子序数的元素,不能形成XY2型化合物的是( )
A. 6 和 8 B. 12 和 17 C. 16 和 8 D. 13和16
D
三、元素金属性和非金属性的周期性变化
金属性(非金属性)的强弱只与原子失(得)电子的
难易有关,与失(得)电子的多少无关。
(1)直接
判据
金属性
非金属性
元素的原子失电子的能力
元素的原子得电子的能力
注意:
(2)间接判据
a、元素的单质与水或与酸反应置换出氢气的难易。
越容易,元素的金属性就越强。
b、元素最高正价氧化物对应的水化物的碱性强弱。
碱性越强,元素的金属性就越强。
1、元素金属性和非金属性的判断标准
金属性
非金属性
a、元素的单质与氢气生成气态氢化物的难易和气态
氢化物的稳定性。
越容易,越稳定则元素的非金属性就越强。
b、元素最高正价氧化物对应的水化物酸性强弱。
酸性越强,元素的非金属性就越强。
2、11~17号元素金属性与非金属性的变化情况
Na Mg Al Si P S Cl
金属元素
非金属元素
电子层数:
核电荷数:
原子半径:
最外层电子数:
相同
失电子
能力:
得电子
能力:
?
逐渐增加
逐渐减小
逐渐增多
逐渐减弱
逐渐增强
金属性:
非金属性:
逐渐减弱
逐渐增强
结构 性质
决定
(1) 元素的金属性递变规律
科学探究
科学探究1实验:
(1)取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入两滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。
(2)取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两只试管,再加入2mL 1mol/L的盐酸。观察发生的现象。
现象: 加热前,镁条表面附着少量的无色气泡,加热至沸腾后,有较多的无色气泡,溶液变成粉红色 。
现象对比: 两支试管内都有无色气泡冒出,但装有镁条的试管中逸出的气体速率更快
(1) 元素的金属性递变规律
与冷水剧烈反应
与水反应很困难
反应很剧烈
反应剧烈
反应不太剧烈
NaOH
Mg(OH)2
Al(OH)3
沉淀不溶
沉淀溶解
碱性逐渐减弱
金属性逐渐减弱
与冷水微弱反应,
滴入酚酞,溶液
为浅红色,加热
后产生大量气泡,
溶液红色加深
Na
Mg
Al
与水
反应
最高价氧化物对应的水化物
与酸反应
氢氧化物与
NaOH反应
氢氧化物
碱性强弱
结论
强碱
中强碱
两性氢氧化物
科学探究
(2)元素的非金属性递变规律
SiH4
PH3
H2S
HCl
H4SiO4
H3PO4
H2SO4
HClO4
与氢气反应越来越容易;稳定性逐渐增强
很弱酸
中强酸
强酸
最强酸
酸性逐渐增强
Si P S Cl
气态
氢化物
最高价
氧化物
对应的
水化物
结论
非金属性逐渐增强
阅读教材P16的第三个表格,比较Si、P、S、Cl非金属性强弱。你能得出Si、P、S、Cl非金属性强弱关系吗?
总结:
Na Mg Al Si P S Cl
金属性逐渐减弱、非金属性逐渐增强
得出:
电子层数相同的元素,随着核电荷数的递增,
原子最外层电子数递增,原子半径逐渐减小,
元素金属性逐渐减弱,非金属性逐渐增强。
Ar
稀有气体元素
结论:元素的金属性和非金属性随着原子序数的递增而呈现周期性的变化。
同周期元素,从左到右,随着原子序数的递增,金属性逐渐减弱,非金属性逐渐增强;
四、元素周期律的概念与实质
元素周期律内容:元素的性质随着原子序数的递增而呈周期性变
化的规律。
实质:元素性质的周期性变化是元素原子核外电子排布的
周期性变化的必然结果。
原子结构的周期性变化
决定
元素性质的周期性化
反映
电子层数为3的元素R,它的原子核外最外层达到稳定结构
所需电子数,小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍,则关于R的说法正确的是( )
A. R的最高价氧化物对应的水化物都是强酸
B. 常温下能稳定存在的R的氧化物都能与烧碱溶液反应
C. R的气态氢化物在常温下都能稳定地在空气中存在
D. R的非金属性一定比磷的非金属性强
B
第一章 第二节 元素周期律
第2课时 元素周期律
2023年人教版高中化学必修二
电子层数(n):1 2 3 4 5 6 7 … … n
电子层符号 :K L M N O P Q … …
离核距离 : 由近 远
电子能量 : 由低 高
电子层
2、最多容纳电子数:2 8 18 32 …… 2n2
3、最外层最多容纳 8 个电子(若K层为最外层最多容纳2个电子);
次外层最多容纳 18 个电子;倒数第三层最多容纳 32 个电子。
核外电子排布的规律
1、电子总是优先排布在能量最低的电子层里。
知识回顾
思考:元素原子核外电子排布、原子半径和主要化合价的变化规律
随原子序数的递增,元素原子最外层电子排布呈现由1到8的
周期性变化(H、He除外)
一、元素周期律
科学探究
教材P14--P15表格
1. 核外电子排布的规律
2. 原子半径的变化规律
随原子序数的递增,元素原子半径呈现由大到小的周期性变化(稀有气体除外)。
3. 元素化合价的规律
随原子序数的递增,元素的最高正价呈现 +1→+7 (O、F除外);最低负价呈现 -4 → -1→ 0 的周期性变化。
注意: ① 金属元素无负价。 ② O、F化合价的特殊性。
结论:随原子序数的递增,元素原子的电子层排布,原
子半径和化合价均呈现周期性的变化。
最高正价 = 最外层电子数
最低负价 = 最外层电子数- 8 (H为2)
最高正价 + 最低负价 = 8 (H为2)
判断元素化合价的一般规律:
二、微粒半径比较的一般规律:
1、同种元素的不同微粒:
核外电子数越多,半径越大。
讨论:比较 r H 、 r H+ 、r H-
r H+ < r H < r H-
2、不同种元素的微粒:
(1)电子层数相同的原子:
核电荷数越大,原子半径减小。
例如:rNa >rMg>rAl
(2)最外层电子数相同的原子:
电子层数越多,半径越大。
例如:rLi
核电荷数越大,离子半径减小。
+
+
-
-
>
>
>
2
2
Ca
K
Cl
S
r
r
r
r
例如:
微粒半径主要是由核电荷数、电子层数和核外电子数决定。
讨论:比较
+
+
-
2
Mg
Na
F
r
r
r
+
+
-
>
>
2
Mg
Na
F
r
r
r
1、X元素阳离子与Y元素阴离子具有相
同电子层结构,下列叙述中正确的是( )
A.X原子比Y原子最外层电子数多
B.X原子序数比Y原子序数小
C.X离子半径比Y离子半径大
D.X原子半径比Y原子半径大
D
3、 X元素的阴离子,Y元素的阴离子和Z元素的阳离子具有相同的电子层结构,已知X的原子序数比Y的大,则X、Y、Z的三种离子半径大小的顺序是(分别用r1、r2、r3表示)( )
A. r1 >r2>r3 B. r2 > r1 >r3 C. r3>r1 >r2 D. r3>r2> r1
B
B
6.两元素X、Y均为18号以前的元素, 它们可以形成化学式为X2Y和X2Y2 两种化合物,已知X原子半径大于 Y,则这两种元素的原子序数之和可能为( )
A. 9 B. 18 C. 19 D. 39
4.有18号以前的X、Y两种元素,已知ZX2+ 比Y2-少8个电子,则Y的原子序数为( )
A. Z + 2 B. Z + 4 C. Z + 6 D. Z + 8
C
B
5.下列各组指定原子序数的元素,不能形成XY2型化合物的是( )
A. 6 和 8 B. 12 和 17 C. 16 和 8 D. 13和16
D
三、元素金属性和非金属性的周期性变化
金属性(非金属性)的强弱只与原子失(得)电子的
难易有关,与失(得)电子的多少无关。
(1)直接
判据
金属性
非金属性
元素的原子失电子的能力
元素的原子得电子的能力
注意:
(2)间接判据
a、元素的单质与水或与酸反应置换出氢气的难易。
越容易,元素的金属性就越强。
b、元素最高正价氧化物对应的水化物的碱性强弱。
碱性越强,元素的金属性就越强。
1、元素金属性和非金属性的判断标准
金属性
非金属性
a、元素的单质与氢气生成气态氢化物的难易和气态
氢化物的稳定性。
越容易,越稳定则元素的非金属性就越强。
b、元素最高正价氧化物对应的水化物酸性强弱。
酸性越强,元素的非金属性就越强。
2、11~17号元素金属性与非金属性的变化情况
Na Mg Al Si P S Cl
金属元素
非金属元素
电子层数:
核电荷数:
原子半径:
最外层电子数:
相同
失电子
能力:
得电子
能力:
?
逐渐增加
逐渐减小
逐渐增多
逐渐减弱
逐渐增强
金属性:
非金属性:
逐渐减弱
逐渐增强
结构 性质
决定
(1) 元素的金属性递变规律
科学探究
科学探究1实验:
(1)取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入两滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。
(2)取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两只试管,再加入2mL 1mol/L的盐酸。观察发生的现象。
现象: 加热前,镁条表面附着少量的无色气泡,加热至沸腾后,有较多的无色气泡,溶液变成粉红色 。
现象对比: 两支试管内都有无色气泡冒出,但装有镁条的试管中逸出的气体速率更快
(1) 元素的金属性递变规律
与冷水剧烈反应
与水反应很困难
反应很剧烈
反应剧烈
反应不太剧烈
NaOH
Mg(OH)2
Al(OH)3
沉淀不溶
沉淀溶解
碱性逐渐减弱
金属性逐渐减弱
与冷水微弱反应,
滴入酚酞,溶液
为浅红色,加热
后产生大量气泡,
溶液红色加深
Na
Mg
Al
与水
反应
最高价氧化物对应的水化物
与酸反应
氢氧化物与
NaOH反应
氢氧化物
碱性强弱
结论
强碱
中强碱
两性氢氧化物
科学探究
(2)元素的非金属性递变规律
SiH4
PH3
H2S
HCl
H4SiO4
H3PO4
H2SO4
HClO4
与氢气反应越来越容易;稳定性逐渐增强
很弱酸
中强酸
强酸
最强酸
酸性逐渐增强
Si P S Cl
气态
氢化物
最高价
氧化物
对应的
水化物
结论
非金属性逐渐增强
阅读教材P16的第三个表格,比较Si、P、S、Cl非金属性强弱。你能得出Si、P、S、Cl非金属性强弱关系吗?
总结:
Na Mg Al Si P S Cl
金属性逐渐减弱、非金属性逐渐增强
得出:
电子层数相同的元素,随着核电荷数的递增,
原子最外层电子数递增,原子半径逐渐减小,
元素金属性逐渐减弱,非金属性逐渐增强。
Ar
稀有气体元素
结论:元素的金属性和非金属性随着原子序数的递增而呈现周期性的变化。
同周期元素,从左到右,随着原子序数的递增,金属性逐渐减弱,非金属性逐渐增强;
四、元素周期律的概念与实质
元素周期律内容:元素的性质随着原子序数的递增而呈周期性变
化的规律。
实质:元素性质的周期性变化是元素原子核外电子排布的
周期性变化的必然结果。
原子结构的周期性变化
决定
元素性质的周期性化
反映
电子层数为3的元素R,它的原子核外最外层达到稳定结构
所需电子数,小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍,则关于R的说法正确的是( )
A. R的最高价氧化物对应的水化物都是强酸
B. 常温下能稳定存在的R的氧化物都能与烧碱溶液反应
C. R的气态氢化物在常温下都能稳定地在空气中存在
D. R的非金属性一定比磷的非金属性强
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
