课前复习课
图片预览





文档简介
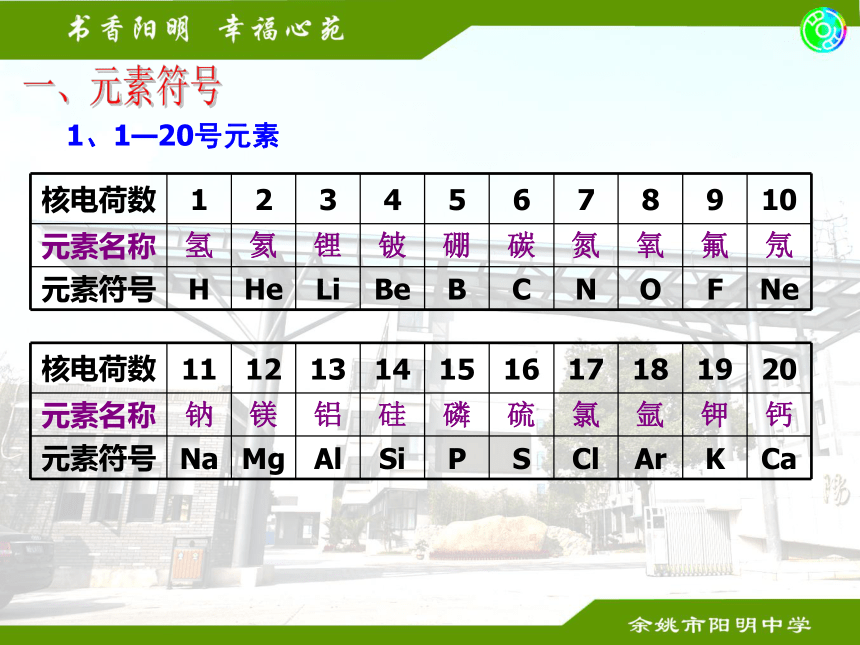
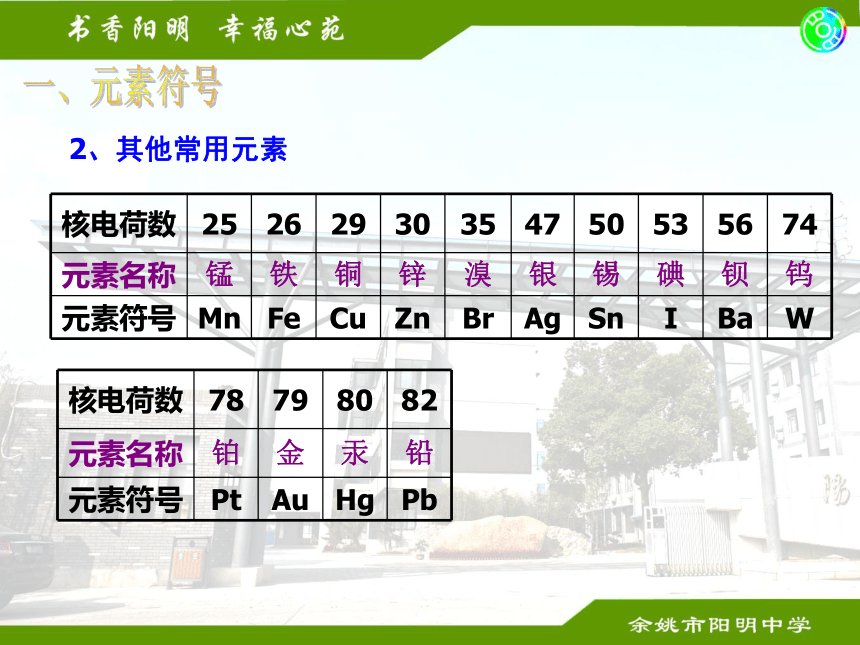
课件28张PPT。化学基础复习一、元素符号1、1—20号元素一、元素符号2、其他常用元素3、写出下列元素符号表示的意义1、 O
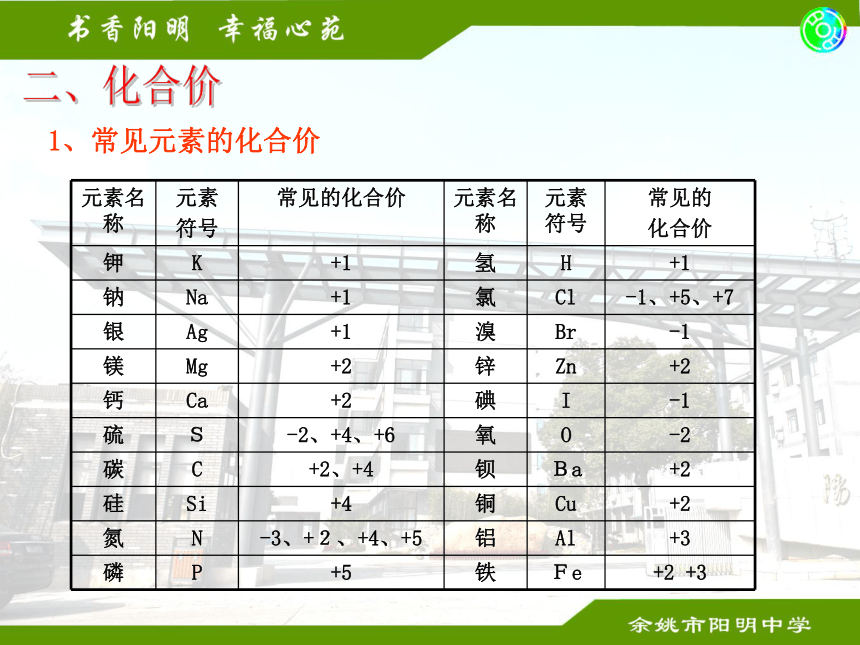
2、 Fe表示氧元素一个氧原子表示铁元素一个铁原子表示铁这种物质二、化合价 1、常见元素的化合价 单质元素价为零,一价氯氢钾钠银,
二价氧钙钡镁锌,三铝四硅五价磷,
二三铁,二四碳,二四六硫都齐全一价铵硝氢氧根,二价硫酸碳酸根。2、常见元素及原子团化合价的记忆口诀3、常见的原子团和化合价OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
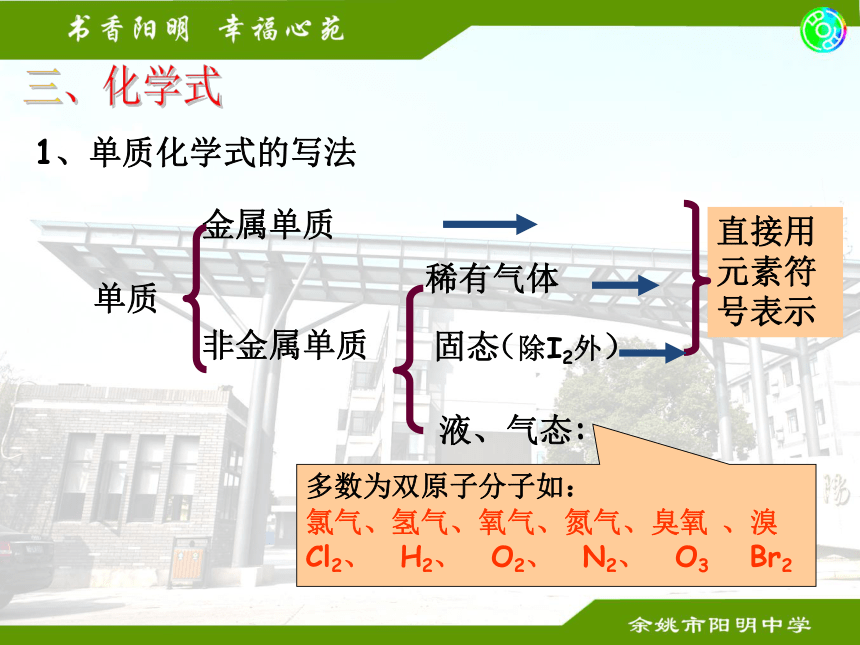
PO4 磷酸根 NH4 铵根-1-1-2-3 -2+11、单质化学式的写法 单质金属单质
非金属单质
直接用
元素符
号表示稀有气体固态液、气态:(除I2外)多数为双原子分子如:
氯气、氢气、氧气、氮气、臭氧 、溴
Cl2、 H2、 O2、 N2、 O3 Br2
三、化学式2、氧化物:由两种元素组成,其中一种是氧元素的化合物。写出O与Al、K、Fe、C、P所组成化合物的化学式R O 一般写法:+n-2R 2On Al2O3 K2O Fe2O3 FeO P2O5 CO2命名:氧化物一般读作“氧化某”,金属元素呈低价时应读作“氧化亚某”,非金属氧化物命名时,一般要读出原子个数。例如: Al2O3 Na2O Fe2O3 FeO
氧化铝 氧化钠 氧化铁 氧化亚铁
P2O5 N2O
五氧化二磷 一氧化二氮水______ 干冰______
五氧化二磷______二氧化硫______
三氧化硫______二氧化氮______
二氧化硅______氧化铜______
氧化钠______四氧化三铁 ______
氧化钙______氧化镁______
氧化铝______即学即用:写出下面氧化物的化学式:3、酸:由氢元素与酸根或氢元素与非金属元素组成的化合物。写出H与Cl、S、SO4、PO4、CO3、NO3组成的化合物的化学式H R 一般写法:+1-nH nRHCl H2S H2SO4 H3PO4 H2CO3 HNO3命名:含氧酸的命名:除氢、氧元素外另一种是什么元素就读作“某酸”例如:H2SO4 H3PO4 H2CO3 H2SiO3
硫酸 磷酸 碳酸 硅酸无氧酸命名:读作“氢某酸”例如:H2S HF HCl
氢硫酸 氢氟酸 氢氯酸(俗名:盐酸)
*氯化氢、硫化氢等是气体,是纯净物硫酸______ 盐酸______ 亚硫酸______
硝酸______ 氢硫酸______ 氢溴酸______ 即学即用:写出下面酸的化学式:4、碱:由金属离子与氢氧根离子组成的化合物。 写出OH与Ca、K、Fe、Ba组成的化合物的化学式R OH 一般写法:+n-1R(OH)n Ca(OH)2 KOH Fe(OH)3 Fe(OH)2 Ba(OH)2 命名:读作“氢氧化某”,金属元素呈低价时读作“氢氧化亚某”例如:Al(OH)3 Mg(OH)2 Fe(OH)3
氢氧化铝 氢氧化镁 氢氧化铁
NaOH Fe(OH)2
氢氧化钠 氢氧化亚铁氢氧化钙______氢氧化钡______
氢氧化铁______氢氧化锌______
氢氧化镁______氢氧化钠______
氢氧化钾______氢氧化铝______ 即学即用:写出下面碱的化学式:5、盐:由金属离子与酸根离子(或非金属离子)组成的化合物。写出Na与Cl、S、SO4、PO4、NO3组成的化合物的化学式A B 一般写法:+n-mA mBn NaCl Na2S Na2SO4 Na3PO4 NaNO3命名:无氧酸盐:命名 读作“某化某”,金属元素呈低价时应读作“某化亚某”例如:FeCl3 FeCl2 NaCl FeS Na2S
氯化铁 氯化亚铁 氯化钠 硫化亚铁 硫化钠含氧酸盐:命名 读作“某酸某”,金属元素呈低价时应读作“某酸亚某。例如:Na2SO4 FePO4 FeCO3 Cu(NO3)2
硫酸钠 磷酸铁 碳酸亚铁 硝酸铜
氯化铝______氯化锌______
硫化锌______硫化钾______
硫酸铝______硫酸铜______
碳酸钙______碳酸钾______
硝酸锌______硝酸银______
磷酸钠______磷酸钾______
即学即用:写出下面盐的化学式:拓展提高:
用下列四种元素中的一种或几种,写出符合要求的化学式
H O S Na思考:
用三种非金属元素写出酸、碱、盐化学式各一个化学式表示一种物质表示这种物质的元素组成表示该物质的一个分子 表示物质的一个分子中各原子个数或原子个数比 化学式的意义: 宏观微观1、计算化学式的式量练习1、计算2KMnO4的式量和。
练习2、计算CuSO4·5H2O的式量
练习3、金属元素R的硫化物的化学式为RS,其式量与相同价态氧化物的式量之比为9:7。求R的相对原子质量。例1.计算二氧化碳(CO2)的式量。例2.计算Cu2(OH)2CO3的式量。四、化学式的相关计算:12+16× 2=4464 × 2+(16+1) × 2+12+16 × 3=22231625040 2、计算组成物质的各元素的质量比 练习1、计算硫酸(H2SO4)中各元素的质量比。练习2、求NH4HCO3中各元素的质量比。 例题:二氧化碳中碳元素和氧元素的质量比 练习3、A、B元素的相对原子质量之比为3:4,在A、B形成的化合物中,A和B的质量之比为3:8,求该化合物的化学式。
C∶O(质量比 )=12∶16×2=3∶8H∶S∶O (质量比) =1∶16∶32N∶H∶C ∶ O (质量比) =14∶5∶12 ∶48AB2例题:求水中氢元素的质量分数。练习1、求NH4NO3中氮元素的质量分数。 3、计算物质中某一元素的质量分数 练习2、丙氨酸是一种氨基酸,其相对分子质量是89,其中氮元素的质量分数为15.8%,求每个丙氨酸分子中含氮原子的个数。解: H%= ×100 % = ×100 % =11.1%2HH2O1×21×2+1635%1 化学式
的内涵一种物质物质的元素组成一种分子一种分子的构成元素化合价化学式式量一个分子内部
原子总数构成分子的
各原子的个数比组成物质的
各元素的质量比组成物质的
某元素的质量分数2、含有相同质量氧元素的N2O、NO、N2O3、NO2、N2O5五种氮的氧化物中,所含氮元素的原子质量比为( )。 ? A.60:30:20:15:12 ???B.30:15:20:12:60 ? C.60:20:30:15:12 ???D.60:30:15:20:12 再提高:A1.某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21:8,原子个数比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为( ) ?A.24 ??? B.27 ??? C.56 ??? D.65C再提高:③SO2、H2、CO23.某气体由SO2、H2、CO2中的一种或几种组成.现测知该气体中氧元素的质量分数为50%,则该气体可能有的各种组成为__________.
① SO2②H2、CO24.在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数为a%,则该混合物中铁元素的质量分数为( )。 A.2a% ? B.1-a%?? C.1-0.5a% ? D.1-1.5a%D
2、 Fe表示氧元素一个氧原子表示铁元素一个铁原子表示铁这种物质二、化合价 1、常见元素的化合价 单质元素价为零,一价氯氢钾钠银,
二价氧钙钡镁锌,三铝四硅五价磷,
二三铁,二四碳,二四六硫都齐全一价铵硝氢氧根,二价硫酸碳酸根。2、常见元素及原子团化合价的记忆口诀3、常见的原子团和化合价OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
PO4 磷酸根 NH4 铵根-1-1-2-3 -2+11、单质化学式的写法 单质金属单质
非金属单质
直接用
元素符
号表示稀有气体固态液、气态:(除I2外)多数为双原子分子如:
氯气、氢气、氧气、氮气、臭氧 、溴
Cl2、 H2、 O2、 N2、 O3 Br2
三、化学式2、氧化物:由两种元素组成,其中一种是氧元素的化合物。写出O与Al、K、Fe、C、P所组成化合物的化学式R O 一般写法:+n-2R 2On Al2O3 K2O Fe2O3 FeO P2O5 CO2命名:氧化物一般读作“氧化某”,金属元素呈低价时应读作“氧化亚某”,非金属氧化物命名时,一般要读出原子个数。例如: Al2O3 Na2O Fe2O3 FeO
氧化铝 氧化钠 氧化铁 氧化亚铁
P2O5 N2O
五氧化二磷 一氧化二氮水______ 干冰______
五氧化二磷______二氧化硫______
三氧化硫______二氧化氮______
二氧化硅______氧化铜______
氧化钠______四氧化三铁 ______
氧化钙______氧化镁______
氧化铝______即学即用:写出下面氧化物的化学式:3、酸:由氢元素与酸根或氢元素与非金属元素组成的化合物。写出H与Cl、S、SO4、PO4、CO3、NO3组成的化合物的化学式H R 一般写法:+1-nH nRHCl H2S H2SO4 H3PO4 H2CO3 HNO3命名:含氧酸的命名:除氢、氧元素外另一种是什么元素就读作“某酸”例如:H2SO4 H3PO4 H2CO3 H2SiO3
硫酸 磷酸 碳酸 硅酸无氧酸命名:读作“氢某酸”例如:H2S HF HCl
氢硫酸 氢氟酸 氢氯酸(俗名:盐酸)
*氯化氢、硫化氢等是气体,是纯净物硫酸______ 盐酸______ 亚硫酸______
硝酸______ 氢硫酸______ 氢溴酸______ 即学即用:写出下面酸的化学式:4、碱:由金属离子与氢氧根离子组成的化合物。 写出OH与Ca、K、Fe、Ba组成的化合物的化学式R OH 一般写法:+n-1R(OH)n Ca(OH)2 KOH Fe(OH)3 Fe(OH)2 Ba(OH)2 命名:读作“氢氧化某”,金属元素呈低价时读作“氢氧化亚某”例如:Al(OH)3 Mg(OH)2 Fe(OH)3
氢氧化铝 氢氧化镁 氢氧化铁
NaOH Fe(OH)2
氢氧化钠 氢氧化亚铁氢氧化钙______氢氧化钡______
氢氧化铁______氢氧化锌______
氢氧化镁______氢氧化钠______
氢氧化钾______氢氧化铝______ 即学即用:写出下面碱的化学式:5、盐:由金属离子与酸根离子(或非金属离子)组成的化合物。写出Na与Cl、S、SO4、PO4、NO3组成的化合物的化学式A B 一般写法:+n-mA mBn NaCl Na2S Na2SO4 Na3PO4 NaNO3命名:无氧酸盐:命名 读作“某化某”,金属元素呈低价时应读作“某化亚某”例如:FeCl3 FeCl2 NaCl FeS Na2S
氯化铁 氯化亚铁 氯化钠 硫化亚铁 硫化钠含氧酸盐:命名 读作“某酸某”,金属元素呈低价时应读作“某酸亚某。例如:Na2SO4 FePO4 FeCO3 Cu(NO3)2
硫酸钠 磷酸铁 碳酸亚铁 硝酸铜
氯化铝______氯化锌______
硫化锌______硫化钾______
硫酸铝______硫酸铜______
碳酸钙______碳酸钾______
硝酸锌______硝酸银______
磷酸钠______磷酸钾______
即学即用:写出下面盐的化学式:拓展提高:
用下列四种元素中的一种或几种,写出符合要求的化学式
H O S Na思考:
用三种非金属元素写出酸、碱、盐化学式各一个化学式表示一种物质表示这种物质的元素组成表示该物质的一个分子 表示物质的一个分子中各原子个数或原子个数比 化学式的意义: 宏观微观1、计算化学式的式量练习1、计算2KMnO4的式量和。
练习2、计算CuSO4·5H2O的式量
练习3、金属元素R的硫化物的化学式为RS,其式量与相同价态氧化物的式量之比为9:7。求R的相对原子质量。例1.计算二氧化碳(CO2)的式量。例2.计算Cu2(OH)2CO3的式量。四、化学式的相关计算:12+16× 2=4464 × 2+(16+1) × 2+12+16 × 3=22231625040 2、计算组成物质的各元素的质量比 练习1、计算硫酸(H2SO4)中各元素的质量比。练习2、求NH4HCO3中各元素的质量比。 例题:二氧化碳中碳元素和氧元素的质量比 练习3、A、B元素的相对原子质量之比为3:4,在A、B形成的化合物中,A和B的质量之比为3:8,求该化合物的化学式。
C∶O(质量比 )=12∶16×2=3∶8H∶S∶O (质量比) =1∶16∶32N∶H∶C ∶ O (质量比) =14∶5∶12 ∶48AB2例题:求水中氢元素的质量分数。练习1、求NH4NO3中氮元素的质量分数。 3、计算物质中某一元素的质量分数 练习2、丙氨酸是一种氨基酸,其相对分子质量是89,其中氮元素的质量分数为15.8%,求每个丙氨酸分子中含氮原子的个数。解: H%= ×100 % = ×100 % =11.1%2HH2O1×21×2+1635%1 化学式
的内涵一种物质物质的元素组成一种分子一种分子的构成元素化合价化学式式量一个分子内部
原子总数构成分子的
各原子的个数比组成物质的
各元素的质量比组成物质的
某元素的质量分数2、含有相同质量氧元素的N2O、NO、N2O3、NO2、N2O5五种氮的氧化物中,所含氮元素的原子质量比为( )。 ? A.60:30:20:15:12 ???B.30:15:20:12:60 ? C.60:20:30:15:12 ???D.60:30:15:20:12 再提高:A1.某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21:8,原子个数比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为( ) ?A.24 ??? B.27 ??? C.56 ??? D.65C再提高:③SO2、H2、CO23.某气体由SO2、H2、CO2中的一种或几种组成.现测知该气体中氧元素的质量分数为50%,则该气体可能有的各种组成为__________.
① SO2②H2、CO24.在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数为a%,则该混合物中铁元素的质量分数为( )。 A.2a% ? B.1-a%?? C.1-0.5a% ? D.1-1.5a%D
