2023年中考化学复习专题 (二)新课标八大必做实验课件(共61张PPT)
文档属性
| 名称 | 2023年中考化学复习专题 (二)新课标八大必做实验课件(共61张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-04 10:47:51 | ||
图片预览








文档简介
(共61张PPT)
第二部分 新课标新中考
(二)新课标八大必做实验
必做实验1 粗盐中难溶性杂质的去除
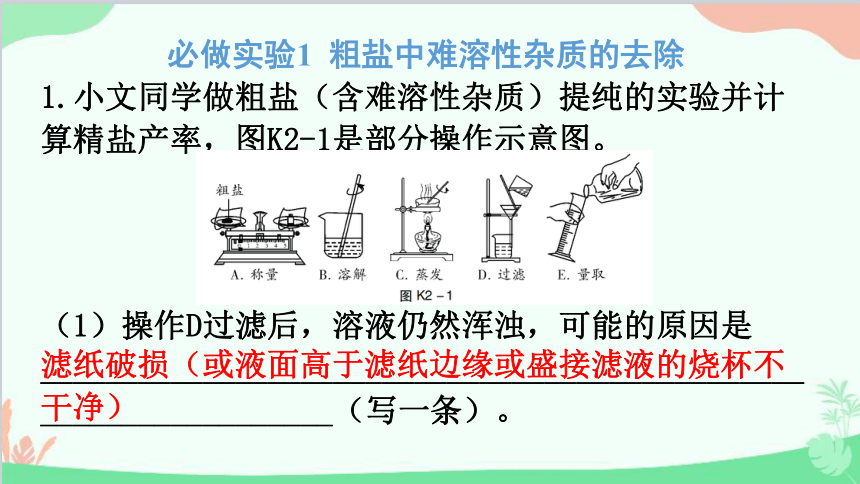
1.小文同学做粗盐(含难溶性杂质)提纯的实验并计算精盐产率,图K2-1是部分操作示意图。
(1)操作D过滤后,溶液仍然浑浊,可能的原因是_________________________________________________________________(写一条)。
滤纸破损(或液面高于滤纸边缘或盛接滤液的烧杯不干净)
(2)操作B中使用玻璃棒的目的是___________________________。
(3)图示中正确的操作顺序为__________(填字母)。
(4)操作B溶解过程中有部分液体溅出,会使所得精盐的产率______(填“偏高”“偏低”或“无影响”)。
搅拌,加快溶解速率
AEBDC
偏低
(5)粗盐提纯的实验过程中发现过滤速度较慢,可能的原因是____________________________________,在蒸发操作中,当蒸发皿中出现____________时,停止加热。
(6)配制100 g质量分数为6%的氯化钠溶液,计算需要水的质量为______g;操作E中,若向烧杯中倒水时部分水洒出,最终会导致配制的溶液中溶质的质量分数______(填“大于”“小于”或“等于”)6%。
滤纸没有紧贴漏斗内壁,中间有气泡
较多固体
94
大于
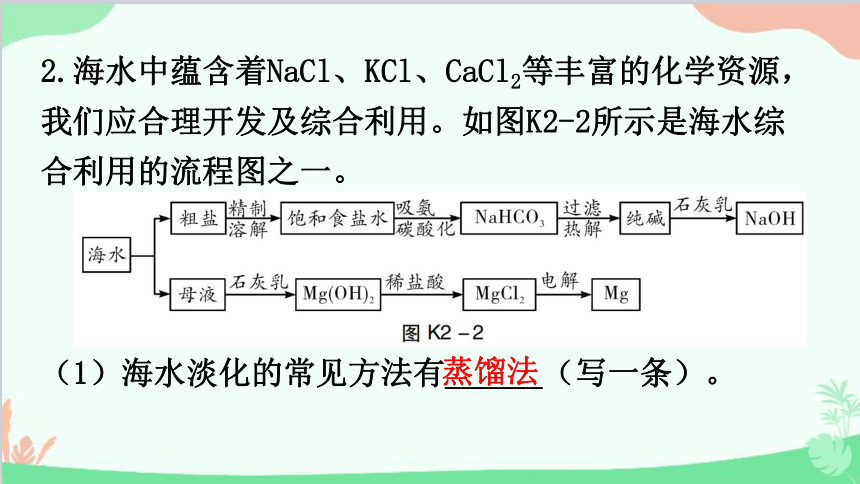
2.海水中蕴含着NaCl、KCl、CaCl2等丰富的化学资源,我们应合理开发及综合利用。如图K2-2所示是海水综合利用的流程图之一。
(1)海水淡化的常见方法有______(写一条)。
蒸馏法
(2)我国著名化学家侯德榜先生创立的侯氏制碱法所制得的“碱”是_____________________。
(3)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是______。在蒸发操作时,玻璃棒的作用是_______________________________________________。
Na2CO3(或碳酸钠)
引流
搅拌,防止因局部温度过高,造成液体飞溅
(4)粗盐水中主要含有CaCl2、MgCl2等可溶性杂质,可加入下列物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为______(填字母)。
A.适量的稀盐酸
B.稍过量的Na2CO3溶液
C.稍过量的Ba(OH)2溶液
CBA
(5)生成Mg(OH)2的化学方程式是__________________________________,该反应的基本类型是__________________。
(6)在吸氨碳酸化中为提高CO2的吸收量,须向饱和食盐水中先通入氨气(NH3)至饱和的原因是_____________________________________________。
Ba(OH)2+MgCl2 == Mg(OH)2↓+BaCl2
复分解反应
NH3溶于水形成氨水,氨水显碱性,有利于吸收CO2
必做实验2 氧气的实验室制取与性质
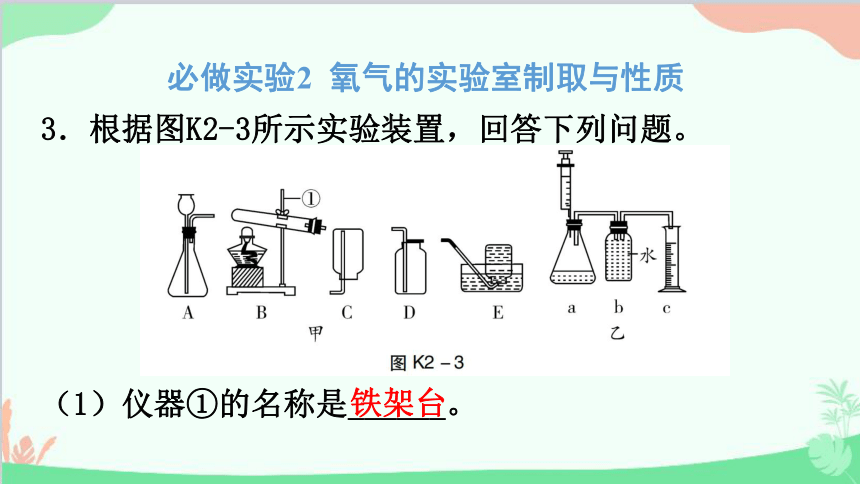
3.根据图K2-3所示实验装置,回答下列问题。
(1)仪器①的名称是______。
铁架台
(2)实验室用氯酸钾制取并收集一瓶较纯净的氧气,反应的化学方程式为____________________________,应选用的装置组合是______(填字母),若收集完成后,测得氧气纯度明显偏低,原因可能是_________(填编号,多选)。
①装置漏气
②收集前,集气瓶中未注满水
③未见气泡连续均匀地冒出时就开始收集
④收集后,集气瓶中仍有少量水
2KClO3======= 2KCl+3O2↑
MnO2
△
BE
①②③
(3)氢气被称为“绿色能源”的主要原因是________________________________________,实验室用装置A来制取氢气,先在锥形中装入的药品是______,若将该装置中的长颈漏斗换成注射器,改进后装置的优点是_________________________________,利用改进后的装置制取收集并测量氢气的体积(如图乙),请将图乙中的仪器b补画完整。
氢气在氧气中燃烧只生成水,对环境无污染
锌粒
可以控制反应速率和节约药品
如答图K2-1所示。
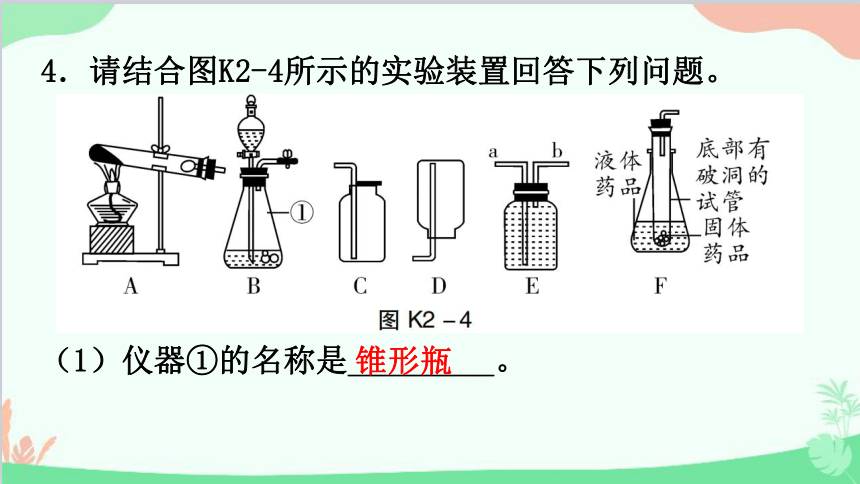
4.请结合图K2-4所示的实验装置回答下列问题。
(1)仪器①的名称是_________。
锥形瓶
(2)实验室用装置A制取氧气的化学方程式为___________________________,试管口放一团棉花的作用是_________________________________________。
(3)良好的实验习惯及合理的做法,是实验安全,环保和顺利进行的保证。
①装置A开始加热时,应先使试管______受热,然后再对药品所在的部位加热;
2KMnO4 === K2MnO4+MnO2+O2↑
△
防止加热时,高锰酸钾粉末进入导管,堵塞导管
均匀
②为减少硫在氧气中燃烧的生成物对空气造成的污染,用排水法收集氧气时,应在集气瓶中预留__________,目的是为了___________________________________。
(4)实验室制取氧气和二氧化碳的发生装置都可以选用装置B,理由是_______________________________。装置F是某同学设计的制取二氧化碳的发生装置,请写一个除废物利用以外的优点:_____________________。
少量的水
吸收生成的二氧化硫,防止污染空气
反应物是固体和液体,不需要加热
能使反应随时发生或停止
(5)实验室制取氧气从“低碳”的角度分析,最佳的制取方法是________________________(用化学方程式表示)。若用装置E连接量筒测量收集到的氧气的体积,气体应该从______(填“a”或“b”)口通入。验证一瓶无色气体是氧气的方法为______________________________________________________________________________________________。
2H2O2======= 2H2O+O2↑
MnO2
b
把带火星的木条伸入集气瓶中,带火星的木条复燃,说明气体是氧气
(6)已知甲烷难溶于水,则实验室收集干燥的甲烷时,应从中选择的收集装置是______(填字母)。
D
必做实验3 二氧化碳的实验室制取与性质
5.气体的制备是我们初中化学研究的重点内容。请根据图K2-5所示的实验装置回答下列问题。
(1)写出标有①②序号的仪器名称:①_________,②____________。
酒精灯
分液漏斗
(2)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是______(填字母),选择这套发生装置的理由是__________________________________。
(3)检验二氧化碳时,可选用装置F,则气体应该从______(填“a”或“b”)管进入,写出该反应的化学方程式:______________________________。
B
反应物为固体和液体,不需要加热
a
Ca(OH)2 + CO2 == CaCO3↓+ H2O
(4)为了验证二氧化碳和水反应,某小组用图K2-6进行实验,在水中插入pH计,打开活塞后测得pH随时间的变化如图K2-7所示。
①碳酸氢钠溶液的作用是_________________________;
除去二氧化碳中的氯化氢气体
②证明二氧化碳与水已发生反应的证据是_________________________________________;
③t2~t3时间段内,溶液pH不变的原因是 ____________________________________________________________________。
烧杯中液体的pH减小,由中性变为酸性
二氧化碳在水中的溶解达到饱和,生成的碳酸浓度不再改变
6.某同学用图K2-8所示的装置(铁架台等略去)制取并探究CO2的性质。
(1)a仪器的名称是_________。发生反应的化学方程式是_________________________________。装置A的优点为__________________________________。
长颈漏斗
CaCO3+2HCl === CaCl2+H2O+CO2↑
随时控制反应的发生和停止
(2)若打开开关K、K1,装置B中可以观察到的现象是______________________,可以证明CO2具有的化学性质是_______________________________。
(3)装置C中进行实验时,先关闭开关K1和K2,加热仪器c,一段时间后再通入CO2,观察到仪器b、d中纸花不变色。再打开开关K2,仪器b中纸花_______(填“变红”“变蓝”或“不变色”),由此证明了CO2能与水反应,化学方程式是________________________。
蜡烛由低到高依次熄灭
CO2不能燃烧、不支持燃烧
变红
H2O+CO2 == H2CO3
必做实验4 常见金属的物理性质和化学性质
7.金属材料在生活、生产中应用广泛。
(1)在三星堆考古发掘中,出土的青铜锈迹斑斑,黄金面具却仍金光灿灿,从物质性质的角度解释其原因是_____________________________________________。青铜属于_________(填“纯净物”或“混合物”),其硬度比纯铜_______(填“大”或“小”)。
金的化学性质更稳定,常温下不易和其他物质反应
混合物
大
(2)在学习了金属的化学性质后,同学们进行了如下实验。
实验探究一:探究铝、铜、银的金属活动性顺序。
【实验探究1】小虹和小桥同学设计的实验如图K2-9甲所示。
【收集证据】小虹实验中发生反应的化学方程式为___________________________,小桥实验中试管E中产生的现象为___________________________________________。
2Al+6HCl == 2AlCl3+3H2↑
铜表面有银白色固体析出,溶液由无色变成蓝色
【实验结论】两位同学通过各自的实验均得出铝、铜、银三种金属的活动性由强到弱的顺序为____________。
【评价交流1】小桥同学认为小虹实验不能得出正确结论,原因是______________________________________________________________________________________________。
铝>铜>银
铝丝与稀盐酸反应,而铜丝、银丝均不与稀盐酸反应,说明铜、银都排在氢后面,不能比较铜和银的活动性
实验探究二:小桥同学实验后,将两支试管中的物质倒入同一废液缸中,充分反应后,将混合物过滤;得滤渣M和滤液N,于是小强同学对所得滤渣M和滤液N的成分进行探究。
【实验探究2】小强同学设计实验如图K2-9乙所示,向滤液N中放入铜丝,观察到铜丝表面无明显现象。
【评价交流2】于是三位同学得出结论。
小强的结论:滤液N中一定含硝酸铝、硝酸铜和硝酸银。
小虹的结论:滤液N中一定含硝酸铝,一定不含硝酸银、硝酸铜。
小桥的结论:滤液N中一定含硝酸铝,可能含硝酸铜,一定不含硝酸银。
你认为三位同学中,_________的结论是正确的。结合上述实验最终确定滤渣M中一定含有_________(填化学式)。
小桥
Ag
8.小林同学发现铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3。
【提出问题】铜是在什么条件下锈蚀的?
【猜想】根据铜锈的化学式,猜想铜生锈可能是铜和水、_________、____________共同作用的结果。
氧气
二氧化碳
【设计与实验】借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如图K2-10所示。
(1)实验较长时间后,发现___(填字母)试管中的光亮铜片最先生锈。
B
(2)从优化实验的角度考虑,A试管实验是多余的,它只考虑了水这个单一条件。C试管中除光亮铜片、蒸馏水外,还应该有的另外一种物质为__________________________。
(3)D试管中除光亮的铜片外,还应该有的另外两种物质为_________、____________;从D试管的实验中,获得的结论是__________________________________。
氧气(或二氧化碳)
氧气
二氧化碳
铜在干燥空气中不会生锈
【评价与改进】我认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验,请在方框中补充完整。
如答图K2-2所示。
(如果C试管中为氧气,则此试管中为二氧化碳;如果C试管中为二氧化碳,则此试管中为氧气)
必做实验5 常见酸、碱的化学性质
9.在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老师引导下开展实验探究活动,请你参与下列活动。
【实验探究】将KOH溶液与稀硫酸混合,观察不到明显现象,为证明KOH溶液与稀硫酸发生了反应,三位同学进行了如图K2-11所示的实验。
(1)测定溶液pH变化的方法
小明同学在实验过程中测得pH变化如图甲所示,则该同学是将_____(填字母)。
a.KOH溶液滴入稀硫酸中 b.稀硫酸滴入KOH溶液中
a
(2)测混合过程中的温度变化
小华同学在实验过程中测得混合溶液的温度变化如图乙所示,说明稀硫酸与KOH溶液发生的反应是______
(填“放热”或“吸热”)反应。图乙中B点表示的含义是____________________________________________。
放热
烧杯中的KOH和稀硫酸恰好完全反应
(3)借助于酸碱指示剂
小红同学通过图丙所示实验,他观察到溶液由红色变成无色,也证明KOH与稀硫酸发生了化学反应,反应的化学方程式为_________________________________。
2KOH+H2SO4 == K2SO4+2H2O
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH。
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
实验方案 实验操作 实验现象 实验结论
方案一 取少量反应后的溶液于试管中,加入Fe2O3粉末 ____________________________________ 溶液中有H2SO4,猜想二正确
方案二 取少量反应后的溶液于试管中,滴加BaCl2溶液 ②产生白色沉淀 溶液中有H2SO4,猜想二正确
固体粉末减少(或消失),溶液变成黄色
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4)小丽同学针对上述方案提出疑问,认为方案二是不合理的,理由是_________________________________
_________________________________________。
溶液中的K2SO4与BaCl2反应也会产生白色沉淀,无法证明H2SO4一定存在
(5)同学们经过反思与讨论,最后认为方案一中的Fe2O3粉末可以用下列的某些物质代替,也能得到同样的实验结论,可用的药品是_______(填字母,多选)。
a.Mg b.CuO c.KCl d.Na2CO3
(6)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑_______________________________
____________________。
abd
反应物是否过量(或反应物是否有剩余)
10.某同学总结了碱的化学性质如图K2-12所示,发现碱与酸一样,也有一些相似的化学性质(“—”表示两类物质间能发生反应)。试回答下列问题。
(1)图甲中物质A所代表的物质类别为_____。不同的碱具有相似化学性质原因是碱溶液中都含有_____。
盐
OH-
(2)请写出一个符合图甲中反应②的化学方程式:_________________________________。反应①②属于______________(填基本反应类型)。
(3)实验室里的NaOH必须密封保存,否则在空气中容易变质。NaOH在空气中变质的化学方程式为________________________。按图乙进行实验,将注射器中相同体积的NaOH溶液和水同时注入锥形瓶中,观察到____________________________的现象,说明NaOH与CO2发生了反应。
FeCl3+3NaOH == Fe(OH)3↓+3NaCl
复分解反应
2NaOH+CO2 == Na2CO3+H2O
红墨水液面左边高于右边
(4)若要除去在空气中已变质的NaOH溶液中的杂质,应选择的试剂是______(填字母)。若要检验已变质的NaOH溶液中的杂质,应选择试剂是_________(填字母,多选)。
A.稀盐酸 B.稀硫酸
C.CaCl2溶液 D.适量Ca(OH)2溶液
D
ABCD
11.学习小组同学用图K2-13所示的实验探究完碱的化学性质后,将图甲、乙、丙中的无色溶液均倒入洁净的废液缸,发现废液明显变浑浊且呈红色。同学们很好奇,于是接着进行了下列的拓展学习与探究。
【反思交流】
(1)小组同学做图甲所示实验时,当溶液恰好由红色变为无色,即停止了滴加稀盐酸,写出发生反应的化学方程式:___________________________。做图乙所示实验时,看到的现象是______________________。
HCl+NaOH == NaCl+H2O
小气球逐渐变大
(2)废液呈红色,说明废液显_________性。废液变浑浊,是因为倾倒前丙中的溶液含有_________(填化学式)。
碱
Ca(OH)2
【查阅资料】氯化钙溶液呈中性。
【拓展问题】使废液变成红色的物质是什么?
【做出猜想】猜想一:只有碳酸钠
猜想二:只有氢氧化钠
猜想三:氢氧化钠和氢氧化钙
猜想四:氢氧化钠和碳酸钠
你认为以上猜想中,不合理的是_________。
猜想一
【验证猜想】
静置一段时间后,取少量废液缸中的上层红色清液于试管中,加入过量氯化钙溶液,有白色沉淀生成。静置后,发现试管中的上层清液仍为红色,由此证明了猜想______成立。
四
必做实验6 一定溶质质量分数的氯化钠溶液的配制
12. 小刚同学在做一定溶质质量分数的NaCl溶液的配制实验时,其配制过程如图K2-14所示。
(1)写出图中有字母标号的仪器名称:a.________,b._________。
药匙
烧杯
(2)称量NaCl时,若将NaCl放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的NaCl质量_________(填“大于”或“小于”)配制溶液所需的NaCl质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中NaCl的质量分数_________(填“偏大”“偏小”或“不变”)。
小于
偏大
(3)图示实验中有一处明显的错误是__________________________;图示实验中玻璃棒的作用是__________________________。
(4)小刚同学要配制90 g质量分数为10%的NaCl溶液,应称取NaCl的质量为_________g。
步骤A中瓶塞没有倒放
搅拌,加快溶解速率
9
必做实验7 水的组成及变化的探究
13.根据图K2-15所示实验,回答下列问题。
(1)图甲实验制取氢气的实验装置,装置内发生反应的化学方程式为_____________________,该反应的基本反应类型是____________。
Zn+H2SO4== ZnSO4+H2↑
置换反应
(2)若要收集干燥的氢气,应采用______________收集。
(3)图乙实验点燃氢气前,需____________________。点燃后,烧杯壁上出现水雾,说明水是由_________________________组成。
向下排空气法
检验其纯度(或验纯)
氢元素和氧元素
(4)图丙实验测得Va∶Vb=1∶2,要确定水分子中氢氧原子个数比,还需要的数据有_________(填字母,多选)。
A.水的相对分子质量
B.氢气、氧气的密度
C.氢原子、氧原子的质量
BC
(5)图K2-16是水分子分解的示意图,水分解过程的微观解释是_________________________________________________________________________________________。
每个水分子分解成2个氢原子和1个氧原子,2个氢原子结合成1个氢分子,2个氧原子结合成1个氧分子
必做实验8 燃烧条件的探究
14.爱思考的化学学习小组利用如图K2-17所示的装置进行“白磷燃烧条件”的探究实验。
(1)检查气密性。
实验前,打开K1、关闭K2或者打开K2、关闭K1,分别向上拉动两支注射器的活塞,若装置C中能出现_________________的现象,则装置气密性良好。
玻璃管液面上升
(2)探究白磷燃烧条件过程一
将装有白磷的具支试管放入20 ℃的冷水中,打开K1、关闭K2,向装置A中注入10%的过氧化氢溶液,一段时间后观察到装置B中白磷_________(填“燃烧”或“不燃烧”);理由是__________________________;装置A中反应的化学方程式为_________________________________。
不燃烧
温度没有达到白磷的着火点
2H2O2 ======= 2H2O+O2↑
MnO2
(3)探究白磷燃烧条件过程二
关闭K1、打开K2,往装置D中注入适量的稀盐酸,当观察到____________________________的现象时,说明二氧化碳与白磷充分接触;然后将装置B中的冷水换成80 ℃的热水,该操作的目的是证明白磷燃烧需要_______;装置C中反应的化学方程式为_______________________________________;装置D中反应的化学方程式为_____________________________________。
装置C中澄清石灰水变浑浊
氧气
Ca(OH)2+CO2 == CaCO3↓+H2O
CaCO3+2HCl == CaCl2+H2O+CO2↑
(4)探究白磷燃烧条件过程三
打开K1、关闭K2,往装置A中注入10%的过氧化氢溶液,一段时间后装置B中白磷燃烧起来,该反应的化学方程式为______________________________________。
4P+5O2 ===== 2P2O5
点燃
(5)熄灭燃烧的白磷
若要使燃烧的白磷熄灭,在不拆卸装置的条件下,需进行的三步操作:_______________________________
_______________;该灭火过程体现了二氧化碳具有的化学性质是____________________________。
关闭K1、打开K2,往装置D中注入适量的稀盐酸
不能燃烧,不支持燃烧
谢 谢!
第二部分 新课标新中考
(二)新课标八大必做实验
必做实验1 粗盐中难溶性杂质的去除
1.小文同学做粗盐(含难溶性杂质)提纯的实验并计算精盐产率,图K2-1是部分操作示意图。
(1)操作D过滤后,溶液仍然浑浊,可能的原因是_________________________________________________________________(写一条)。
滤纸破损(或液面高于滤纸边缘或盛接滤液的烧杯不干净)
(2)操作B中使用玻璃棒的目的是___________________________。
(3)图示中正确的操作顺序为__________(填字母)。
(4)操作B溶解过程中有部分液体溅出,会使所得精盐的产率______(填“偏高”“偏低”或“无影响”)。
搅拌,加快溶解速率
AEBDC
偏低
(5)粗盐提纯的实验过程中发现过滤速度较慢,可能的原因是____________________________________,在蒸发操作中,当蒸发皿中出现____________时,停止加热。
(6)配制100 g质量分数为6%的氯化钠溶液,计算需要水的质量为______g;操作E中,若向烧杯中倒水时部分水洒出,最终会导致配制的溶液中溶质的质量分数______(填“大于”“小于”或“等于”)6%。
滤纸没有紧贴漏斗内壁,中间有气泡
较多固体
94
大于
2.海水中蕴含着NaCl、KCl、CaCl2等丰富的化学资源,我们应合理开发及综合利用。如图K2-2所示是海水综合利用的流程图之一。
(1)海水淡化的常见方法有______(写一条)。
蒸馏法
(2)我国著名化学家侯德榜先生创立的侯氏制碱法所制得的“碱”是_____________________。
(3)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是______。在蒸发操作时,玻璃棒的作用是_______________________________________________。
Na2CO3(或碳酸钠)
引流
搅拌,防止因局部温度过高,造成液体飞溅
(4)粗盐水中主要含有CaCl2、MgCl2等可溶性杂质,可加入下列物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为______(填字母)。
A.适量的稀盐酸
B.稍过量的Na2CO3溶液
C.稍过量的Ba(OH)2溶液
CBA
(5)生成Mg(OH)2的化学方程式是__________________________________,该反应的基本类型是__________________。
(6)在吸氨碳酸化中为提高CO2的吸收量,须向饱和食盐水中先通入氨气(NH3)至饱和的原因是_____________________________________________。
Ba(OH)2+MgCl2 == Mg(OH)2↓+BaCl2
复分解反应
NH3溶于水形成氨水,氨水显碱性,有利于吸收CO2
必做实验2 氧气的实验室制取与性质
3.根据图K2-3所示实验装置,回答下列问题。
(1)仪器①的名称是______。
铁架台
(2)实验室用氯酸钾制取并收集一瓶较纯净的氧气,反应的化学方程式为____________________________,应选用的装置组合是______(填字母),若收集完成后,测得氧气纯度明显偏低,原因可能是_________(填编号,多选)。
①装置漏气
②收集前,集气瓶中未注满水
③未见气泡连续均匀地冒出时就开始收集
④收集后,集气瓶中仍有少量水
2KClO3======= 2KCl+3O2↑
MnO2
△
BE
①②③
(3)氢气被称为“绿色能源”的主要原因是________________________________________,实验室用装置A来制取氢气,先在锥形中装入的药品是______,若将该装置中的长颈漏斗换成注射器,改进后装置的优点是_________________________________,利用改进后的装置制取收集并测量氢气的体积(如图乙),请将图乙中的仪器b补画完整。
氢气在氧气中燃烧只生成水,对环境无污染
锌粒
可以控制反应速率和节约药品
如答图K2-1所示。
4.请结合图K2-4所示的实验装置回答下列问题。
(1)仪器①的名称是_________。
锥形瓶
(2)实验室用装置A制取氧气的化学方程式为___________________________,试管口放一团棉花的作用是_________________________________________。
(3)良好的实验习惯及合理的做法,是实验安全,环保和顺利进行的保证。
①装置A开始加热时,应先使试管______受热,然后再对药品所在的部位加热;
2KMnO4 === K2MnO4+MnO2+O2↑
△
防止加热时,高锰酸钾粉末进入导管,堵塞导管
均匀
②为减少硫在氧气中燃烧的生成物对空气造成的污染,用排水法收集氧气时,应在集气瓶中预留__________,目的是为了___________________________________。
(4)实验室制取氧气和二氧化碳的发生装置都可以选用装置B,理由是_______________________________。装置F是某同学设计的制取二氧化碳的发生装置,请写一个除废物利用以外的优点:_____________________。
少量的水
吸收生成的二氧化硫,防止污染空气
反应物是固体和液体,不需要加热
能使反应随时发生或停止
(5)实验室制取氧气从“低碳”的角度分析,最佳的制取方法是________________________(用化学方程式表示)。若用装置E连接量筒测量收集到的氧气的体积,气体应该从______(填“a”或“b”)口通入。验证一瓶无色气体是氧气的方法为______________________________________________________________________________________________。
2H2O2======= 2H2O+O2↑
MnO2
b
把带火星的木条伸入集气瓶中,带火星的木条复燃,说明气体是氧气
(6)已知甲烷难溶于水,则实验室收集干燥的甲烷时,应从中选择的收集装置是______(填字母)。
D
必做实验3 二氧化碳的实验室制取与性质
5.气体的制备是我们初中化学研究的重点内容。请根据图K2-5所示的实验装置回答下列问题。
(1)写出标有①②序号的仪器名称:①_________,②____________。
酒精灯
分液漏斗
(2)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是______(填字母),选择这套发生装置的理由是__________________________________。
(3)检验二氧化碳时,可选用装置F,则气体应该从______(填“a”或“b”)管进入,写出该反应的化学方程式:______________________________。
B
反应物为固体和液体,不需要加热
a
Ca(OH)2 + CO2 == CaCO3↓+ H2O
(4)为了验证二氧化碳和水反应,某小组用图K2-6进行实验,在水中插入pH计,打开活塞后测得pH随时间的变化如图K2-7所示。
①碳酸氢钠溶液的作用是_________________________;
除去二氧化碳中的氯化氢气体
②证明二氧化碳与水已发生反应的证据是_________________________________________;
③t2~t3时间段内,溶液pH不变的原因是 ____________________________________________________________________。
烧杯中液体的pH减小,由中性变为酸性
二氧化碳在水中的溶解达到饱和,生成的碳酸浓度不再改变
6.某同学用图K2-8所示的装置(铁架台等略去)制取并探究CO2的性质。
(1)a仪器的名称是_________。发生反应的化学方程式是_________________________________。装置A的优点为__________________________________。
长颈漏斗
CaCO3+2HCl === CaCl2+H2O+CO2↑
随时控制反应的发生和停止
(2)若打开开关K、K1,装置B中可以观察到的现象是______________________,可以证明CO2具有的化学性质是_______________________________。
(3)装置C中进行实验时,先关闭开关K1和K2,加热仪器c,一段时间后再通入CO2,观察到仪器b、d中纸花不变色。再打开开关K2,仪器b中纸花_______(填“变红”“变蓝”或“不变色”),由此证明了CO2能与水反应,化学方程式是________________________。
蜡烛由低到高依次熄灭
CO2不能燃烧、不支持燃烧
变红
H2O+CO2 == H2CO3
必做实验4 常见金属的物理性质和化学性质
7.金属材料在生活、生产中应用广泛。
(1)在三星堆考古发掘中,出土的青铜锈迹斑斑,黄金面具却仍金光灿灿,从物质性质的角度解释其原因是_____________________________________________。青铜属于_________(填“纯净物”或“混合物”),其硬度比纯铜_______(填“大”或“小”)。
金的化学性质更稳定,常温下不易和其他物质反应
混合物
大
(2)在学习了金属的化学性质后,同学们进行了如下实验。
实验探究一:探究铝、铜、银的金属活动性顺序。
【实验探究1】小虹和小桥同学设计的实验如图K2-9甲所示。
【收集证据】小虹实验中发生反应的化学方程式为___________________________,小桥实验中试管E中产生的现象为___________________________________________。
2Al+6HCl == 2AlCl3+3H2↑
铜表面有银白色固体析出,溶液由无色变成蓝色
【实验结论】两位同学通过各自的实验均得出铝、铜、银三种金属的活动性由强到弱的顺序为____________。
【评价交流1】小桥同学认为小虹实验不能得出正确结论,原因是______________________________________________________________________________________________。
铝>铜>银
铝丝与稀盐酸反应,而铜丝、银丝均不与稀盐酸反应,说明铜、银都排在氢后面,不能比较铜和银的活动性
实验探究二:小桥同学实验后,将两支试管中的物质倒入同一废液缸中,充分反应后,将混合物过滤;得滤渣M和滤液N,于是小强同学对所得滤渣M和滤液N的成分进行探究。
【实验探究2】小强同学设计实验如图K2-9乙所示,向滤液N中放入铜丝,观察到铜丝表面无明显现象。
【评价交流2】于是三位同学得出结论。
小强的结论:滤液N中一定含硝酸铝、硝酸铜和硝酸银。
小虹的结论:滤液N中一定含硝酸铝,一定不含硝酸银、硝酸铜。
小桥的结论:滤液N中一定含硝酸铝,可能含硝酸铜,一定不含硝酸银。
你认为三位同学中,_________的结论是正确的。结合上述实验最终确定滤渣M中一定含有_________(填化学式)。
小桥
Ag
8.小林同学发现铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3。
【提出问题】铜是在什么条件下锈蚀的?
【猜想】根据铜锈的化学式,猜想铜生锈可能是铜和水、_________、____________共同作用的结果。
氧气
二氧化碳
【设计与实验】借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如图K2-10所示。
(1)实验较长时间后,发现___(填字母)试管中的光亮铜片最先生锈。
B
(2)从优化实验的角度考虑,A试管实验是多余的,它只考虑了水这个单一条件。C试管中除光亮铜片、蒸馏水外,还应该有的另外一种物质为__________________________。
(3)D试管中除光亮的铜片外,还应该有的另外两种物质为_________、____________;从D试管的实验中,获得的结论是__________________________________。
氧气(或二氧化碳)
氧气
二氧化碳
铜在干燥空气中不会生锈
【评价与改进】我认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验,请在方框中补充完整。
如答图K2-2所示。
(如果C试管中为氧气,则此试管中为二氧化碳;如果C试管中为二氧化碳,则此试管中为氧气)
必做实验5 常见酸、碱的化学性质
9.在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老师引导下开展实验探究活动,请你参与下列活动。
【实验探究】将KOH溶液与稀硫酸混合,观察不到明显现象,为证明KOH溶液与稀硫酸发生了反应,三位同学进行了如图K2-11所示的实验。
(1)测定溶液pH变化的方法
小明同学在实验过程中测得pH变化如图甲所示,则该同学是将_____(填字母)。
a.KOH溶液滴入稀硫酸中 b.稀硫酸滴入KOH溶液中
a
(2)测混合过程中的温度变化
小华同学在实验过程中测得混合溶液的温度变化如图乙所示,说明稀硫酸与KOH溶液发生的反应是______
(填“放热”或“吸热”)反应。图乙中B点表示的含义是____________________________________________。
放热
烧杯中的KOH和稀硫酸恰好完全反应
(3)借助于酸碱指示剂
小红同学通过图丙所示实验,他观察到溶液由红色变成无色,也证明KOH与稀硫酸发生了化学反应,反应的化学方程式为_________________________________。
2KOH+H2SO4 == K2SO4+2H2O
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH。
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
实验方案 实验操作 实验现象 实验结论
方案一 取少量反应后的溶液于试管中,加入Fe2O3粉末 ____________________________________ 溶液中有H2SO4,猜想二正确
方案二 取少量反应后的溶液于试管中,滴加BaCl2溶液 ②产生白色沉淀 溶液中有H2SO4,猜想二正确
固体粉末减少(或消失),溶液变成黄色
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4)小丽同学针对上述方案提出疑问,认为方案二是不合理的,理由是_________________________________
_________________________________________。
溶液中的K2SO4与BaCl2反应也会产生白色沉淀,无法证明H2SO4一定存在
(5)同学们经过反思与讨论,最后认为方案一中的Fe2O3粉末可以用下列的某些物质代替,也能得到同样的实验结论,可用的药品是_______(填字母,多选)。
a.Mg b.CuO c.KCl d.Na2CO3
(6)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑_______________________________
____________________。
abd
反应物是否过量(或反应物是否有剩余)
10.某同学总结了碱的化学性质如图K2-12所示,发现碱与酸一样,也有一些相似的化学性质(“—”表示两类物质间能发生反应)。试回答下列问题。
(1)图甲中物质A所代表的物质类别为_____。不同的碱具有相似化学性质原因是碱溶液中都含有_____。
盐
OH-
(2)请写出一个符合图甲中反应②的化学方程式:_________________________________。反应①②属于______________(填基本反应类型)。
(3)实验室里的NaOH必须密封保存,否则在空气中容易变质。NaOH在空气中变质的化学方程式为________________________。按图乙进行实验,将注射器中相同体积的NaOH溶液和水同时注入锥形瓶中,观察到____________________________的现象,说明NaOH与CO2发生了反应。
FeCl3+3NaOH == Fe(OH)3↓+3NaCl
复分解反应
2NaOH+CO2 == Na2CO3+H2O
红墨水液面左边高于右边
(4)若要除去在空气中已变质的NaOH溶液中的杂质,应选择的试剂是______(填字母)。若要检验已变质的NaOH溶液中的杂质,应选择试剂是_________(填字母,多选)。
A.稀盐酸 B.稀硫酸
C.CaCl2溶液 D.适量Ca(OH)2溶液
D
ABCD
11.学习小组同学用图K2-13所示的实验探究完碱的化学性质后,将图甲、乙、丙中的无色溶液均倒入洁净的废液缸,发现废液明显变浑浊且呈红色。同学们很好奇,于是接着进行了下列的拓展学习与探究。
【反思交流】
(1)小组同学做图甲所示实验时,当溶液恰好由红色变为无色,即停止了滴加稀盐酸,写出发生反应的化学方程式:___________________________。做图乙所示实验时,看到的现象是______________________。
HCl+NaOH == NaCl+H2O
小气球逐渐变大
(2)废液呈红色,说明废液显_________性。废液变浑浊,是因为倾倒前丙中的溶液含有_________(填化学式)。
碱
Ca(OH)2
【查阅资料】氯化钙溶液呈中性。
【拓展问题】使废液变成红色的物质是什么?
【做出猜想】猜想一:只有碳酸钠
猜想二:只有氢氧化钠
猜想三:氢氧化钠和氢氧化钙
猜想四:氢氧化钠和碳酸钠
你认为以上猜想中,不合理的是_________。
猜想一
【验证猜想】
静置一段时间后,取少量废液缸中的上层红色清液于试管中,加入过量氯化钙溶液,有白色沉淀生成。静置后,发现试管中的上层清液仍为红色,由此证明了猜想______成立。
四
必做实验6 一定溶质质量分数的氯化钠溶液的配制
12. 小刚同学在做一定溶质质量分数的NaCl溶液的配制实验时,其配制过程如图K2-14所示。
(1)写出图中有字母标号的仪器名称:a.________,b._________。
药匙
烧杯
(2)称量NaCl时,若将NaCl放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的NaCl质量_________(填“大于”或“小于”)配制溶液所需的NaCl质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中NaCl的质量分数_________(填“偏大”“偏小”或“不变”)。
小于
偏大
(3)图示实验中有一处明显的错误是__________________________;图示实验中玻璃棒的作用是__________________________。
(4)小刚同学要配制90 g质量分数为10%的NaCl溶液,应称取NaCl的质量为_________g。
步骤A中瓶塞没有倒放
搅拌,加快溶解速率
9
必做实验7 水的组成及变化的探究
13.根据图K2-15所示实验,回答下列问题。
(1)图甲实验制取氢气的实验装置,装置内发生反应的化学方程式为_____________________,该反应的基本反应类型是____________。
Zn+H2SO4== ZnSO4+H2↑
置换反应
(2)若要收集干燥的氢气,应采用______________收集。
(3)图乙实验点燃氢气前,需____________________。点燃后,烧杯壁上出现水雾,说明水是由_________________________组成。
向下排空气法
检验其纯度(或验纯)
氢元素和氧元素
(4)图丙实验测得Va∶Vb=1∶2,要确定水分子中氢氧原子个数比,还需要的数据有_________(填字母,多选)。
A.水的相对分子质量
B.氢气、氧气的密度
C.氢原子、氧原子的质量
BC
(5)图K2-16是水分子分解的示意图,水分解过程的微观解释是_________________________________________________________________________________________。
每个水分子分解成2个氢原子和1个氧原子,2个氢原子结合成1个氢分子,2个氧原子结合成1个氧分子
必做实验8 燃烧条件的探究
14.爱思考的化学学习小组利用如图K2-17所示的装置进行“白磷燃烧条件”的探究实验。
(1)检查气密性。
实验前,打开K1、关闭K2或者打开K2、关闭K1,分别向上拉动两支注射器的活塞,若装置C中能出现_________________的现象,则装置气密性良好。
玻璃管液面上升
(2)探究白磷燃烧条件过程一
将装有白磷的具支试管放入20 ℃的冷水中,打开K1、关闭K2,向装置A中注入10%的过氧化氢溶液,一段时间后观察到装置B中白磷_________(填“燃烧”或“不燃烧”);理由是__________________________;装置A中反应的化学方程式为_________________________________。
不燃烧
温度没有达到白磷的着火点
2H2O2 ======= 2H2O+O2↑
MnO2
(3)探究白磷燃烧条件过程二
关闭K1、打开K2,往装置D中注入适量的稀盐酸,当观察到____________________________的现象时,说明二氧化碳与白磷充分接触;然后将装置B中的冷水换成80 ℃的热水,该操作的目的是证明白磷燃烧需要_______;装置C中反应的化学方程式为_______________________________________;装置D中反应的化学方程式为_____________________________________。
装置C中澄清石灰水变浑浊
氧气
Ca(OH)2+CO2 == CaCO3↓+H2O
CaCO3+2HCl == CaCl2+H2O+CO2↑
(4)探究白磷燃烧条件过程三
打开K1、关闭K2,往装置A中注入10%的过氧化氢溶液,一段时间后装置B中白磷燃烧起来,该反应的化学方程式为______________________________________。
4P+5O2 ===== 2P2O5
点燃
(5)熄灭燃烧的白磷
若要使燃烧的白磷熄灭,在不拆卸装置的条件下,需进行的三步操作:_______________________________
_______________;该灭火过程体现了二氧化碳具有的化学性质是____________________________。
关闭K1、打开K2,往装置D中注入适量的稀盐酸
不能燃烧,不支持燃烧
谢 谢!
同课章节目录
