化学人教版(2019)必修第二册7.3.1乙醇 课件(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇 课件(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 42.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 07:05:34 | ||
图片预览








文档简介
(共34张PPT)
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
1.认识乙醇的结构及其主要性质与应用,培养宏观辨识及微观探析
能力。
2.理解烃的衍生物、官能团的概念,结合实例认识官能团与性质的
关系,知道有机物之间在一定条件下是可以转化的,培养变化观
念与平衡思想。
核心素养发展目标
黄酒 白酒 红酒 啤酒
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
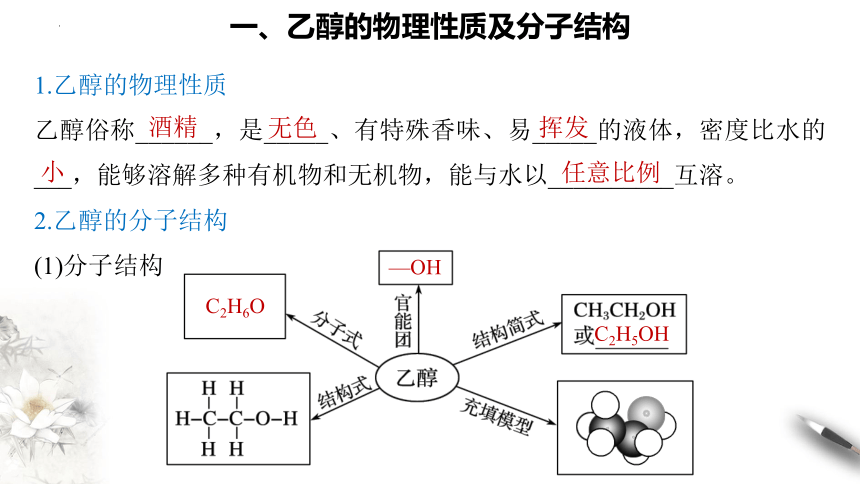
1.乙醇的物理性质
乙醇俗称______,是_____、有特殊香味、易_____的液体,密度比水的___,能够溶解多种有机物和无机物,能与水以__________互溶。
2.乙醇的分子结构
(1)分子结构
一、乙醇的物理性质及分子结构
C2H6O
—OH
C2H5OH
酒精
无色
挥发
小
任意比例
(2)烃的衍生物
烃分子中的_______被__________________所取代而生成的一系列化合物。如一氯甲烷、1,2-二溴乙烷、乙醇、乙酸等。
(3)官能团
①定义:决定有机化合物__________的原子或原子团。
氢原子
其他原子或原子团
化学特性
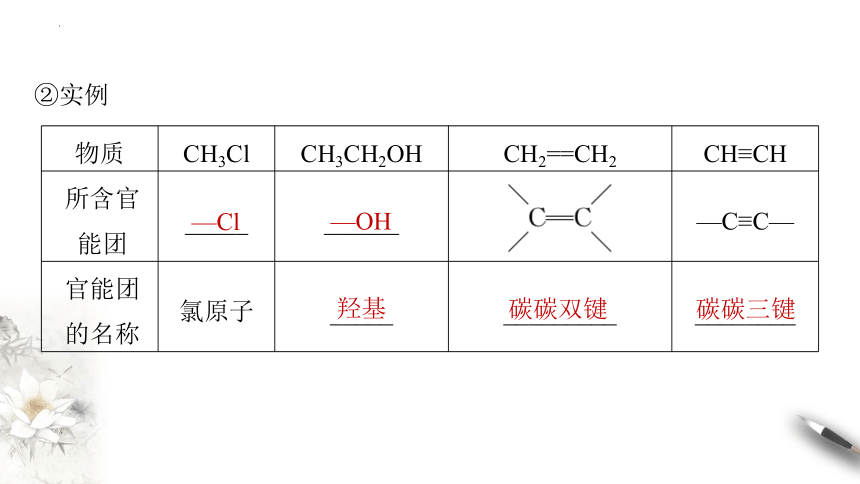
物质 CH3Cl CH3CH2OH CH2==CH2 CH≡CH
所含官 能团 _____ ______ —C≡C—
官能团 的名称 氯原子 _____ _________ ________
②实例
—Cl
—OH
羟基
碳碳双键
碳碳三键
(1)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水( )
提示 乙醇和水互溶,无法用分液的方法分离。
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(3)乙烷(CH3CH3)可以看成CH4分子中的一个H原子被甲基(—CH3)所取代而生成的产物,故乙烷为烃的衍生物( )
(4)乙醇可以看作乙烷分子中氢原子被氢氧根(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
判断正误
×
√
×
×
(5)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键( )
(6)乙醇的官能团为羟基,其电子式为 ( )
×
×
(2020·河北沧州高一期末)某有机物(含C、H、O)分子结构如图所示,有关该有机物说法正确的是________。
①该有机物含有取代基团OH-
②该有机物分子中碳和氢原子个数比为1∶3
③该有机物的同分异构体结构简式为CH3—O—CH3
④该有机物溶于水呈酸性
⑤该有机物分子中三种类型的氢原子,都能电离出H+
⑥工业上获取无水该有机物的方法,常加入新制的生石灰,再进行蒸馏
深度思考
②③⑥
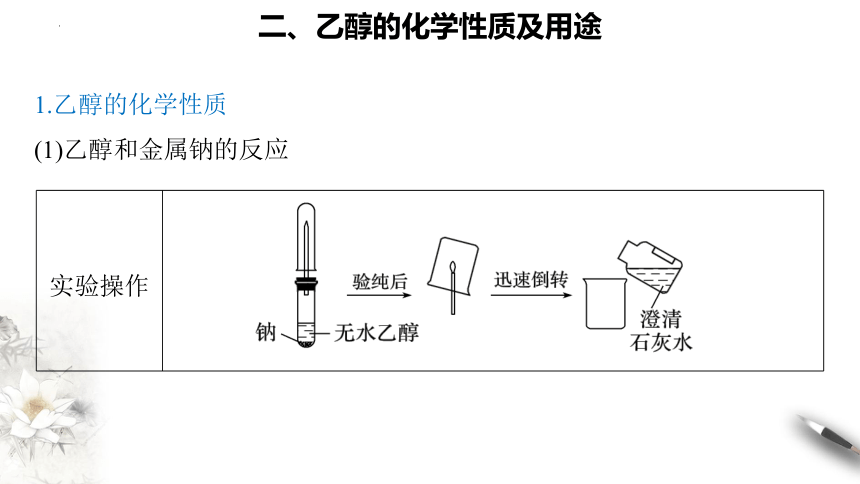
实验操作
二、乙醇的化学性质及用途
1.乙醇的化学性质
(1)乙醇和金属钠的反应
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生___________气体;
②烧杯内壁有_____产生;
③向烧杯中加入澄清石灰水_________
实验 结论 乙醇与钠反应生成_____,化学方程式为________________
___________________________
反应 实质 钠置换了羟基中的氢生成氢气
跟钠和H2O 反应比较 剧烈程度比水__,钠沉在乙醇底部,且没有熔化成金属小球
无色无味
水珠
不变浑浊
氢气
2CH3CH2OH+
2Na―→ 2CH3CH2ONa+H2↑
弱
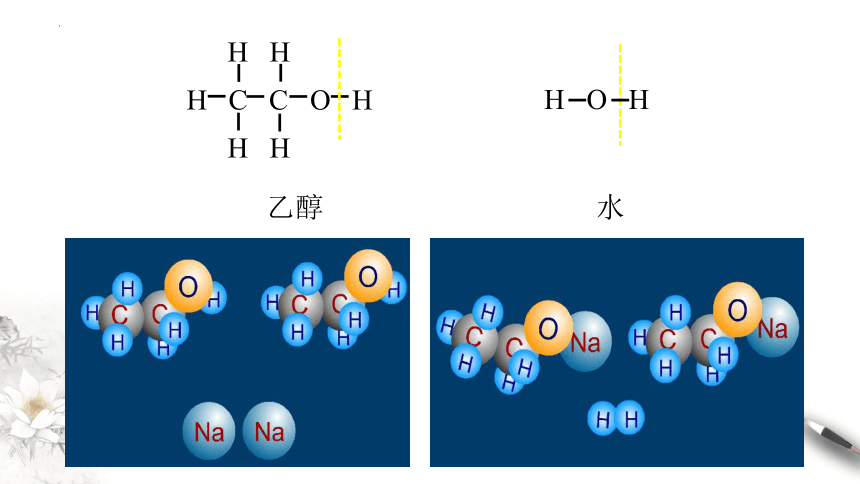
H H
H C C O H
H H
H O H
乙醇 水
实验操作
(2)乙醇的氧化反应
①燃烧
化学方程式:_________________________________。
现象:乙醇在空气中燃烧,产生_______火焰,放出_________。
②催化氧化
淡蓝色
大量的热
实验现象 红色的铜丝 变为_____ 变为_____,闻到_______气味
实验结论 乙醇被氧化为乙醛,化学方程式为______________________
_________________
知识拓展
乙醛中所含官能团为醛基( ,可简写为—CHO),乙醛在适当条件下可被进一步氧化,生成乙酸(CH3COOH)
黑色
红色
刺激性
2CH3CH2OH+O2
2CH3CHO+2H2O
③与强氧化剂反应
CH3COOH
2.乙醇的用途
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为_____的乙醇溶液作消毒剂。
75%
(1)乙醇分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol氢气
( )
提示 乙醇分子中只有羟基上的氢原子才能和钠反应,故1 mol乙醇只生成0.5 mol氢气。
(2)乙醇和金属钠反应时,是乙醇分子中的O—H键断裂( )
(3)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
判断正误
×
√
√
(4)检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水
( )
(5)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(6)乙醇催化氧化生成乙醛,乙醇能使酸性KMnO4溶液褪色,上述乙醇都表现还原性( )
×
√
√
解析 乙醇和金属钠反应时,断裂的键为羟基上的O—H,1 mol乙醇和足量钠反应会生成0.5 mol H2,在标准状况下为11.2 L。
乙醇分子中有5种化学键,如图所示 ,在不同的反应中
会有不同形式的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为______(填断键序号,下同),化学方程式为_______________________________________。1 mol 乙醇和足量的金属钠反应,生成标准状况下的氢气为______L。
深度思考
①
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
11.2
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为_____________,反
应的化学方程式为________________________________。
①②③④⑤
解析 乙醇燃烧生成CO2和H2O,分子中所有的化学键都断裂。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为______________
______(用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为______,反应方程式为_________________________________________,整个过程反应总方
程式为_________________________________________,铜在反应中起到_______作用。
2CuO
①③
催化剂
②如果将乙醇改为 ,试写出在该条件下的化学反应方程
式:______________________________________________。
③如果醇为 ,在该条件下,醇还能被催化氧化吗?为什么?
+2H2O
答案 不能被催化氧化;因为该分子中和羟基相连的碳原子上没有氢原子,不能被催化脱氢。
解析 在Cu的作用下,乙醇和氧气反应,实质是Cu首先和O2生成CuO,CuO再和CH3CH2OH反应生成CH3CHO、Cu和H2O,整个化学反应过程中,Cu为催化剂,反应中CH3CH2OH分子中的O—H及和—OH相连的碳原子上的C—H断裂,最终生成CH3CHO,若和—OH相连的碳原子有一个H原
子,则被氧化为 ,若没有氢原子,则不能被催化氧化。
醇的催化氧化反应规律
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
(2)凡是含有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮(R—CO—R′)。
(3)凡是含有 结构的醇通常情况下不能被氧化。
归纳总结
返回
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间充填模型为
1
2
3
5
随堂演练 知识落实
4
√
1
2
3
5
4
解析 甲基的电子式为 ,A项错误;
乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;
羟基的电子式为 ,为中性基团,C项错误。
解析 决定乙醇性质的原子团为羟基,羟基为乙醇的官能团。
2.决定乙醇主要化学性质的原子或原子团是
A.羟基 B.乙基(—CH2CH3)
C.氢氧根离子 D.氢离子
1
2
3
5
4
√
解析 钠可以和乙醇发生反应生成乙醇钠和氢气,故不能用乙醇保存金属钠,A错误;
无水CuSO4可以和水反应生成蓝色晶体,故可检验乙醇中是否含水,B正确,
乙醇和水互溶,故乙醇不能萃取溴水中的溴,C正确;
乙醇和水的沸点不同,故可以用蒸馏的方法分离乙醇和水,D正确。
3.下列有关乙醇的说法错误的是
A.钠的密度大于乙醇,实验室可用乙醇保存金属钠
B.可用无水CuSO4检验工业酒精中是否含水
C.乙醇不能萃取出溴水中的溴
D.分离乙醇和水常用蒸馏的方法
√
1
2
3
5
4
4.(2019·山东聊城高一月考)小明在探究乙醇性质的实验中,下列描述正确的是
A.金属钠沉在乙醇液面之下,熔化成小球,剧烈反应
B.向乙醇的水溶液滴入几滴酚酞,溶液变红色
C.将灼烧的铜丝伸入乙醇中,铜丝溶解,生成刺激性物质
D.向乙醇中滴加酸性KMnO4溶液,紫红色褪去
√
1
2
3
5
4
解析 钠的密度比乙醇的大,沉在乙醇下面,但反应比较缓慢,放出热量不足以使钠熔化,A错误;
乙醇溶液呈中性,不能使酚酞溶液变色,B错误;
铜在乙醇的催化氧化反应中为催化剂,铜丝不会溶解,C错误;
乙醇能被酸性KMnO4溶液氧化,因而紫红色褪去,D正确。
1
2
3
5
4
______________________________________________________________________________________________________________。
5.已知分子结构中含有—OH的有机物可以和钠反应放出氢气,某实验小
组为了测定乙醇的结构式是 还是 ,
利用乙醇和钠的反应,设计如图装置进行实验
探究:
(1)实验前检验该装置的气密性的实验操作是
________________________________________
连接好装置,关闭分液漏斗的活塞,将右侧
导管插入水槽,微热烧瓶,右侧导管若有气泡冒出,冷却后形成一段水柱,且一段时间内水柱不变化,证明装置气密性良好
1
2
3
5
4
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为________(填“正确”或“不正确”)。
(3)如果实验开始前b导管内未充满水,则实验结果将______(填“偏大”或“偏小”)。
1
2
3
5
4
不正确
偏小
解析 该实验的关键是准确测量反应产生气体的体积,根据产生气体的体积可以确定被置换的氢原子的个数。
如果实验开始前b导管内未充满水,则会使排出水的体积减小,故实验结果偏小。
解析 参加反应的乙醇的物质的量是0.025 mol,生成氢气的物质的量是0.012 5 mol,即乙醇分子中的6个氢原子所处的化学环境并不完全相同,有1个应不同于其他的氢原子,从而确定乙醇的结构为Ⅱ式。
(4)若测得有1.15 g C2H6O参加反应,把量筒c中水的体积换算成标准状况下H2的体积为280 mL,试结合计算和讨论,判断下面Ⅰ和Ⅱ两式中,哪个正确?____(填“Ⅰ”或“Ⅱ”)。
1
2
3
5
4
Ⅱ
Ⅰ Ⅱ
返回
本课结束
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
1.认识乙醇的结构及其主要性质与应用,培养宏观辨识及微观探析
能力。
2.理解烃的衍生物、官能团的概念,结合实例认识官能团与性质的
关系,知道有机物之间在一定条件下是可以转化的,培养变化观
念与平衡思想。
核心素养发展目标
黄酒 白酒 红酒 啤酒
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
1.乙醇的物理性质
乙醇俗称______,是_____、有特殊香味、易_____的液体,密度比水的___,能够溶解多种有机物和无机物,能与水以__________互溶。
2.乙醇的分子结构
(1)分子结构
一、乙醇的物理性质及分子结构
C2H6O
—OH
C2H5OH
酒精
无色
挥发
小
任意比例
(2)烃的衍生物
烃分子中的_______被__________________所取代而生成的一系列化合物。如一氯甲烷、1,2-二溴乙烷、乙醇、乙酸等。
(3)官能团
①定义:决定有机化合物__________的原子或原子团。
氢原子
其他原子或原子团
化学特性
物质 CH3Cl CH3CH2OH CH2==CH2 CH≡CH
所含官 能团 _____ ______ —C≡C—
官能团 的名称 氯原子 _____ _________ ________
②实例
—Cl
—OH
羟基
碳碳双键
碳碳三键
(1)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水( )
提示 乙醇和水互溶,无法用分液的方法分离。
(2)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(3)乙烷(CH3CH3)可以看成CH4分子中的一个H原子被甲基(—CH3)所取代而生成的产物,故乙烷为烃的衍生物( )
(4)乙醇可以看作乙烷分子中氢原子被氢氧根(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
判断正误
×
√
×
×
(5)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键( )
(6)乙醇的官能团为羟基,其电子式为 ( )
×
×
(2020·河北沧州高一期末)某有机物(含C、H、O)分子结构如图所示,有关该有机物说法正确的是________。
①该有机物含有取代基团OH-
②该有机物分子中碳和氢原子个数比为1∶3
③该有机物的同分异构体结构简式为CH3—O—CH3
④该有机物溶于水呈酸性
⑤该有机物分子中三种类型的氢原子,都能电离出H+
⑥工业上获取无水该有机物的方法,常加入新制的生石灰,再进行蒸馏
深度思考
②③⑥
实验操作
二、乙醇的化学性质及用途
1.乙醇的化学性质
(1)乙醇和金属钠的反应
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生___________气体;
②烧杯内壁有_____产生;
③向烧杯中加入澄清石灰水_________
实验 结论 乙醇与钠反应生成_____,化学方程式为________________
___________________________
反应 实质 钠置换了羟基中的氢生成氢气
跟钠和H2O 反应比较 剧烈程度比水__,钠沉在乙醇底部,且没有熔化成金属小球
无色无味
水珠
不变浑浊
氢气
2CH3CH2OH+
2Na―→ 2CH3CH2ONa+H2↑
弱
H H
H C C O H
H H
H O H
乙醇 水
实验操作
(2)乙醇的氧化反应
①燃烧
化学方程式:_________________________________。
现象:乙醇在空气中燃烧,产生_______火焰,放出_________。
②催化氧化
淡蓝色
大量的热
实验现象 红色的铜丝 变为_____ 变为_____,闻到_______气味
实验结论 乙醇被氧化为乙醛,化学方程式为______________________
_________________
知识拓展
乙醛中所含官能团为醛基( ,可简写为—CHO),乙醛在适当条件下可被进一步氧化,生成乙酸(CH3COOH)
黑色
红色
刺激性
2CH3CH2OH+O2
2CH3CHO+2H2O
③与强氧化剂反应
CH3COOH
2.乙醇的用途
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为_____的乙醇溶液作消毒剂。
75%
(1)乙醇分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol氢气
( )
提示 乙醇分子中只有羟基上的氢原子才能和钠反应,故1 mol乙醇只生成0.5 mol氢气。
(2)乙醇和金属钠反应时,是乙醇分子中的O—H键断裂( )
(3)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
判断正误
×
√
√
(4)检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水
( )
(5)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(6)乙醇催化氧化生成乙醛,乙醇能使酸性KMnO4溶液褪色,上述乙醇都表现还原性( )
×
√
√
解析 乙醇和金属钠反应时,断裂的键为羟基上的O—H,1 mol乙醇和足量钠反应会生成0.5 mol H2,在标准状况下为11.2 L。
乙醇分子中有5种化学键,如图所示 ,在不同的反应中
会有不同形式的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1)和金属钠反应,断裂的化学键为______(填断键序号,下同),化学方程式为_______________________________________。1 mol 乙醇和足量的金属钠反应,生成标准状况下的氢气为______L。
深度思考
①
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
11.2
(2)乙醇在空气中充分燃烧,反应时断裂的化学键为_____________,反
应的化学方程式为________________________________。
①②③④⑤
解析 乙醇燃烧生成CO2和H2O,分子中所有的化学键都断裂。
(3)①将弯成螺旋状的铜丝灼烧,铜丝变黑,反应原理为______________
______(用化学方程式表示)。然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为______,反应方程式为_________________________________________,整个过程反应总方
程式为_________________________________________,铜在反应中起到_______作用。
2CuO
①③
催化剂
②如果将乙醇改为 ,试写出在该条件下的化学反应方程
式:______________________________________________。
③如果醇为 ,在该条件下,醇还能被催化氧化吗?为什么?
+2H2O
答案 不能被催化氧化;因为该分子中和羟基相连的碳原子上没有氢原子,不能被催化脱氢。
解析 在Cu的作用下,乙醇和氧气反应,实质是Cu首先和O2生成CuO,CuO再和CH3CH2OH反应生成CH3CHO、Cu和H2O,整个化学反应过程中,Cu为催化剂,反应中CH3CH2OH分子中的O—H及和—OH相连的碳原子上的C—H断裂,最终生成CH3CHO,若和—OH相连的碳原子有一个H原
子,则被氧化为 ,若没有氢原子,则不能被催化氧化。
醇的催化氧化反应规律
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
(2)凡是含有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮(R—CO—R′)。
(3)凡是含有 结构的醇通常情况下不能被氧化。
归纳总结
返回
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间充填模型为
1
2
3
5
随堂演练 知识落实
4
√
1
2
3
5
4
解析 甲基的电子式为 ,A项错误;
乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;
羟基的电子式为 ,为中性基团,C项错误。
解析 决定乙醇性质的原子团为羟基,羟基为乙醇的官能团。
2.决定乙醇主要化学性质的原子或原子团是
A.羟基 B.乙基(—CH2CH3)
C.氢氧根离子 D.氢离子
1
2
3
5
4
√
解析 钠可以和乙醇发生反应生成乙醇钠和氢气,故不能用乙醇保存金属钠,A错误;
无水CuSO4可以和水反应生成蓝色晶体,故可检验乙醇中是否含水,B正确,
乙醇和水互溶,故乙醇不能萃取溴水中的溴,C正确;
乙醇和水的沸点不同,故可以用蒸馏的方法分离乙醇和水,D正确。
3.下列有关乙醇的说法错误的是
A.钠的密度大于乙醇,实验室可用乙醇保存金属钠
B.可用无水CuSO4检验工业酒精中是否含水
C.乙醇不能萃取出溴水中的溴
D.分离乙醇和水常用蒸馏的方法
√
1
2
3
5
4
4.(2019·山东聊城高一月考)小明在探究乙醇性质的实验中,下列描述正确的是
A.金属钠沉在乙醇液面之下,熔化成小球,剧烈反应
B.向乙醇的水溶液滴入几滴酚酞,溶液变红色
C.将灼烧的铜丝伸入乙醇中,铜丝溶解,生成刺激性物质
D.向乙醇中滴加酸性KMnO4溶液,紫红色褪去
√
1
2
3
5
4
解析 钠的密度比乙醇的大,沉在乙醇下面,但反应比较缓慢,放出热量不足以使钠熔化,A错误;
乙醇溶液呈中性,不能使酚酞溶液变色,B错误;
铜在乙醇的催化氧化反应中为催化剂,铜丝不会溶解,C错误;
乙醇能被酸性KMnO4溶液氧化,因而紫红色褪去,D正确。
1
2
3
5
4
______________________________________________________________________________________________________________。
5.已知分子结构中含有—OH的有机物可以和钠反应放出氢气,某实验小
组为了测定乙醇的结构式是 还是 ,
利用乙醇和钠的反应,设计如图装置进行实验
探究:
(1)实验前检验该装置的气密性的实验操作是
________________________________________
连接好装置,关闭分液漏斗的活塞,将右侧
导管插入水槽,微热烧瓶,右侧导管若有气泡冒出,冷却后形成一段水柱,且一段时间内水柱不变化,证明装置气密性良好
1
2
3
5
4
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为________(填“正确”或“不正确”)。
(3)如果实验开始前b导管内未充满水,则实验结果将______(填“偏大”或“偏小”)。
1
2
3
5
4
不正确
偏小
解析 该实验的关键是准确测量反应产生气体的体积,根据产生气体的体积可以确定被置换的氢原子的个数。
如果实验开始前b导管内未充满水,则会使排出水的体积减小,故实验结果偏小。
解析 参加反应的乙醇的物质的量是0.025 mol,生成氢气的物质的量是0.012 5 mol,即乙醇分子中的6个氢原子所处的化学环境并不完全相同,有1个应不同于其他的氢原子,从而确定乙醇的结构为Ⅱ式。
(4)若测得有1.15 g C2H6O参加反应,把量筒c中水的体积换算成标准状况下H2的体积为280 mL,试结合计算和讨论,判断下面Ⅰ和Ⅱ两式中,哪个正确?____(填“Ⅰ”或“Ⅱ”)。
1
2
3
5
4
Ⅱ
Ⅰ Ⅱ
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
