2023年广东省初中化学学业水平考试化学模拟试卷(一)(共40张PPT)
文档属性
| 名称 | 2023年广东省初中化学学业水平考试化学模拟试卷(一)(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 07:50:05 | ||
图片预览









文档简介
(共40张PPT)
第四部分 中考模拟实战练
2023年广东省初中学业水平考试
化学模拟试卷(一)
5.可能用到的相对原子质量:H-1 C-12 N-14
O-16 Na-23 Cl-35.5 Zn-65
一、选择题:本大题共15小题。每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.《天工开物》记载的以竹子为原料的古法造纸工艺的主要步骤如下:①斩竹浸泡;②烧木煮碱;③捞浆成膜;④膜干得纸。其中以物理变化为主的步骤是( )
A.①②③ B.②③④ C.①②④ D.①③④
D
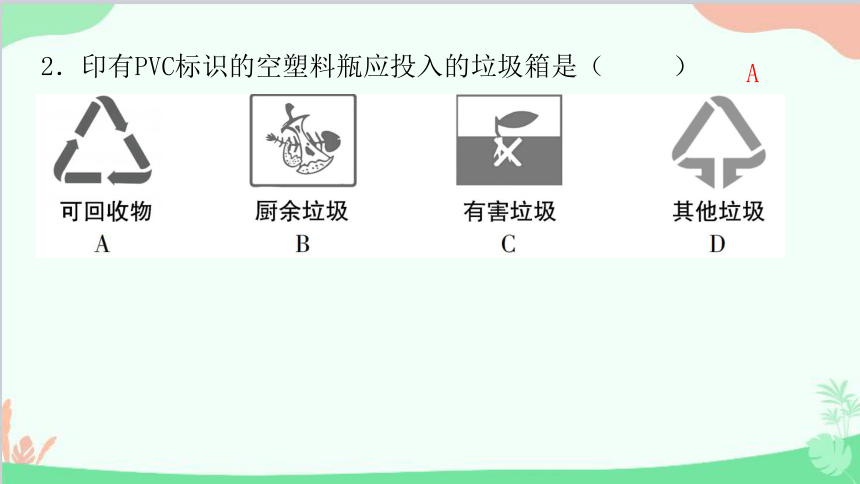
2.印有PVC标识的空塑料瓶应投入的垃圾箱是( )
A
3.冰墩墩是2022年北京冬奥会的吉祥物,某冰墩墩玩具的外用材料为纯羊毛,内充物为聚酯纤维,该材料属于( )
A.天然橡胶 B.天然纤维
C.金属材料 D.合成材料
4.下列化学用语中,只具有微观意义的是( )
A.N2 B.H C.Cu D.O2-
D
D
5.2022年中国水周活动主题为“推进地下水超采综合治理,复苏河湖生态环境”。下列有关水的说法错误的是( )
A.活性炭可除去水中色素和异味
B.用肥皂水可以区分硬水和软水
C.明矾用于净水主要起杀菌消毒的作用
D.水通电得到氢气和氧气的体积比为2∶1
C
6.“一粥一饭,当思来处不易;半丝半缕,恒念物力维艰。”节约粮食是我们中华民族的传统美德。下列有关食物与营养健康的说法正确的是( )
A.适量食用蔬菜补充维生素C,以预防夜盲症
B.霉变大豆榨成豆油食用,以节约粮食提供营养
C.油脂是提供能量的重要物质,应多吃油炸食品
D.馒头和米饭富含人体需要的基本营养素糖类,每天应适量摄入
D
7.蔡旭哲老师在“天宫课堂”第三课中介绍冷原子钟50亿年的误差只有1秒。铯可用于制作冷原子钟。如图S1-1是铯在元素周期表中的信息,下列有关说法正确的是( )
A.铯的原子序数为55
B.铯属于非金属元素
C.铯原子带55个单位的正电荷
D.铯的相对原子质量为132.9 g
A
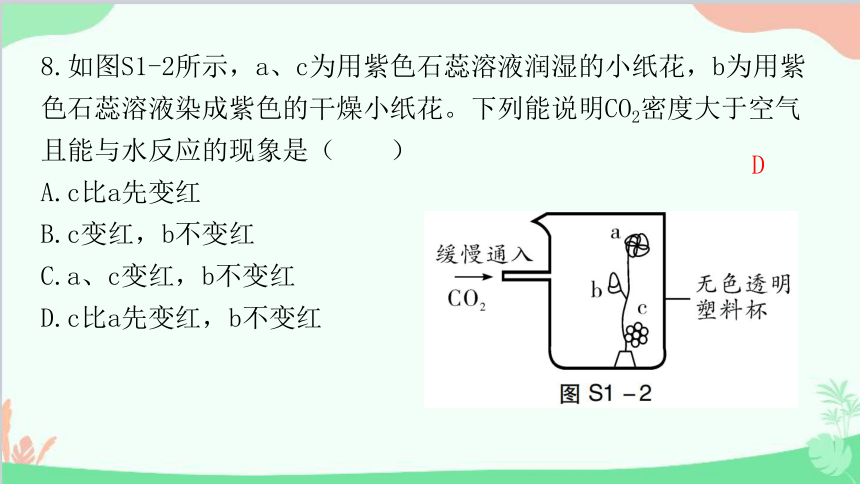
8.如图S1-2所示,a、c为用紫色石蕊溶液润湿的小纸花,b为用紫色石蕊溶液染成紫色的干燥小纸花。下列能说明CO2密度大于空气且能与水反应的现象是( )
A.c比a先变红
B.c变红,b不变红
C.a、c变红,b不变红
D.c比a先变红,b不变红
D
9.《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七具有化瘀止血、活血定痛、抗氧化、调节免疫、安神的作用,成分主要是田七氨酸(C5H8N2O5),下列有关说法错误的是( )
A.田七氨酸是由碳、氢、氮、氧四种元素组成的物质
B.田七氨酸中碳、氢、氮、氧元素质量比为5∶8∶2∶5
C.田七氨酸中氧元素的质量分数最大
D.一个田七氨酸分子由5个碳原子、8个氢原子、2个氮原子和5个氧原子构成
B
10.下列有关化学史的叙述错误的是( )
A.拉瓦锡发现空气是由氧气和氮气组成的
B.张青莲为相对原子质量的测定做出卓越贡献
C.门捷列夫编制了第一张元素周期表
D.波义耳提出了原子论
D
C
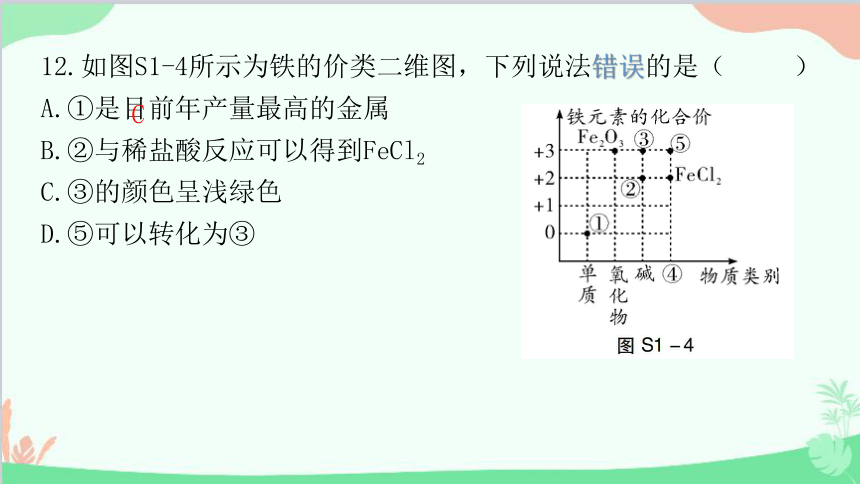
12.如图S1-4所示为铁的价类二维图,下列说法错误的是( )
A.①是目前年产量最高的金属
B.②与稀盐酸反应可以得到FeCl2
C.③的颜色呈浅绿色
D.⑤可以转化为③
C
13.下列有关物质的除杂或鉴别所用试剂或方法中,不正确的是( )
B
选项 除杂或鉴别 试剂或方法
A 除去氦气中的氧气 通过灼热的铜丝网
B 除去铜粉中含有的碳粉 在空气中灼烧
C 鉴别羊毛线和腈纶线 灼烧后闻气味
D 鉴别氢氧化钠溶液、稀硫酸 无色酚酞溶液
A
B
15.下列图像与所对应操作不相符的是( )
A.H2和CuO在加热条件下充分反应
B.向浓盐酸溶液中加入水
C.向HCl和CuCl2的混合溶液中加入Ba(OH)2溶液
D.向一定量水中加入少量浓硫酸
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.化学与生活息息相关,在医疗上也有不可或缺的作用,请用所学化学知识解答下列问题。
(1)空气的成分中用于医疗急救的是_______(填化学式),小苏打在医疗上的作用是_______________。
O2
治疗胃酸过多
(2)有一种中间有凸起小囊区的创可贴(如图S1-5),使用时按贴伤口的同时小囊区内的水与____________(填“NaOH”或“NH4NO3”)被挤破混合。使温度降低,能起到快速止血的作用。
NH4NO3
(3)40%的甲醛(CH2O)溶液常用于医药的组织固定剂和防腐剂,工业用甲醇(CH3OH)氧化得到甲醛和另一种常见液体丁的微观示意图如图S1-6所示。
①请将生成物丁补画完全;
如答图S1-1所示。
②甲醇(CH3OH)中碳、氢元素的质量比为____________;
③写出该反应的化学方程式:_______________________________________。
17.2022年10月19日,中国海油对外宣布,在海南岛东南部海域琼东南盆地再获勘探重大突破。发现了我国首个深水深层大气田宝岛21-1,探明天然气储量超过500亿立方米。
(1)天然气是一种化石燃料,常见的化石燃料还包括煤和_______,它们属于____________(填“可再生”或“不可再生”)能源。
3∶1
2CH3OH+O2 ====== 2CH2O+2H2O
一定条件
石油
不可再生
(2)天然气的主要成分是甲烷,试写出甲烷在空气中充分燃烧的化学方程式:___________________________。
(3)家庭使用天然气时,要注意用气安全。
①为了及时发天然气泄漏,可在燃气中添加乙硫醇(C2H5SH)作加臭剂。乙硫醇是最臭的物质之一,空气中仅含五百亿分之一时,其臭味就可嗅到,用分子的知识解释人们闻到臭味的原因是_____________________;
CH4+2O2 ====== CO2+2H2O
点燃
分子在不断运动
②为防止天然气泄漏造成危险,应在厨房安装天然气泄漏报警器,安装位置应在燃气灶附近墙壁的____________(填“上方”“下方”或“水平位置”);
③如果报警器显示漏气,下列应急措施可行的有____________(填字母,多选)。
A.检查并关闭气源阀门
B.轻轻打开门窗通风
C.立即打开抽油烟机排气
上方
AB
(4)天然气中混入的乙硫醇也可以在氧气中燃烧,反应的化学方程式为2C2H5SH+9O2== 4CO2+2X+6H2O,X的化学式为____________。
SO2
18.保险粉(Na2S2O4)在工农业生产中有广泛的用途。
查阅资料:①Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;②在NaCl存在下,Na2S2O4在水中溶解度显著减小。保险粉的制备工艺流程如图S1-7所示。
(1)反应Ⅰ的原理为Zn+2SO2 == ZnS2O4,该反应中将Zn研磨成粉末的目的是_____________________________
_____________________。
增大反应物接触面积,使反应更快、更充分
(2)反应Ⅱ为复分解反应,写出该反应的化学方程式:_____________________________________。
(3)操作a的名称为____________,实验室进行此操作需要用到的玻璃仪器有_________________________。
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出,要加入NaCl的原因是___________________________________
___________,还需要加入少量NaOH的原因是_______________________________________。
ZnS2O4+2NaOH == Na2S2O4+Zn(OH)2↓
过滤
烧杯、漏斗、玻璃棒
在NaCl存在下,Na2S2O4在水中溶解度显著减小
Na2S2O4在碱性溶液中稳定
(5)Zn(OH)2在加热的条件下分解成两种氧化物,写用该反应的化学方程式:________________________。
(6)198 g Zn(OH)2理论上能得到Zn的质量为____________g。
Zn(OH)2 ====== ZnO+H2O
△
130
19.分析图S1-8中的实验装置,并
结合所提供的信息,完成下列实验。
已知:乙炔(C2H2)是一种无色无味
气体,极难溶于水,密度比空气略
小。实验室里常用电石(CaC2)与水在常温下反应来制取。
(1)实验室用KClO3制取一瓶较纯净的O2,应选用的装置是_______(填字母),反应的化学方程式为__________________________________。
AC
2KClO3 ====== 2KCl + 3O2↑
△
MnO2
(2)实验室用电石制取乙炔,选用的发生装置是_______(填字母),反应生成乙炔的同时会生成一种碱,反应的化学方程式是____________________________。
B
CaC2+2H2O == Ca(OH)2+C2H2↑
(3)已知 CaCl2的水溶液呈中性。用图S1-9甲所示的装置制取 CO2及并探究性质。实验开始时,向锥形瓶中加入一定量的稀盐酸。图S1-9乙表示实验过程中装置 G 和Ⅰ中溶液的 pH 变化曲线。
①装置 H 的作用为______________________________
____________________________________;
除去HCl气体,防止影响装置Ⅰ中 pH 测定(2分)
②t1时,锥形瓶中有固体残留,无气泡产生。根据显示器 A 的曲线判断稀盐酸____________(填“不足”或“过量”);
③t1后,显示器 B 的曲线几乎无变化,其可能原因是____________(填字母)。
a.CO2的溶解已经达到饱和
b.t1时装置 G 中反应已停止,没有 CO2生成
过量
ab
20.某班同学分三个小组对酸、碱、盐的化学性质进行了探究。
(1)第一组同学为了证明稀盐酸与氢氧化钠溶液发生了反应,如图S1-10甲所示实验,传感器测定的pH和温度随溶液质量的变化情况如图S1-10乙、图S1-10丙所示。
由图S1-10乙可以判断实验中加入的B溶液是_________,写出反应的化学方程式:_________________________;图S1-10丙中的M与图S1-10乙中的X、Y、Z中的_____数值相等。
稀盐酸
HCl+NaOH == NaCl+H2O
Y
(2)第二组同学做了如图S1-11所示实验。
【提出问题】
②号试管中无色溶液的溶质是什么?
【做出猜想】猜想一:氯化钠
猜想二:____________________
猜想三:氯化钠、氢氧化钠
氯化钠、氯化氢
【反思】甲同学认为猜想三不成立,因为①②试管中溶液混合后烧杯中没有蓝色沉淀生成,乙同学则认为猜想三可以成立,理由是______________________________________________________________________________________________。
①试管中含有过量的稀盐酸,稀盐酸和氢氧化钠先反应
(3)第三组同学将一定量的澄清石灰水加入10 g 7.3%的稀盐酸中,未观察到明显现象,再向混合后的溶液中滴加溶质质量分数为5%的碳酸钠溶液,烧杯中溶液的质量与碳酸钠溶液的质量关系如图S1-12所示。
①图示信息______(填“能”或“不能”)作为稀盐酸和澄清石灰水发生反应的证据,理由是________________
________________________________
____________________;
能
ab段与10.6 g碳酸钠溶液反应消耗盐酸的质量是5 g,小于10 g
②写出bc段发生反应的化学方程式:________________________________________。
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
21.2021年6月27日我国“长征”二号运载火箭搭载“神舟”十二号载人飞船顺利升空。火箭推进剂有液氢、液氧、偏二甲肼(C2H8N2)与四氧化二氮等。
(1)其中偏二甲肼与四氧化二氮的燃烧生成二氧化碳、氧气和氮气。工业上获得氮气的方法是_____________,氮气的通常用途是______________________________
__________(写一条)。
分离液态空气
做保护气(或做冷冻剂等,合理即可)
(2)在实验室把一定质量偏二甲肼在氧气中完全燃烧,其反应化学方程式为C2H8N2+4O2 ====== 2CO2+4H2O+N2。将产生的气体依次通入浓硫酸和碱石灰(主要成分为氢氧化钠和氧化钙固体),将碱石灰增重(吸收二氧化碳)的数据绘成的曲线如图S1-13。请计算燃烧的偏二甲肼的质量。(写出计算过程)
点燃
点燃
(3)上述浓硫酸的作用是吸收燃烧产物H2O。请在图S1-13中画出浓硫酸增重的曲线。
如答图S1-2所示。
谢 谢!
第四部分 中考模拟实战练
2023年广东省初中学业水平考试
化学模拟试卷(一)
5.可能用到的相对原子质量:H-1 C-12 N-14
O-16 Na-23 Cl-35.5 Zn-65
一、选择题:本大题共15小题。每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.《天工开物》记载的以竹子为原料的古法造纸工艺的主要步骤如下:①斩竹浸泡;②烧木煮碱;③捞浆成膜;④膜干得纸。其中以物理变化为主的步骤是( )
A.①②③ B.②③④ C.①②④ D.①③④
D
2.印有PVC标识的空塑料瓶应投入的垃圾箱是( )
A
3.冰墩墩是2022年北京冬奥会的吉祥物,某冰墩墩玩具的外用材料为纯羊毛,内充物为聚酯纤维,该材料属于( )
A.天然橡胶 B.天然纤维
C.金属材料 D.合成材料
4.下列化学用语中,只具有微观意义的是( )
A.N2 B.H C.Cu D.O2-
D
D
5.2022年中国水周活动主题为“推进地下水超采综合治理,复苏河湖生态环境”。下列有关水的说法错误的是( )
A.活性炭可除去水中色素和异味
B.用肥皂水可以区分硬水和软水
C.明矾用于净水主要起杀菌消毒的作用
D.水通电得到氢气和氧气的体积比为2∶1
C
6.“一粥一饭,当思来处不易;半丝半缕,恒念物力维艰。”节约粮食是我们中华民族的传统美德。下列有关食物与营养健康的说法正确的是( )
A.适量食用蔬菜补充维生素C,以预防夜盲症
B.霉变大豆榨成豆油食用,以节约粮食提供营养
C.油脂是提供能量的重要物质,应多吃油炸食品
D.馒头和米饭富含人体需要的基本营养素糖类,每天应适量摄入
D
7.蔡旭哲老师在“天宫课堂”第三课中介绍冷原子钟50亿年的误差只有1秒。铯可用于制作冷原子钟。如图S1-1是铯在元素周期表中的信息,下列有关说法正确的是( )
A.铯的原子序数为55
B.铯属于非金属元素
C.铯原子带55个单位的正电荷
D.铯的相对原子质量为132.9 g
A
8.如图S1-2所示,a、c为用紫色石蕊溶液润湿的小纸花,b为用紫色石蕊溶液染成紫色的干燥小纸花。下列能说明CO2密度大于空气且能与水反应的现象是( )
A.c比a先变红
B.c变红,b不变红
C.a、c变红,b不变红
D.c比a先变红,b不变红
D
9.《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七具有化瘀止血、活血定痛、抗氧化、调节免疫、安神的作用,成分主要是田七氨酸(C5H8N2O5),下列有关说法错误的是( )
A.田七氨酸是由碳、氢、氮、氧四种元素组成的物质
B.田七氨酸中碳、氢、氮、氧元素质量比为5∶8∶2∶5
C.田七氨酸中氧元素的质量分数最大
D.一个田七氨酸分子由5个碳原子、8个氢原子、2个氮原子和5个氧原子构成
B
10.下列有关化学史的叙述错误的是( )
A.拉瓦锡发现空气是由氧气和氮气组成的
B.张青莲为相对原子质量的测定做出卓越贡献
C.门捷列夫编制了第一张元素周期表
D.波义耳提出了原子论
D
C
12.如图S1-4所示为铁的价类二维图,下列说法错误的是( )
A.①是目前年产量最高的金属
B.②与稀盐酸反应可以得到FeCl2
C.③的颜色呈浅绿色
D.⑤可以转化为③
C
13.下列有关物质的除杂或鉴别所用试剂或方法中,不正确的是( )
B
选项 除杂或鉴别 试剂或方法
A 除去氦气中的氧气 通过灼热的铜丝网
B 除去铜粉中含有的碳粉 在空气中灼烧
C 鉴别羊毛线和腈纶线 灼烧后闻气味
D 鉴别氢氧化钠溶液、稀硫酸 无色酚酞溶液
A
B
15.下列图像与所对应操作不相符的是( )
A.H2和CuO在加热条件下充分反应
B.向浓盐酸溶液中加入水
C.向HCl和CuCl2的混合溶液中加入Ba(OH)2溶液
D.向一定量水中加入少量浓硫酸
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.化学与生活息息相关,在医疗上也有不可或缺的作用,请用所学化学知识解答下列问题。
(1)空气的成分中用于医疗急救的是_______(填化学式),小苏打在医疗上的作用是_______________。
O2
治疗胃酸过多
(2)有一种中间有凸起小囊区的创可贴(如图S1-5),使用时按贴伤口的同时小囊区内的水与____________(填“NaOH”或“NH4NO3”)被挤破混合。使温度降低,能起到快速止血的作用。
NH4NO3
(3)40%的甲醛(CH2O)溶液常用于医药的组织固定剂和防腐剂,工业用甲醇(CH3OH)氧化得到甲醛和另一种常见液体丁的微观示意图如图S1-6所示。
①请将生成物丁补画完全;
如答图S1-1所示。
②甲醇(CH3OH)中碳、氢元素的质量比为____________;
③写出该反应的化学方程式:_______________________________________。
17.2022年10月19日,中国海油对外宣布,在海南岛东南部海域琼东南盆地再获勘探重大突破。发现了我国首个深水深层大气田宝岛21-1,探明天然气储量超过500亿立方米。
(1)天然气是一种化石燃料,常见的化石燃料还包括煤和_______,它们属于____________(填“可再生”或“不可再生”)能源。
3∶1
2CH3OH+O2 ====== 2CH2O+2H2O
一定条件
石油
不可再生
(2)天然气的主要成分是甲烷,试写出甲烷在空气中充分燃烧的化学方程式:___________________________。
(3)家庭使用天然气时,要注意用气安全。
①为了及时发天然气泄漏,可在燃气中添加乙硫醇(C2H5SH)作加臭剂。乙硫醇是最臭的物质之一,空气中仅含五百亿分之一时,其臭味就可嗅到,用分子的知识解释人们闻到臭味的原因是_____________________;
CH4+2O2 ====== CO2+2H2O
点燃
分子在不断运动
②为防止天然气泄漏造成危险,应在厨房安装天然气泄漏报警器,安装位置应在燃气灶附近墙壁的____________(填“上方”“下方”或“水平位置”);
③如果报警器显示漏气,下列应急措施可行的有____________(填字母,多选)。
A.检查并关闭气源阀门
B.轻轻打开门窗通风
C.立即打开抽油烟机排气
上方
AB
(4)天然气中混入的乙硫醇也可以在氧气中燃烧,反应的化学方程式为2C2H5SH+9O2== 4CO2+2X+6H2O,X的化学式为____________。
SO2
18.保险粉(Na2S2O4)在工农业生产中有广泛的用途。
查阅资料:①Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;②在NaCl存在下,Na2S2O4在水中溶解度显著减小。保险粉的制备工艺流程如图S1-7所示。
(1)反应Ⅰ的原理为Zn+2SO2 == ZnS2O4,该反应中将Zn研磨成粉末的目的是_____________________________
_____________________。
增大反应物接触面积,使反应更快、更充分
(2)反应Ⅱ为复分解反应,写出该反应的化学方程式:_____________________________________。
(3)操作a的名称为____________,实验室进行此操作需要用到的玻璃仪器有_________________________。
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出,要加入NaCl的原因是___________________________________
___________,还需要加入少量NaOH的原因是_______________________________________。
ZnS2O4+2NaOH == Na2S2O4+Zn(OH)2↓
过滤
烧杯、漏斗、玻璃棒
在NaCl存在下,Na2S2O4在水中溶解度显著减小
Na2S2O4在碱性溶液中稳定
(5)Zn(OH)2在加热的条件下分解成两种氧化物,写用该反应的化学方程式:________________________。
(6)198 g Zn(OH)2理论上能得到Zn的质量为____________g。
Zn(OH)2 ====== ZnO+H2O
△
130
19.分析图S1-8中的实验装置,并
结合所提供的信息,完成下列实验。
已知:乙炔(C2H2)是一种无色无味
气体,极难溶于水,密度比空气略
小。实验室里常用电石(CaC2)与水在常温下反应来制取。
(1)实验室用KClO3制取一瓶较纯净的O2,应选用的装置是_______(填字母),反应的化学方程式为__________________________________。
AC
2KClO3 ====== 2KCl + 3O2↑
△
MnO2
(2)实验室用电石制取乙炔,选用的发生装置是_______(填字母),反应生成乙炔的同时会生成一种碱,反应的化学方程式是____________________________。
B
CaC2+2H2O == Ca(OH)2+C2H2↑
(3)已知 CaCl2的水溶液呈中性。用图S1-9甲所示的装置制取 CO2及并探究性质。实验开始时,向锥形瓶中加入一定量的稀盐酸。图S1-9乙表示实验过程中装置 G 和Ⅰ中溶液的 pH 变化曲线。
①装置 H 的作用为______________________________
____________________________________;
除去HCl气体,防止影响装置Ⅰ中 pH 测定(2分)
②t1时,锥形瓶中有固体残留,无气泡产生。根据显示器 A 的曲线判断稀盐酸____________(填“不足”或“过量”);
③t1后,显示器 B 的曲线几乎无变化,其可能原因是____________(填字母)。
a.CO2的溶解已经达到饱和
b.t1时装置 G 中反应已停止,没有 CO2生成
过量
ab
20.某班同学分三个小组对酸、碱、盐的化学性质进行了探究。
(1)第一组同学为了证明稀盐酸与氢氧化钠溶液发生了反应,如图S1-10甲所示实验,传感器测定的pH和温度随溶液质量的变化情况如图S1-10乙、图S1-10丙所示。
由图S1-10乙可以判断实验中加入的B溶液是_________,写出反应的化学方程式:_________________________;图S1-10丙中的M与图S1-10乙中的X、Y、Z中的_____数值相等。
稀盐酸
HCl+NaOH == NaCl+H2O
Y
(2)第二组同学做了如图S1-11所示实验。
【提出问题】
②号试管中无色溶液的溶质是什么?
【做出猜想】猜想一:氯化钠
猜想二:____________________
猜想三:氯化钠、氢氧化钠
氯化钠、氯化氢
【反思】甲同学认为猜想三不成立,因为①②试管中溶液混合后烧杯中没有蓝色沉淀生成,乙同学则认为猜想三可以成立,理由是______________________________________________________________________________________________。
①试管中含有过量的稀盐酸,稀盐酸和氢氧化钠先反应
(3)第三组同学将一定量的澄清石灰水加入10 g 7.3%的稀盐酸中,未观察到明显现象,再向混合后的溶液中滴加溶质质量分数为5%的碳酸钠溶液,烧杯中溶液的质量与碳酸钠溶液的质量关系如图S1-12所示。
①图示信息______(填“能”或“不能”)作为稀盐酸和澄清石灰水发生反应的证据,理由是________________
________________________________
____________________;
能
ab段与10.6 g碳酸钠溶液反应消耗盐酸的质量是5 g,小于10 g
②写出bc段发生反应的化学方程式:________________________________________。
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
21.2021年6月27日我国“长征”二号运载火箭搭载“神舟”十二号载人飞船顺利升空。火箭推进剂有液氢、液氧、偏二甲肼(C2H8N2)与四氧化二氮等。
(1)其中偏二甲肼与四氧化二氮的燃烧生成二氧化碳、氧气和氮气。工业上获得氮气的方法是_____________,氮气的通常用途是______________________________
__________(写一条)。
分离液态空气
做保护气(或做冷冻剂等,合理即可)
(2)在实验室把一定质量偏二甲肼在氧气中完全燃烧,其反应化学方程式为C2H8N2+4O2 ====== 2CO2+4H2O+N2。将产生的气体依次通入浓硫酸和碱石灰(主要成分为氢氧化钠和氧化钙固体),将碱石灰增重(吸收二氧化碳)的数据绘成的曲线如图S1-13。请计算燃烧的偏二甲肼的质量。(写出计算过程)
点燃
点燃
(3)上述浓硫酸的作用是吸收燃烧产物H2O。请在图S1-13中画出浓硫酸增重的曲线。
如答图S1-2所示。
谢 谢!
同课章节目录
