第八单元金属和金属材料复习题(含答案)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第八单元金属和金属材料复习题(含答案)---2022-2023学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 215.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 13:03:04 | ||
图片预览



文档简介
第八单元金属和金属材料复习题
一、单选题
1.某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是( )
A.铝和锌 B.镁和锌 C.镁和铜 D.锌和铜
2.已知:X和Y在高温、催化剂的条件下生成Z和Q,各物质微观示意图如下:
X Y Z Q
下列说法正确的是( )
A.该反应是置换反应
B.化学变化中分子和原子均可再分
C.反应前后,各元素化合价都不变
D.若反应后生成1.8gQ,则生成Z的质量为8.4g
3.开化是浙江省硅产业基地,生产的空间用太阳能级硅单晶片广泛应用于“东方红一号”卫星、神舟号系列宇宙飞船、嫦娥一号卫星等航天航空领域,其中在生产单晶硅中主要的化学反应为:SiO2+2C=Si+2CO↑,该化学反应的基本反应类型是()
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
4.从陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如图,有关说法不正确的是
A.该反应属于置换反应 B.图甲所示物质中硅、氯元素的质量比是14∶71
C.X的化学式是HCl D.反应后硅元素的化合价升高
5.将铝、铁组成的混合物放入足量的稀硫酸中充分反应,生成氢气0.1g,则混合物的质量可能是
A.0.8g B.1.4g C.2.8g D.3.7g
6.关于金属材料的说法,正确的是
A.钢是纯净物,生铁是混合物
B.铝易氧化,因此抗腐蚀性能较差
C.武德合金的熔点比其成分金属低
D.“曾青得铁则化为铜”的原理是用铜置换出铁
7.有X、Y、Z三种金属,它们之间有如下关系:
(1)X + Y(NO3)2 = X(NO3)2 + Y
(2)Z+H2SO4=ZSO4+H2↑
(3)X与稀H2SO4不反应,则它们的金属活动性由强到弱的顺序是
A.Z>X>Y B.Y>X>Z C.X>Y>Z D.X>Z>Y
8.84 消毒液(主要成分为次氯酸钠 NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用,化学方程式可表示为:NaCl+H2ONaClO+X,下列说法正确的是
A.X 的化学式为 H2
B.反应前后只有一种元素的化合价发生改变
C.该反应为置换反应
D.84 消毒液无需稀释可直接使用
9.2021年佛山市全面推行垃圾分类,下列废弃物品可以投放到如图所示的“可回收”垃圾桶的是
A.过期的药物 B.未污染的纸 C.废弃的口罩 D.剩饭剩菜
10.下列关于金属与合金的叙述中,不正确的是
A.生铁和钢都是铁的合金
B.黄铜(铜与锌的合金)的硬度大于纯铜
C.铝比铁活泼,因此铝制品的抗腐蚀能力比铁制品差
D.在钢铁表面镀锡、镀锌、镀铬,可以防止钢铁生锈
11.下列有关物质的用途错误的是( )
A.活性炭炼铁 B.石墨作电刷
C.用不锈钢做水壶 D.钛合金做人造骨
12.下列做法与社会可持续发展理念相违背的是
A.将工业废水注入地下,治理水污染
B.回收利用易拉罐等废弃金属材料,节约资源
C.开发新能源,减少对煤、石油等化石燃料的依赖
D.倡导步行、公交等出行方式,减少温室气体排放
二、填空题
13.下图是探究燃烧条件的实验装置图,已知白磷和红磷的着火点分别是40℃、240℃。回答下列问题:
(1)该实验主要利用了薄铜片良好的___________性。
(2)由薄铜片上的白磷燃烧而红磷不燃烧的事实,说明燃烧需要的条件是___________。
(3)燃着的白磷熄灭后,观察到薄铜片上的白色固体周边的铜片表面变黑,该黑色物质是___________(填化学式)。
14.写出下列反应的化学方程式:
(1)高温煅烧石灰石________________。
(2)铁与硫酸铜溶液________________。
(3)高温下,碳与二氧化碳反应________________。
15.社会发展离不开金属,生产、生活中铝及其合金制品随处可见。
(1)易拉罐由铝合金制成,将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明______。
(2)生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是______(填字母序号)。
A.废旧电池 B.废弃口罩 C.厨余垃圾 D.废旧铁锅
(3)金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为______;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,该反应的化学方程式为______。
(4)工业上常用电解______(填物质名称)的方法制备金属铝。
16.金属是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(一)人类冶炼和使用金属铝的时间较晚。可能是因为______(填字母)。
a.地壳中铝元素含量少 b.冶炼铝的技术要求高
(二)银器在使用过程中,因为发生化学反应:,产生的Ag2S使银器渐失去光泽。已知银的化合价为+1价,则Ag2S中S的化合价为______。
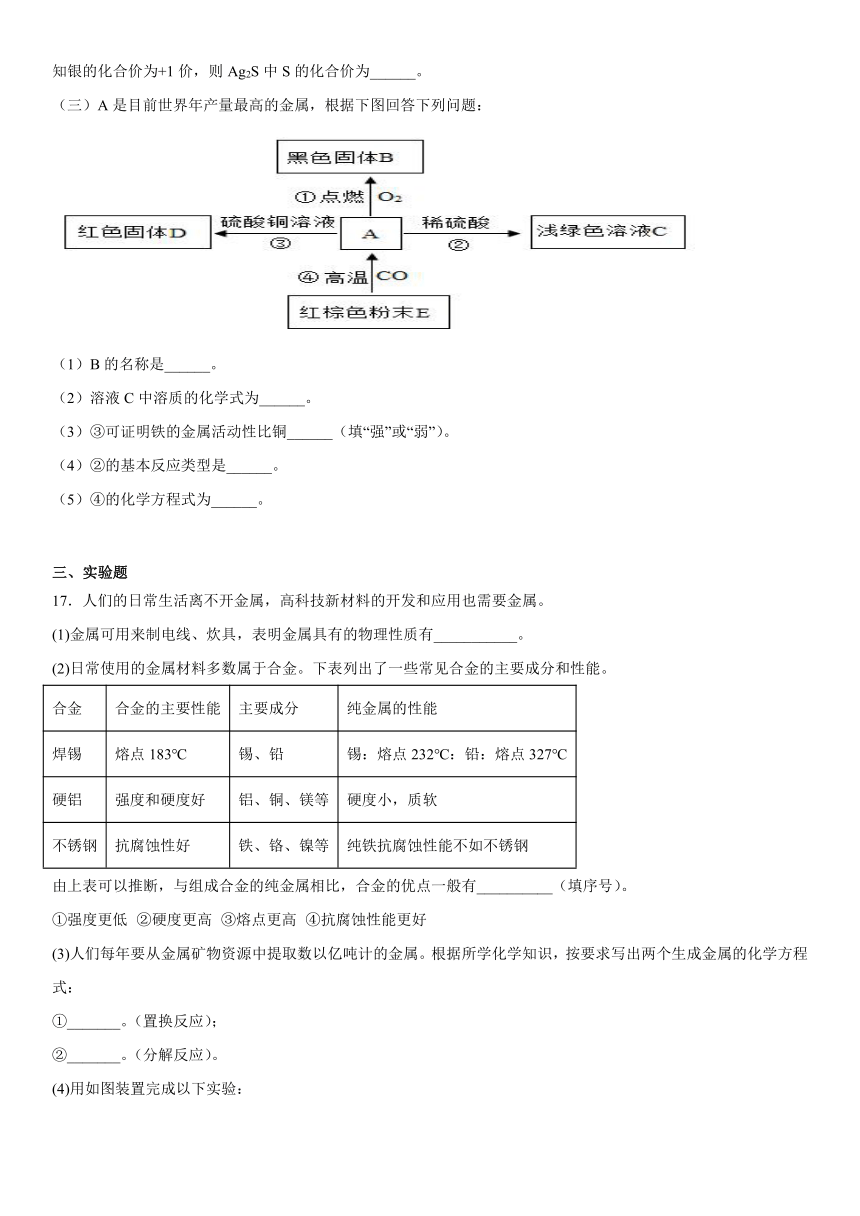
(三)A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)B的名称是______。
(2)溶液C中溶质的化学式为______。
(3)③可证明铁的金属活动性比铜______(填“强”或“弱”)。
(4)②的基本反应类型是______。
(5)④的化学方程式为______。
三、实验题
17.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)金属可用来制电线、炊具,表明金属具有的物理性质有___________。
(2)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合金 合金的主要性能 主要成分 纯金属的性能
焊锡 熔点183℃ 锡、铅 锡:熔点232℃:铅:熔点327℃
硬铝 强度和硬度好 铝、铜、镁等 硬度小,质软
不锈钢 抗腐蚀性好 铁、铬、镍等 纯铁抗腐蚀性能不如不锈钢
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有__________(填序号)。
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
(3)人们每年要从金属矿物资源中提取数以亿吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:
①_______。(置换反应);
②_______。(分解反应)。
(4)用如图装置完成以下实验:
①探究燃烧条件:若B处盛放木炭。
I.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
II.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
III.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊。
其中II与III对比,说明燃烧的条件之一是_______。C中反应的化学方程式为_______。
②模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用酒精喷灯加热,B处可观察到的现象为_______,处理尾气的方法为_______。进行实验时,为避免出现安全事故,还需要注意_______。
18.如图是化学的一些实验装置示意图,请你回答下列实验问题。
(1)A实验中待红磷熄灭并冷却到室温后,打开弹簧夹,发现进入集气瓶的水少于,可能的原因是______。(写一点即可)
(2)B实验中,发现两杯水都变红,且整杯热水变红时间比冷水要短,由此说明:______。
(3)C实验中,通过图中对比实验,说明燃烧的条件之一是______。
(4)D实验中,从实验现象可判断金属的活动性由强到弱的顺序为______。
四、推断题
19.A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)溶液C中溶质的化学式为_______。
(2)D可用于制_______。
(3)③的化学反应方程式为_______,此反应可证明铜的金属活动性比铁_______。
(4)④的化学反应方程式为_______。①的基本反应类型是_______。
20.A一F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示部分生成物已省略。
(1)物质B的化学式为______。X可能是______填化学式。
(2)反应化学反应方程式为______。
(3)反应的基本反应类型为______。
(4)反应化学反应方程式为______。
五、计算题
21.我国的冶金工业发展很早,在西汉时期,刘安所著的《淮南万毕术》中曾记载“曾青得铁则化为铜”,把铁片放入硫酸铜溶液,可以置换出铜,若用84g铁,可以制得多少克铜?(Cu-64 Fe-56 S-32. O-16)
22.“诚信”是中华民族的优良传统,但目前有不法分子将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合加热至约800℃得到一种外观酷似金子的铜锌合金,人称“伪黄金”,(其反应化学方程式为:ZnCO3+C+Cu2O高温Zn+2Cu+2CO2↑)然后加工成“黄金”饰品出售,非法牟取利益。作为当代中学生,请你利用所学知识揭露“伪黄金”的庐山真面目。
(1)列举一种鉴别真金与“伪黄金”的方法:___________________________;
(2)按以上化学方程式计算,得到的铜锌合金中铜与锌的质量比___________;
(3)按以上化学方程式计算,若得到了26.4gCO2,消耗Cu2O的质量是_____ (要求写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.D
5.B
6.C
7.A
8.A
9.B
10.C
11.A
12.A
13.(1)导热
(2)温度需要达到着火点
(3)CuO
14.
15.(1)铝合金的硬度大于纯铝的硬度
(2)D
(3) -1
(4)氧化铝/三氧化二铝
16. b -2 四氧化三铁 FeSO4 强 置换反应
17.(1)延展性、导电性、导热性
(2)②④
(3)
(4) 温度达到可燃物的着火点 红棕色粉末逐渐变成黑色 在装置末端放点燃的酒精灯 先预热,再集中加热
18.(1)红磷的量不足或装置漏气
(2)分子在不断的运动,且温度越高,分子运动越快
(3)需要可燃物
(4)Fe>Cu>Ag
19. FeSO4 作导线 弱 化合
20. Fe2O3 CuSO4 置换反应 CO2+Ca(OH)2=CaCO3↓+H2O
21.可以制得96g铜。
22. 灼烧 128:65 解:设若得到26.4gCO2消耗Cu2O的质量为x。
答:若得到26.4gCO2消耗Cu2O的质量为43.2g
一、单选题
1.某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是( )
A.铝和锌 B.镁和锌 C.镁和铜 D.锌和铜
2.已知:X和Y在高温、催化剂的条件下生成Z和Q,各物质微观示意图如下:
X Y Z Q
下列说法正确的是( )
A.该反应是置换反应
B.化学变化中分子和原子均可再分
C.反应前后,各元素化合价都不变
D.若反应后生成1.8gQ,则生成Z的质量为8.4g
3.开化是浙江省硅产业基地,生产的空间用太阳能级硅单晶片广泛应用于“东方红一号”卫星、神舟号系列宇宙飞船、嫦娥一号卫星等航天航空领域,其中在生产单晶硅中主要的化学反应为:SiO2+2C=Si+2CO↑,该化学反应的基本反应类型是()
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
4.从陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如图,有关说法不正确的是
A.该反应属于置换反应 B.图甲所示物质中硅、氯元素的质量比是14∶71
C.X的化学式是HCl D.反应后硅元素的化合价升高
5.将铝、铁组成的混合物放入足量的稀硫酸中充分反应,生成氢气0.1g,则混合物的质量可能是
A.0.8g B.1.4g C.2.8g D.3.7g
6.关于金属材料的说法,正确的是
A.钢是纯净物,生铁是混合物
B.铝易氧化,因此抗腐蚀性能较差
C.武德合金的熔点比其成分金属低
D.“曾青得铁则化为铜”的原理是用铜置换出铁
7.有X、Y、Z三种金属,它们之间有如下关系:
(1)X + Y(NO3)2 = X(NO3)2 + Y
(2)Z+H2SO4=ZSO4+H2↑
(3)X与稀H2SO4不反应,则它们的金属活动性由强到弱的顺序是
A.Z>X>Y B.Y>X>Z C.X>Y>Z D.X>Z>Y
8.84 消毒液(主要成分为次氯酸钠 NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用,化学方程式可表示为:NaCl+H2ONaClO+X,下列说法正确的是
A.X 的化学式为 H2
B.反应前后只有一种元素的化合价发生改变
C.该反应为置换反应
D.84 消毒液无需稀释可直接使用
9.2021年佛山市全面推行垃圾分类,下列废弃物品可以投放到如图所示的“可回收”垃圾桶的是
A.过期的药物 B.未污染的纸 C.废弃的口罩 D.剩饭剩菜
10.下列关于金属与合金的叙述中,不正确的是
A.生铁和钢都是铁的合金
B.黄铜(铜与锌的合金)的硬度大于纯铜
C.铝比铁活泼,因此铝制品的抗腐蚀能力比铁制品差
D.在钢铁表面镀锡、镀锌、镀铬,可以防止钢铁生锈
11.下列有关物质的用途错误的是( )
A.活性炭炼铁 B.石墨作电刷
C.用不锈钢做水壶 D.钛合金做人造骨
12.下列做法与社会可持续发展理念相违背的是
A.将工业废水注入地下,治理水污染
B.回收利用易拉罐等废弃金属材料,节约资源
C.开发新能源,减少对煤、石油等化石燃料的依赖
D.倡导步行、公交等出行方式,减少温室气体排放
二、填空题
13.下图是探究燃烧条件的实验装置图,已知白磷和红磷的着火点分别是40℃、240℃。回答下列问题:
(1)该实验主要利用了薄铜片良好的___________性。
(2)由薄铜片上的白磷燃烧而红磷不燃烧的事实,说明燃烧需要的条件是___________。
(3)燃着的白磷熄灭后,观察到薄铜片上的白色固体周边的铜片表面变黑,该黑色物质是___________(填化学式)。
14.写出下列反应的化学方程式:
(1)高温煅烧石灰石________________。
(2)铁与硫酸铜溶液________________。
(3)高温下,碳与二氧化碳反应________________。
15.社会发展离不开金属,生产、生活中铝及其合金制品随处可见。
(1)易拉罐由铝合金制成,将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明______。
(2)生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是______(填字母序号)。
A.废旧电池 B.废弃口罩 C.厨余垃圾 D.废旧铁锅
(3)金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为______;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,该反应的化学方程式为______。
(4)工业上常用电解______(填物质名称)的方法制备金属铝。
16.金属是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(一)人类冶炼和使用金属铝的时间较晚。可能是因为______(填字母)。
a.地壳中铝元素含量少 b.冶炼铝的技术要求高
(二)银器在使用过程中,因为发生化学反应:,产生的Ag2S使银器渐失去光泽。已知银的化合价为+1价,则Ag2S中S的化合价为______。
(三)A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)B的名称是______。
(2)溶液C中溶质的化学式为______。
(3)③可证明铁的金属活动性比铜______(填“强”或“弱”)。
(4)②的基本反应类型是______。
(5)④的化学方程式为______。
三、实验题
17.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)金属可用来制电线、炊具,表明金属具有的物理性质有___________。
(2)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合金 合金的主要性能 主要成分 纯金属的性能
焊锡 熔点183℃ 锡、铅 锡:熔点232℃:铅:熔点327℃
硬铝 强度和硬度好 铝、铜、镁等 硬度小,质软
不锈钢 抗腐蚀性好 铁、铬、镍等 纯铁抗腐蚀性能不如不锈钢
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有__________(填序号)。
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
(3)人们每年要从金属矿物资源中提取数以亿吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:
①_______。(置换反应);
②_______。(分解反应)。
(4)用如图装置完成以下实验:
①探究燃烧条件:若B处盛放木炭。
I.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
II.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
III.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊。
其中II与III对比,说明燃烧的条件之一是_______。C中反应的化学方程式为_______。
②模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用酒精喷灯加热,B处可观察到的现象为_______,处理尾气的方法为_______。进行实验时,为避免出现安全事故,还需要注意_______。
18.如图是化学的一些实验装置示意图,请你回答下列实验问题。
(1)A实验中待红磷熄灭并冷却到室温后,打开弹簧夹,发现进入集气瓶的水少于,可能的原因是______。(写一点即可)
(2)B实验中,发现两杯水都变红,且整杯热水变红时间比冷水要短,由此说明:______。
(3)C实验中,通过图中对比实验,说明燃烧的条件之一是______。
(4)D实验中,从实验现象可判断金属的活动性由强到弱的顺序为______。
四、推断题
19.A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)溶液C中溶质的化学式为_______。
(2)D可用于制_______。
(3)③的化学反应方程式为_______,此反应可证明铜的金属活动性比铁_______。
(4)④的化学反应方程式为_______。①的基本反应类型是_______。
20.A一F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示部分生成物已省略。
(1)物质B的化学式为______。X可能是______填化学式。
(2)反应化学反应方程式为______。
(3)反应的基本反应类型为______。
(4)反应化学反应方程式为______。
五、计算题
21.我国的冶金工业发展很早,在西汉时期,刘安所著的《淮南万毕术》中曾记载“曾青得铁则化为铜”,把铁片放入硫酸铜溶液,可以置换出铜,若用84g铁,可以制得多少克铜?(Cu-64 Fe-56 S-32. O-16)
22.“诚信”是中华民族的优良传统,但目前有不法分子将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合加热至约800℃得到一种外观酷似金子的铜锌合金,人称“伪黄金”,(其反应化学方程式为:ZnCO3+C+Cu2O高温Zn+2Cu+2CO2↑)然后加工成“黄金”饰品出售,非法牟取利益。作为当代中学生,请你利用所学知识揭露“伪黄金”的庐山真面目。
(1)列举一种鉴别真金与“伪黄金”的方法:___________________________;
(2)按以上化学方程式计算,得到的铜锌合金中铜与锌的质量比___________;
(3)按以上化学方程式计算,若得到了26.4gCO2,消耗Cu2O的质量是_____ (要求写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.D
5.B
6.C
7.A
8.A
9.B
10.C
11.A
12.A
13.(1)导热
(2)温度需要达到着火点
(3)CuO
14.
15.(1)铝合金的硬度大于纯铝的硬度
(2)D
(3) -1
(4)氧化铝/三氧化二铝
16. b -2 四氧化三铁 FeSO4 强 置换反应
17.(1)延展性、导电性、导热性
(2)②④
(3)
(4) 温度达到可燃物的着火点 红棕色粉末逐渐变成黑色 在装置末端放点燃的酒精灯 先预热,再集中加热
18.(1)红磷的量不足或装置漏气
(2)分子在不断的运动,且温度越高,分子运动越快
(3)需要可燃物
(4)Fe>Cu>Ag
19. FeSO4 作导线 弱 化合
20. Fe2O3 CuSO4 置换反应 CO2+Ca(OH)2=CaCO3↓+H2O
21.可以制得96g铜。
22. 灼烧 128:65 解:设若得到26.4gCO2消耗Cu2O的质量为x。
答:若得到26.4gCO2消耗Cu2O的质量为43.2g
同课章节目录
