第1章 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用 课件(共32张PPT)高中化学鲁科版选择性必修1
文档属性
| 名称 | 第1章 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用 课件(共32张PPT)高中化学鲁科版选择性必修1 |
|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
设计载人航天器用化学电池与氧气再生方案
——化学反应中能量及物质的转化利用
微项目
高中化学 鲁科版选择性必修1
1.通过探究载人航天器用化学电池与氧气再生方案,尝试利用原电池原理及焓
变、盖斯定律等知识,分析、评价真实环境下化学反应中的能量转化与物质
转化问题,并形成电源选择和氧气再生的基本思路。
2.通过分析载人航天器上的电源,了解真实化学电池的工作原理与装置结构,
并形成分析化学电池的一般思路。
3.通过本项目的学习,感受化学知识在解决实际问题中的应用价值。
[学习目标]
尝试设计载人航天器用化学电池
导学
1.尝试设计载人航天器用化学电池
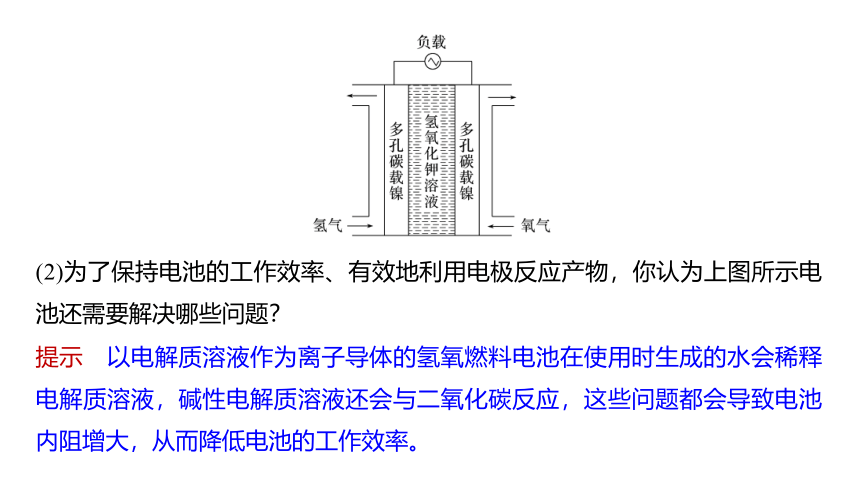
(1)小组讨论:如图是“阿波罗”飞船中使用的氢氧燃料电池部分结构的示意图。请将该电池和你在本章第2节中设计的氢氧燃料电池进行比较、说明异同,并结合资料尝试解释“阿波罗”飞船使用的氢氧燃料电池中各部分材料选择的理由。
提示 二者不同之处在于“阿波罗”飞船使用的氢氧燃料电池为多孔碳载镍电极,而我们设计的氢氧燃料电池为石墨电极;镍对燃料电池反应有催化作用。
(2)为了保持电池的工作效率、有效地利用电极反应产物,你认为上图所示电池还需要解决哪些问题?
提示 以电解质溶液作为离子导体的氢氧燃料电池在使用时生成的水会稀释电解质溶液,碱性电解质溶液还会与二氧化碳反应,这些问题都会导致电池内阻增大,从而降低电池的工作效率。
(3)如果你是电池设计人员,你会提出哪些思路或方案来解决以上问题?
提示 要解决以上问题,在设计电池时,可以附设电解质溶液循环系统,这样既便于浓缩电解质溶液或补充电解质,又便于更换已污染的电解质溶液;也可以更换离子导体,如使用酸性电解质溶液作为离子导体,避免电解质与二氧化碳反应,或采用固体材料离子导体,避免电解质被生成的水稀释,同时将生成的水冷凝回收再利用。
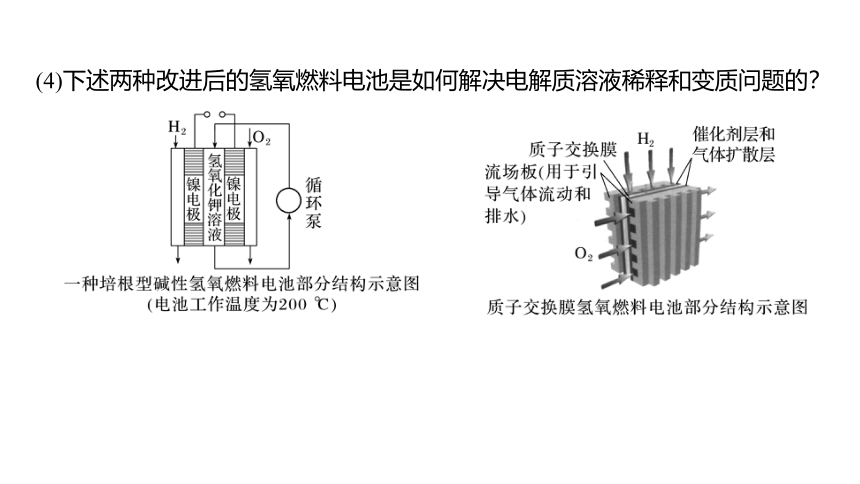
(4)下述两种改进后的氢氧燃料电池是如何解决电解质溶液稀释和变质问题的?
提示 培根型碱性氢氧燃料电池主要通过外加循环设备的方式解决电解质溶液稀释和变质的问题。由于电池工作温度较高,生成的水主要以气态形式存在,水蒸气可以由气态反应物带出并在出口冷凝。电解质循环泵使燃料电池的电解质溶液不断浓缩、循环;如果电解质已变质,可以很方便地更换新溶液。质子交换膜氢氧燃料电池则通过使用质子交换膜作为离子导体,从根本上解决了电解质溶液的稀释和变质问题。
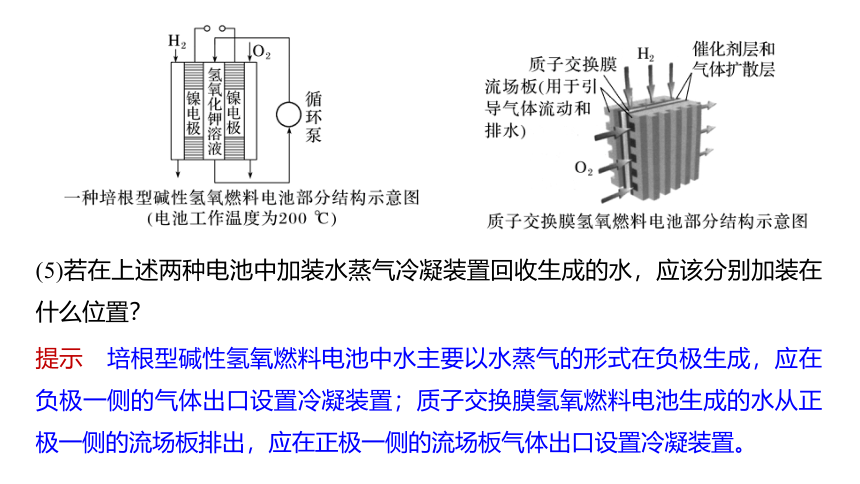
(5)若在上述两种电池中加装水蒸气冷凝装置回收生成的水,应该分别加装在什么位置?
提示 培根型碱性氢氧燃料电池中水主要以水蒸气的形式在负极生成,应在负极一侧的气体出口设置冷凝装置;质子交换膜氢氧燃料电池生成的水从正极一侧的流场板排出,应在正极一侧的流场板气体出口设置冷凝装置。
2.“阿波罗”飞船燃料电池的工作原理
(1)“阿波罗”飞船燃料电池(离子导体为KOH溶液)的电极反应为
负极:2H2+4OH--4e-===4H2O;
正极:O2+2H2O+4e-===4OH-。
(2)“阿波罗”登月飞船一代燃料电池(离子导体为H2SO4溶液)的电极反应为
负极:2H2-4e-===4H+;
正极:O2+4H++4e-===2H2O。
3.“神舟”飞船中镍镉碱性蓄电池反应原理
(1)当飞船进入光照区时,太阳能电池为用电设备供电,同时为镍镉电池充电,镍镉电池的电极反应为
阴极:Cd(OH)2+2e-===Cd+2OH-;
阳极:2Ni(OH)2+2OH--2e-===2NiOOH+2H2O。
(2)当飞船进入阴影区时,由镍镉电池提供电能,电极反应为
负极:Cd+2OH--2e-===Cd(OH)2;
正极:2NiOOH+2H2O+2e-===2Ni(OH)2+2OH-。
尝试设计载人航天器的氧气再生方案
1.根据以下信息回答问题:
导学
Ⅱ.CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802.3 kJ·mol-1
②萨巴蒂尔反应为
利用萨巴蒂尔反应再生氧气的大体流程如图所示:
萨巴蒂尔反应在300~400 ℃时转化率较高,显然控制反应器内的温度非常重要。要设计控制反应器内温度的方案,需要知道该反应的热效应。在该条件下,副反应比较多,测定萨巴蒂尔反应的热效应困难较大,我们可以通过理论计算来了解该反应的热效应。
(1)请计算萨巴蒂尔反应的焓变,并考虑如何控制反应器内的温度?
提示 根据盖斯定律,将4×Ⅰ-Ⅱ得:CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.9 kJ·mol-1,则萨巴蒂尔反应是放热反应(ΔH<0)。为保证转化率、控制反应器内温度,一般会将进入反应器的气体提前加热至反应温度。同时,反应器配有冷却装置,以便及时将过多的反应热传走。冷却装置传走的热量,以及从反应器出来的气体带走的热量还可以继续利用。
(2)请分析萨巴蒂尔反应有什么缺点?
提示 萨巴蒂尔反应有一个明显的缺陷,即有50%的氢元素存在于甲烷中而没有得到利用。
2.探究载人航天器电源配置与氧气再生的一般思路
3.载人航天器中能量转化形式
1
2
3
1.下列我国科技创新的产品设备在工作时,由化学能转变成电能的是
4
5
A.长征三号乙运载火箭用偏二甲肼为燃料 B.嫦娥四号月球探测器上的太阳能电池板 C.和谐号动车以350 km·h-1飞驰 D.世界首部可折叠柔屏手机通话
√
6
自我测试
1
2
3
燃料发动机能将化学能转变为动能,故A错误;
太阳能电池板将太阳能转变为电能,故B错误;
和谐号动车将电能转变为动能,故C错误;
世界首部可折叠柔屏手机通话是原电池的应用,是将化学能转变为电能,实现了能量之间的转化,故D正确。
4
5
6
自我测试
1
2
3
2.中国研究人员研制出一种新型复合光催化剂,在航天器中利用太阳光在催化剂表面实现高效分解水,实现氧气的再生。主要过程如图所示:
4
5
下列说法不正确的是
A.整个过程实现了光能向化学能的转化
B.过程Ⅱ放出能量并生成了O—O键
D.过程Ⅲ不是氧化还原反应
√
6
自我测试
1
2
3
4
5
由图示可知,利用太阳光在催化剂表面实现了水分解为氢气和氧气,光能转化为化学能,故A正确;
过程Ⅱ中生成了O—O键,释放能量,故B正确;
该过程的总反应是水分解为氢气和氧气,故C正确;
由图可知,过程Ⅲ中H2O2转化为氢气和氧气,属于氧化还原反应,故D错误。
6
自我测试
1
2
3
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
4
5
√
6
自我测试
1
2
3
4
5
通氧气的一极得到电子,所以通氧气的电极为正极,A错误;
氢氧根离子参加反应而且生成水,所以氢氧化钾的物质的量浓度减小,C错误;
电解质溶液中阴离子向负极迁移,阳离子向正极迁移,D错误。
6
自我测试
1
2
3
4.光电池在光照条件下可产生电压,如图所示装置可以实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+、OH-的定向通过。下列说法错误的是
4
5
A.该装置将光能最终转化为化学能并分解水
B.双极膜可控制其两侧溶液分别呈酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应为2V2++2H2O===2V3++2OH-+H2↑
√
6
自我测试
1
2
3
4
5
在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,由题图可知,电解过程中的总反应是2H2O 2H2↑+O2↑,A项正确;
双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+、OH-的定向通过,故双极膜可控制其两侧溶液分别呈酸性和碱性,B正确;
右侧电极反应式为4OH--4e-===O2↑+2H2O,根据溶液呈电中性可知阳极放电消耗的OH-与从双极膜中进入右侧的OH-数目相等,C项正确;
放电后溶液中含有V2+和H+,在催化剂作用下H+将V2+氧化为V3+,从而实现V3+的再生,即发生反应:2V2++2H+ 2V3++H2↑,D项错误。
6
自我测试
1
2
3
5.有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应式为O2+4e-===2O2-
C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑
D.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷
4
5
√
6
自我测试
√
1
2
3
4
5
在熔融电解质中,没有水溶液,阴离子O2-由正极移向负极,A错误;
通入丁烷的一极为负极,通入空气的一极是正极,正极电极反应式为O2+4e-===2O2-,B正确;
在电解池中,电解Na2SO4溶液即电解水,阳极发生氧化反应即OH-失电子,阳极反应式为4OH--4e-===2H2O+O2↑,C正确;
电解一共生成H2和O2合计0.9 mol气体,其中氢气是0.6 mol,氧气是0.3 mol,转移电子的物质的量是0.6 mol×2=1.2 mol,1 mol丁烷失去26 mol电子,则需丁烷 mol≠0.1 mol,D错误。
6
自我测试
1
2
3
6.神舟系列载人航天器的成功登天标志着我国的航天事业进入了新的篇章。
(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为________________________。
如果某段时间内氢氧储罐中共收集到33.6 L(已折算成标准状况)气体,则该段时间内水电解系统中转移电子的物质的量为___ mol。
4
5
H2-2e-+2OH-===2H2O
2
6
自我测试
1
2
3
4
5
6
自我测试
(2)在载人航天器的生态系统中,不仅要求分离出CO2,还要求提供充足的O2。某种电化学装置可实现转化2CO2===2CO+O2,CO可用作燃料。已知该反应的阳极反应式为4OH--4e-===O2+2H2O,则阴极反应式为_______________
_______________。
由题意可知,该装置为电解池,碱性条件下,阴极上二氧化碳得电子发生还原反应生成CO,电极反应式为CO2+2e-+H2O===CO+2OH-。
CO2+2e-+H2O
===CO+2OH-
1
2
3
4
5
6
自我测试
设计载人航天器用化学电池与氧气再生方案
——化学反应中能量及物质的转化利用
微项目
高中化学 鲁科版选择性必修1
1.通过探究载人航天器用化学电池与氧气再生方案,尝试利用原电池原理及焓
变、盖斯定律等知识,分析、评价真实环境下化学反应中的能量转化与物质
转化问题,并形成电源选择和氧气再生的基本思路。
2.通过分析载人航天器上的电源,了解真实化学电池的工作原理与装置结构,
并形成分析化学电池的一般思路。
3.通过本项目的学习,感受化学知识在解决实际问题中的应用价值。
[学习目标]
尝试设计载人航天器用化学电池
导学
1.尝试设计载人航天器用化学电池
(1)小组讨论:如图是“阿波罗”飞船中使用的氢氧燃料电池部分结构的示意图。请将该电池和你在本章第2节中设计的氢氧燃料电池进行比较、说明异同,并结合资料尝试解释“阿波罗”飞船使用的氢氧燃料电池中各部分材料选择的理由。
提示 二者不同之处在于“阿波罗”飞船使用的氢氧燃料电池为多孔碳载镍电极,而我们设计的氢氧燃料电池为石墨电极;镍对燃料电池反应有催化作用。
(2)为了保持电池的工作效率、有效地利用电极反应产物,你认为上图所示电池还需要解决哪些问题?
提示 以电解质溶液作为离子导体的氢氧燃料电池在使用时生成的水会稀释电解质溶液,碱性电解质溶液还会与二氧化碳反应,这些问题都会导致电池内阻增大,从而降低电池的工作效率。
(3)如果你是电池设计人员,你会提出哪些思路或方案来解决以上问题?
提示 要解决以上问题,在设计电池时,可以附设电解质溶液循环系统,这样既便于浓缩电解质溶液或补充电解质,又便于更换已污染的电解质溶液;也可以更换离子导体,如使用酸性电解质溶液作为离子导体,避免电解质与二氧化碳反应,或采用固体材料离子导体,避免电解质被生成的水稀释,同时将生成的水冷凝回收再利用。
(4)下述两种改进后的氢氧燃料电池是如何解决电解质溶液稀释和变质问题的?
提示 培根型碱性氢氧燃料电池主要通过外加循环设备的方式解决电解质溶液稀释和变质的问题。由于电池工作温度较高,生成的水主要以气态形式存在,水蒸气可以由气态反应物带出并在出口冷凝。电解质循环泵使燃料电池的电解质溶液不断浓缩、循环;如果电解质已变质,可以很方便地更换新溶液。质子交换膜氢氧燃料电池则通过使用质子交换膜作为离子导体,从根本上解决了电解质溶液的稀释和变质问题。
(5)若在上述两种电池中加装水蒸气冷凝装置回收生成的水,应该分别加装在什么位置?
提示 培根型碱性氢氧燃料电池中水主要以水蒸气的形式在负极生成,应在负极一侧的气体出口设置冷凝装置;质子交换膜氢氧燃料电池生成的水从正极一侧的流场板排出,应在正极一侧的流场板气体出口设置冷凝装置。
2.“阿波罗”飞船燃料电池的工作原理
(1)“阿波罗”飞船燃料电池(离子导体为KOH溶液)的电极反应为
负极:2H2+4OH--4e-===4H2O;
正极:O2+2H2O+4e-===4OH-。
(2)“阿波罗”登月飞船一代燃料电池(离子导体为H2SO4溶液)的电极反应为
负极:2H2-4e-===4H+;
正极:O2+4H++4e-===2H2O。
3.“神舟”飞船中镍镉碱性蓄电池反应原理
(1)当飞船进入光照区时,太阳能电池为用电设备供电,同时为镍镉电池充电,镍镉电池的电极反应为
阴极:Cd(OH)2+2e-===Cd+2OH-;
阳极:2Ni(OH)2+2OH--2e-===2NiOOH+2H2O。
(2)当飞船进入阴影区时,由镍镉电池提供电能,电极反应为
负极:Cd+2OH--2e-===Cd(OH)2;
正极:2NiOOH+2H2O+2e-===2Ni(OH)2+2OH-。
尝试设计载人航天器的氧气再生方案
1.根据以下信息回答问题:
导学
Ⅱ.CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802.3 kJ·mol-1
②萨巴蒂尔反应为
利用萨巴蒂尔反应再生氧气的大体流程如图所示:
萨巴蒂尔反应在300~400 ℃时转化率较高,显然控制反应器内的温度非常重要。要设计控制反应器内温度的方案,需要知道该反应的热效应。在该条件下,副反应比较多,测定萨巴蒂尔反应的热效应困难较大,我们可以通过理论计算来了解该反应的热效应。
(1)请计算萨巴蒂尔反应的焓变,并考虑如何控制反应器内的温度?
提示 根据盖斯定律,将4×Ⅰ-Ⅱ得:CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.9 kJ·mol-1,则萨巴蒂尔反应是放热反应(ΔH<0)。为保证转化率、控制反应器内温度,一般会将进入反应器的气体提前加热至反应温度。同时,反应器配有冷却装置,以便及时将过多的反应热传走。冷却装置传走的热量,以及从反应器出来的气体带走的热量还可以继续利用。
(2)请分析萨巴蒂尔反应有什么缺点?
提示 萨巴蒂尔反应有一个明显的缺陷,即有50%的氢元素存在于甲烷中而没有得到利用。
2.探究载人航天器电源配置与氧气再生的一般思路
3.载人航天器中能量转化形式
1
2
3
1.下列我国科技创新的产品设备在工作时,由化学能转变成电能的是
4
5
A.长征三号乙运载火箭用偏二甲肼为燃料 B.嫦娥四号月球探测器上的太阳能电池板 C.和谐号动车以350 km·h-1飞驰 D.世界首部可折叠柔屏手机通话
√
6
自我测试
1
2
3
燃料发动机能将化学能转变为动能,故A错误;
太阳能电池板将太阳能转变为电能,故B错误;
和谐号动车将电能转变为动能,故C错误;
世界首部可折叠柔屏手机通话是原电池的应用,是将化学能转变为电能,实现了能量之间的转化,故D正确。
4
5
6
自我测试
1
2
3
2.中国研究人员研制出一种新型复合光催化剂,在航天器中利用太阳光在催化剂表面实现高效分解水,实现氧气的再生。主要过程如图所示:
4
5
下列说法不正确的是
A.整个过程实现了光能向化学能的转化
B.过程Ⅱ放出能量并生成了O—O键
D.过程Ⅲ不是氧化还原反应
√
6
自我测试
1
2
3
4
5
由图示可知,利用太阳光在催化剂表面实现了水分解为氢气和氧气,光能转化为化学能,故A正确;
过程Ⅱ中生成了O—O键,释放能量,故B正确;
该过程的总反应是水分解为氢气和氧气,故C正确;
由图可知,过程Ⅲ中H2O2转化为氢气和氧气,属于氧化还原反应,故D错误。
6
自我测试
1
2
3
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
4
5
√
6
自我测试
1
2
3
4
5
通氧气的一极得到电子,所以通氧气的电极为正极,A错误;
氢氧根离子参加反应而且生成水,所以氢氧化钾的物质的量浓度减小,C错误;
电解质溶液中阴离子向负极迁移,阳离子向正极迁移,D错误。
6
自我测试
1
2
3
4.光电池在光照条件下可产生电压,如图所示装置可以实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+、OH-的定向通过。下列说法错误的是
4
5
A.该装置将光能最终转化为化学能并分解水
B.双极膜可控制其两侧溶液分别呈酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应为2V2++2H2O===2V3++2OH-+H2↑
√
6
自我测试
1
2
3
4
5
在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,由题图可知,电解过程中的总反应是2H2O 2H2↑+O2↑,A项正确;
双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+、OH-的定向通过,故双极膜可控制其两侧溶液分别呈酸性和碱性,B正确;
右侧电极反应式为4OH--4e-===O2↑+2H2O,根据溶液呈电中性可知阳极放电消耗的OH-与从双极膜中进入右侧的OH-数目相等,C项正确;
放电后溶液中含有V2+和H+,在催化剂作用下H+将V2+氧化为V3+,从而实现V3+的再生,即发生反应:2V2++2H+ 2V3++H2↑,D项错误。
6
自我测试
1
2
3
5.有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应式为O2+4e-===2O2-
C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑
D.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷
4
5
√
6
自我测试
√
1
2
3
4
5
在熔融电解质中,没有水溶液,阴离子O2-由正极移向负极,A错误;
通入丁烷的一极为负极,通入空气的一极是正极,正极电极反应式为O2+4e-===2O2-,B正确;
在电解池中,电解Na2SO4溶液即电解水,阳极发生氧化反应即OH-失电子,阳极反应式为4OH--4e-===2H2O+O2↑,C正确;
电解一共生成H2和O2合计0.9 mol气体,其中氢气是0.6 mol,氧气是0.3 mol,转移电子的物质的量是0.6 mol×2=1.2 mol,1 mol丁烷失去26 mol电子,则需丁烷 mol≠0.1 mol,D错误。
6
自我测试
1
2
3
6.神舟系列载人航天器的成功登天标志着我国的航天事业进入了新的篇章。
(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为________________________。
如果某段时间内氢氧储罐中共收集到33.6 L(已折算成标准状况)气体,则该段时间内水电解系统中转移电子的物质的量为___ mol。
4
5
H2-2e-+2OH-===2H2O
2
6
自我测试
1
2
3
4
5
6
自我测试
(2)在载人航天器的生态系统中,不仅要求分离出CO2,还要求提供充足的O2。某种电化学装置可实现转化2CO2===2CO+O2,CO可用作燃料。已知该反应的阳极反应式为4OH--4e-===O2+2H2O,则阴极反应式为_______________
_______________。
由题意可知,该装置为电解池,碱性条件下,阴极上二氧化碳得电子发生还原反应生成CO,电极反应式为CO2+2e-+H2O===CO+2OH-。
CO2+2e-+H2O
===CO+2OH-
1
2
3
4
5
6
自我测试
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
