第2章 第2节 第5课时 平衡常数的应用及计算、平衡转化率的分析 课件(共33张PPT)-高中化学鲁科版选择性必修1
文档属性
| 名称 | 第2章 第2节 第5课时 平衡常数的应用及计算、平衡转化率的分析 课件(共33张PPT)-高中化学鲁科版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 00:00:00 | ||
图片预览











文档简介
(共33张PPT)
平衡常数的应用及计算、平衡转化率的分析
第5课时
高中化学 鲁科版选择性必修1
1.依据平衡常数分析热效应。
2.依据K与Q判断反应进行的方向。
3.平衡转化率的分析。
4.压强平衡常数(Kp)的计算及应用。
1.压强平衡常数(Kp)的应用及计算。
2.平衡转化率的分析。
[学习目标]
[重点难点]
化学平衡常数的应用及计算
导学
1.化学平衡常数的应用
2.多重平衡体系中化学平衡常数计算
(1)多重平衡体系:一个化学反应体系中存在多个化学反应,在一定条件下,这些反应都可以达到平衡状态,这种现象称作多重平衡现象,该体系称作多重平衡体系。
(2)多重平衡反应类型
①连续型(耦合)反应:某物质是某反应的反应产物,同时又是其他反应的反应物。
②平行型(竞争型)反应:某物质同时是多个反应的反应物。
(3)多重平衡体系中有关平衡常数的计算,各组分的平衡量指的是整个平衡体系中的量,而不是指某一单一反应中的量。
导练
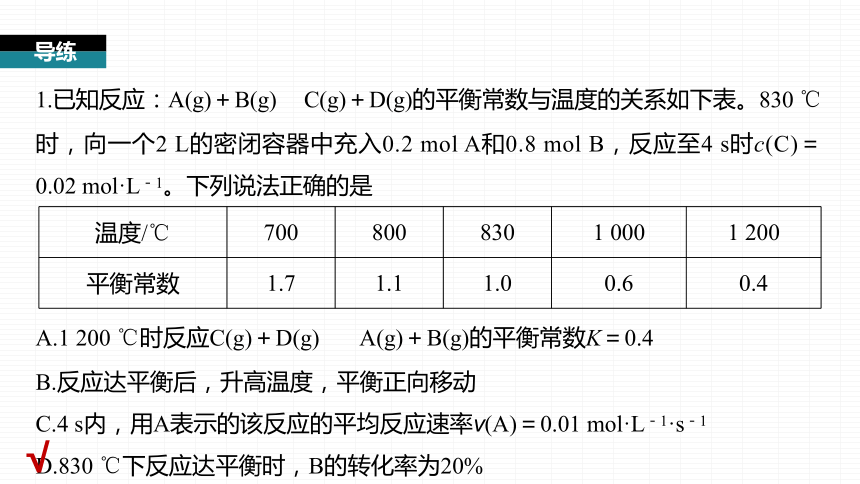
1.已知反应:A(g)+B(g) C(g)+D(g)的平衡常数与温度的关系如下表。830 ℃时,向一个2 L的密闭容器中充入0.2 mol A和0.8 mol B,反应至4 s时c(C)=0.02 mol·L-1。下列说法正确的是
温度/℃ 700 800 830 1 000 1 200
平衡常数 1.7 1.1 1.0 0.6 0.4
A.1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数K=0.4
B.反应达平衡后,升高温度,平衡正向移动
C.4 s内,用A表示的该反应的平均反应速率v(A)=0.01 mol·L-1·s-1
D.830 ℃下反应达平衡时,B的转化率为20%
√
随温度升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,B错误;
2.加热N2O5依次发生的分解反应为
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则t ℃时反应①的平衡常数为
A.10.7 mol·L-1 B.8.5 mol·L-1
C.9.6 mol·L-1 D.10.2 mol·L-1
√
压强平衡常数(Kp)及其应用
1.分压
(1)定义:相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同体积时,该气体B所具有的压强,称为气体B的分压强。
(2)计算公式:
混合气体中某组分的分压=总压×该组分的物质的量分数,pB=p总× 。
(3)分压定律:混合气体的总压等于相同温度下各组分气体的分压之和,即p总=pA+pB+pC+…
导学
2.压强平衡常数
3.压强平衡常数计算技巧
第一步,根据三段式法计算平衡体系中各物质的物质的量或物质的量浓度。
第二步,计算各气体组分的物质的量分数或体积分数。
第三步,根据分压计算公式求出各气体物质的分压。
1.[2020·全国卷Ⅱ,28(1)③改编]乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH=+137 kJ·mol-1,容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡
常数Kp的数值为______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
导练
设起始时加入的乙烷和氢气各为1 mol,列出三段式,
C2H6(g) C2H4(g)+H2(g)
起始/mol 1 0 1
转化/mol α α α
平衡/mol 1-α α 1+α
2.环戊二烯是生产精细化工产品的重要中间体,其制备反应为
ΔH>0
该反应在刚性容器中进行。实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为100 kPa的双环戊二烯和水蒸气,达到平衡后总压为160 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=______kPa(Kp为用分压表示的平衡常数)。
25
960
ΔH>0
平衡转化率的分析
导学
1.当可逆反应达到平衡后,反应物的初始浓度不变,只改变体系的温度、压强或减小反应产物的量使平衡正向移动,这时反应物的转化率一定增大。
2.反应物用量的改变对转化率的影响
(1)若反应物是一种且为气体,如:aA(g) bB(g)+cC(g)。在恒温恒容条件下,增加A的浓度,平衡正向移动,但A的转化率分析等效为压强对平衡的影响。
气体计量数关系 A的转化率
a=b+c 不变
a>b+c 增大
a(2)若反应物不只一种,如:aA(g)+bB(g) cC(g)+dD(g)。
①在其他条件不变时,增加A的量,平衡正向移动,A的转化率降低,B的转化率升高。
②若起始按化学计量数之比投入A、B,则A、B的转化率一定相同。
③在恒温恒容条件下,若按原比例(投料比)同倍数增加A和B,平衡正向移动,但反应物(A或B)的转化率等效为压强对平衡的影响。此时可虚拟一个路径来理解转化率的变化。如:
导练
1.反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
A.增大容器容积
B.降低反应温度
C.分离出部分氢气
D.等容下通入惰性气体
√
√
该反应的正反应是气体体积增大的反应,增大反应容器的容积,体系的压强减小,化学平衡正向移动,能提高乙烷的平衡转化率,A项不符合题意;
分离出部分氢气,减少了反应产物浓度,平衡正向移动,可提高乙烷的平衡转化率,C项不符合题意;
等容下通入惰性气体,体系的总压强增大,物质的浓度不变,因此化学平衡不移动,对乙烷的平衡转化率无影响,D项符合题意。
2.(1)可逆反应2SO2(g)+O2(g) 2SO3(g),在一定条件下达到平衡后,只增大O2的浓度,平衡_____移动,则SO2的转化率______,O2的转化率______。
(2)某温度下,在2 L的密闭容器中,加入3 mol X(g)和1 mol Y(g),发生反应:3X(g)+Y(g) 2Z(g)+2R(g) ΔH<0。平衡时,X、Y、Z、R的体积分数分别为60%、20%、10%、10%。X与Y的转化率之比为______。
正向
增大
减小
1∶1
(3)两个体积相同的密闭容器A、B,在A中充入SO2和O2各1 mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应:2SO2(g)+O2(g) 2SO3(g),对此反应的表述不正确的是____(填字母)。
A.反应速率:B>A
B.SO2 的转化率:B>A
C.平衡时各组分含量:B=A
D.平衡时容器的压强:B>A
C
A项,两容器的体积相同,B中SO2、O2物质的量浓度都是A中的两倍,在相同条件下反应物浓度越大反应速率越快,反应速率:B>A,正确;
B项,要将A、B两容器平衡时的物理量进行比较,可建立如下模型:①另取一个2倍体积的容器,充入SO2、O2各2 mol,则在相同条件下,该容器达平衡时SO2的转化率、平衡时各组分含量、平衡时的压强与A中对应相等;②B相当于在该容器的基础上将体积缩小一半,即增大压强,平衡正向移动,反应物的转化率增大,SO2的转化率:B>A,正确;
C项,由于平衡正向移动,SO3的含量:B>A,SO2、O2的含量:A>B,错误;
D项,平衡时:pA1.α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g) 2NO2(g)和3O2(g)
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A.α1、α2均减小,c1、c2均增大
B.α1、α2均增大,c1、c2均减小
C.α1减小、α2增大,c1、c2均增大
D.α1减小、α2增大,c1增大、c2减小
1
2
3
自我测试
√
1
2
3
自我测试
恒容容器中,在温度不变的情况下,均增加反应物的物质的量,相当于增大压强,对于N2O4(g) 2NO2(g)而言,压强增大,平衡逆向移动,α1减小;对于3O2(g) 2O3(g)而言,压强增大,平衡正向移动,α2增大。因都直接加入了反应物,则反应物的平衡浓度c1、c2均增大。
该催化剂在较低温度时主要选择__________(填“反应Ⅰ”或“反应Ⅱ”)。
520 ℃时,反应Ⅰ的平衡常数K=_________________(只列算式不计算)。
自我测试
1
2
3
2.CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
为分析催化剂对反应的选择性,在1 L密闭容器中充入2 mol CO2和4 mol H2,测得有关物质的物质的量随温度变化如图所示:
反应Ⅰ
温度较低时,CH4的物质的量多,所以该催化剂在较低温度时主要选择反应Ⅰ。
CO2(g)+4H2(g) CH4(g)+2H2O(g)
转化/(mol·L-1) 0.2 0.8 0.2 0.4
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
转化/(mol·L-1) 0.4 1.2 0.2 0.8
c(CO2)=(2-0.2-0.4)mol·L-1=1.4 mol·L-1
c(H2)=(4-0.8-1.2)mol·L-1=2 mol·L-1
c(H2O)=(0.4+0.8)mol·L-1=1.2 mol·L-1
自我测试
1
2
3
自我测试
1
2
3
3.如图为气相直接水合法C2H4(g)+H2O(g) C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=______________(保留三位有效数字)。
0.071 7 MPa-1
自我测试
1
2
3
C2H4(g) + H2O(g) C2H5OH(g)
起始/mol 1 1 0
转化/mol 0.2 0.2 0.2
平衡/mol 0.8 0.8 0.2
自我测试
1
2
3
≈0.071 7 MPa-1。
平衡常数的应用及计算、平衡转化率的分析
第5课时
高中化学 鲁科版选择性必修1
1.依据平衡常数分析热效应。
2.依据K与Q判断反应进行的方向。
3.平衡转化率的分析。
4.压强平衡常数(Kp)的计算及应用。
1.压强平衡常数(Kp)的应用及计算。
2.平衡转化率的分析。
[学习目标]
[重点难点]
化学平衡常数的应用及计算
导学
1.化学平衡常数的应用
2.多重平衡体系中化学平衡常数计算
(1)多重平衡体系:一个化学反应体系中存在多个化学反应,在一定条件下,这些反应都可以达到平衡状态,这种现象称作多重平衡现象,该体系称作多重平衡体系。
(2)多重平衡反应类型
①连续型(耦合)反应:某物质是某反应的反应产物,同时又是其他反应的反应物。
②平行型(竞争型)反应:某物质同时是多个反应的反应物。
(3)多重平衡体系中有关平衡常数的计算,各组分的平衡量指的是整个平衡体系中的量,而不是指某一单一反应中的量。
导练
1.已知反应:A(g)+B(g) C(g)+D(g)的平衡常数与温度的关系如下表。830 ℃时,向一个2 L的密闭容器中充入0.2 mol A和0.8 mol B,反应至4 s时c(C)=0.02 mol·L-1。下列说法正确的是
温度/℃ 700 800 830 1 000 1 200
平衡常数 1.7 1.1 1.0 0.6 0.4
A.1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数K=0.4
B.反应达平衡后,升高温度,平衡正向移动
C.4 s内,用A表示的该反应的平均反应速率v(A)=0.01 mol·L-1·s-1
D.830 ℃下反应达平衡时,B的转化率为20%
√
随温度升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,B错误;
2.加热N2O5依次发生的分解反应为
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则t ℃时反应①的平衡常数为
A.10.7 mol·L-1 B.8.5 mol·L-1
C.9.6 mol·L-1 D.10.2 mol·L-1
√
压强平衡常数(Kp)及其应用
1.分压
(1)定义:相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同体积时,该气体B所具有的压强,称为气体B的分压强。
(2)计算公式:
混合气体中某组分的分压=总压×该组分的物质的量分数,pB=p总× 。
(3)分压定律:混合气体的总压等于相同温度下各组分气体的分压之和,即p总=pA+pB+pC+…
导学
2.压强平衡常数
3.压强平衡常数计算技巧
第一步,根据三段式法计算平衡体系中各物质的物质的量或物质的量浓度。
第二步,计算各气体组分的物质的量分数或体积分数。
第三步,根据分压计算公式求出各气体物质的分压。
1.[2020·全国卷Ⅱ,28(1)③改编]乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH=+137 kJ·mol-1,容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡
常数Kp的数值为______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
导练
设起始时加入的乙烷和氢气各为1 mol,列出三段式,
C2H6(g) C2H4(g)+H2(g)
起始/mol 1 0 1
转化/mol α α α
平衡/mol 1-α α 1+α
2.环戊二烯是生产精细化工产品的重要中间体,其制备反应为
ΔH>0
该反应在刚性容器中进行。实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为100 kPa的双环戊二烯和水蒸气,达到平衡后总压为160 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=______kPa(Kp为用分压表示的平衡常数)。
25
960
ΔH>0
平衡转化率的分析
导学
1.当可逆反应达到平衡后,反应物的初始浓度不变,只改变体系的温度、压强或减小反应产物的量使平衡正向移动,这时反应物的转化率一定增大。
2.反应物用量的改变对转化率的影响
(1)若反应物是一种且为气体,如:aA(g) bB(g)+cC(g)。在恒温恒容条件下,增加A的浓度,平衡正向移动,但A的转化率分析等效为压强对平衡的影响。
气体计量数关系 A的转化率
a=b+c 不变
a>b+c 增大
a
①在其他条件不变时,增加A的量,平衡正向移动,A的转化率降低,B的转化率升高。
②若起始按化学计量数之比投入A、B,则A、B的转化率一定相同。
③在恒温恒容条件下,若按原比例(投料比)同倍数增加A和B,平衡正向移动,但反应物(A或B)的转化率等效为压强对平衡的影响。此时可虚拟一个路径来理解转化率的变化。如:
导练
1.反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
A.增大容器容积
B.降低反应温度
C.分离出部分氢气
D.等容下通入惰性气体
√
√
该反应的正反应是气体体积增大的反应,增大反应容器的容积,体系的压强减小,化学平衡正向移动,能提高乙烷的平衡转化率,A项不符合题意;
分离出部分氢气,减少了反应产物浓度,平衡正向移动,可提高乙烷的平衡转化率,C项不符合题意;
等容下通入惰性气体,体系的总压强增大,物质的浓度不变,因此化学平衡不移动,对乙烷的平衡转化率无影响,D项符合题意。
2.(1)可逆反应2SO2(g)+O2(g) 2SO3(g),在一定条件下达到平衡后,只增大O2的浓度,平衡_____移动,则SO2的转化率______,O2的转化率______。
(2)某温度下,在2 L的密闭容器中,加入3 mol X(g)和1 mol Y(g),发生反应:3X(g)+Y(g) 2Z(g)+2R(g) ΔH<0。平衡时,X、Y、Z、R的体积分数分别为60%、20%、10%、10%。X与Y的转化率之比为______。
正向
增大
减小
1∶1
(3)两个体积相同的密闭容器A、B,在A中充入SO2和O2各1 mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应:2SO2(g)+O2(g) 2SO3(g),对此反应的表述不正确的是____(填字母)。
A.反应速率:B>A
B.SO2 的转化率:B>A
C.平衡时各组分含量:B=A
D.平衡时容器的压强:B>A
C
A项,两容器的体积相同,B中SO2、O2物质的量浓度都是A中的两倍,在相同条件下反应物浓度越大反应速率越快,反应速率:B>A,正确;
B项,要将A、B两容器平衡时的物理量进行比较,可建立如下模型:①另取一个2倍体积的容器,充入SO2、O2各2 mol,则在相同条件下,该容器达平衡时SO2的转化率、平衡时各组分含量、平衡时的压强与A中对应相等;②B相当于在该容器的基础上将体积缩小一半,即增大压强,平衡正向移动,反应物的转化率增大,SO2的转化率:B>A,正确;
C项,由于平衡正向移动,SO3的含量:B>A,SO2、O2的含量:A>B,错误;
D项,平衡时:pA
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A.α1、α2均减小,c1、c2均增大
B.α1、α2均增大,c1、c2均减小
C.α1减小、α2增大,c1、c2均增大
D.α1减小、α2增大,c1增大、c2减小
1
2
3
自我测试
√
1
2
3
自我测试
恒容容器中,在温度不变的情况下,均增加反应物的物质的量,相当于增大压强,对于N2O4(g) 2NO2(g)而言,压强增大,平衡逆向移动,α1减小;对于3O2(g) 2O3(g)而言,压强增大,平衡正向移动,α2增大。因都直接加入了反应物,则反应物的平衡浓度c1、c2均增大。
该催化剂在较低温度时主要选择__________(填“反应Ⅰ”或“反应Ⅱ”)。
520 ℃时,反应Ⅰ的平衡常数K=_________________(只列算式不计算)。
自我测试
1
2
3
2.CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
为分析催化剂对反应的选择性,在1 L密闭容器中充入2 mol CO2和4 mol H2,测得有关物质的物质的量随温度变化如图所示:
反应Ⅰ
温度较低时,CH4的物质的量多,所以该催化剂在较低温度时主要选择反应Ⅰ。
CO2(g)+4H2(g) CH4(g)+2H2O(g)
转化/(mol·L-1) 0.2 0.8 0.2 0.4
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
转化/(mol·L-1) 0.4 1.2 0.2 0.8
c(CO2)=(2-0.2-0.4)mol·L-1=1.4 mol·L-1
c(H2)=(4-0.8-1.2)mol·L-1=2 mol·L-1
c(H2O)=(0.4+0.8)mol·L-1=1.2 mol·L-1
自我测试
1
2
3
自我测试
1
2
3
3.如图为气相直接水合法C2H4(g)+H2O(g) C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=______________(保留三位有效数字)。
0.071 7 MPa-1
自我测试
1
2
3
C2H4(g) + H2O(g) C2H5OH(g)
起始/mol 1 1 0
转化/mol 0.2 0.2 0.2
平衡/mol 0.8 0.8 0.2
自我测试
1
2
3
≈0.071 7 MPa-1。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
