第2章 第4节 化学反应条件的优化——工业合成氨 课件(共29张PPT)-高中化学鲁科版选择性必修1
文档属性
| 名称 | 第2章 第4节 化学反应条件的优化——工业合成氨 课件(共29张PPT)-高中化学鲁科版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-05 15:18:24 | ||
图片预览








文档简介
(共29张PPT)
化学反应条件的优化——工业合成氨
第4节
高中化学 鲁科版选择性必修1
1.了解化学反应速率和化学平衡调控在生活、生产和科学研究领域中的重要作用。
2.通过对工业合成氨生产条件的优化选择,认识化学反应原理在工业生产中的
重要价值。
1.应用化学反应速率和化学平衡原理分析合成氨的适宜条件。
2.应用化学反应原理分析化工生产条件的思路和方法,体验实际生产条件的选
择与理论分析的差异。
[学习目标]
[重点难点]
合成氨反应的限度与速率
导学
1.合成氨反应的特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1。
可逆
减小
<
<
<
能
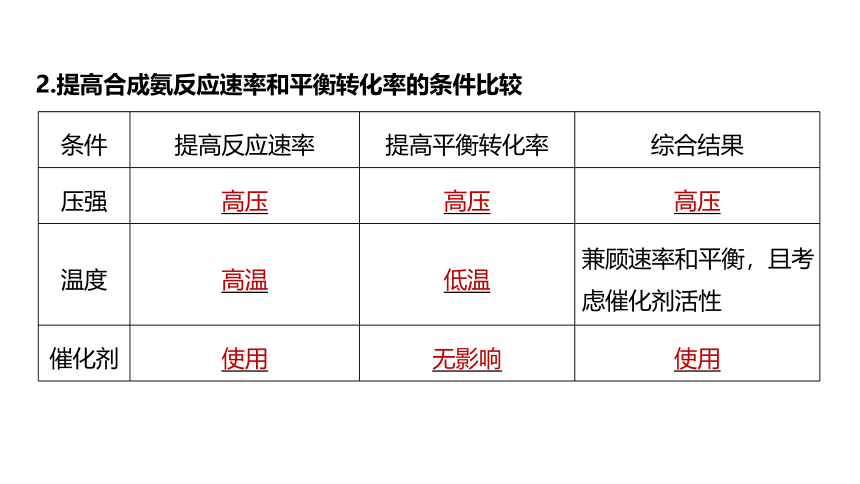
2.提高合成氨反应速率和平衡转化率的条件比较
条件 提高反应速率 提高平衡转化率 综合结果
压强 高压 高压 高压
温度 高温 低温 兼顾速率和平衡,且考虑催化剂活性
催化剂 使用 无影响 使用
研究发现,在一定的温度、压强下,反应物N2和H2的体积比为1∶3时平衡混合物中氨的含量最高。
浓度 由反应速率方程可知,增大氮气、氢气的浓度,减小氨气的浓度 增大反应物的浓度,降低反应产物的浓度 增大反应物的浓度,且不断减小反应产物的浓度
导思
1.判断正误
(1)工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行
( )
(2)合成氨反应是气体体积减小的反应,故实际生产中采用的压强越大越好
( )
(3)合成氨工业生产中,N2和H2的转化率相等( )
(4)合成氨中在提高反应速率和原料的转化率上对温度的要求是一致的( )
(5)增大反应物的浓度,减少反应产物的浓度,可以提高氨气的产率( )
×
×
×
×
√
2.实验研究表明,在特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为v=kc(N2)·c1.5(H2)·c-1(NH3),请你根据该关系式分析,各物质的浓度对反应速率有哪些影响?可以采取哪些措施来提高反应速率?
提示 由合成氨反应的化学反应速率公式可知,在一定温度、压强下,化学反应速率与反应物浓度[c(N2)或c1.5(H2)]成正比关系,与反应产物浓度[c(NH3)]成反比关系。由此在一定温度、压强下,可采取增大反应物浓度、减小反应产物浓度的措施来提高化学反应速率。另外还可采取升高温度、使用合适的催化剂等措施来加快反应速率。
1.可逆反应:3H2(g)+N2(g) 2NH3(g) ΔH<0,达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是
A.升高温度,减小压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
导练
√
先分析温度的影响,合成氨是放热反应,从理论上分析应采用尽可能低的温度,选项A、C中升高温度是错误的;
合成氨是一个气体体积减小的反应,所以增大压强会使平衡向正反应方向移动。增加反应物(N2)浓度或减小反应产物(NH3)浓度,会使平衡向正反应方向移动,选项D正确;
加入催化剂可提高反应速率,但对平衡移动无影响,选项B错误。
2.在N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1中v=kc(N2)·c1.5(H2)·
c-1(NH3),仅从使反应速率加快的角度来考虑,可采取的措施是
①减压 ②加压 ③升温 ④降温 ⑤补充N2 ⑥加催化剂 ⑦减小N2或H2的量
A.③④⑤⑦ B.②④ C.①②⑥ D.②③⑤⑥
√
加压、升温、使用催化剂均可提高反应速率,由反应速率方程可知,增大氮气、氢气的浓度可提高合成氨的反应速率。
合成氨生产的适宜条件
1.合成氨的适宜条件分析
工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适宜条件,既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间内的产量,同时还要考虑设备的要求和技术条件。
导学
2.工业合成氨的适宜条件
序号 影响因素 选择条件
(1) 温度 反应温度控制在700 K左右
(2) 浓度 N2、H2投料比为1∶2.8。氨及时从混合气中分离出去,剩余气体循环使用
(3) 压强 1×107~1×108 Pa
(4) 催化剂 选择铁做催化剂
3.合成氨的生产流程的三阶段
导思
1.判断正误
(1)充入的N2越多越有利于NH3的合成( )
(2)使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率
( )
(3)在工业生产条件优化时,只考虑经济性就行,不用考虑环保( )
(4)合成氨反应选择在700 K左右进行的重要原因是催化剂在700 K左右时活性最大( )
(5)一个化工生产的过程中只考虑反应的限度问题即可( )
×
√
×
√
×
2.合成氨的反应中,为何将氮气、氢气的投料比定为1∶2.8呢?
提示 温度、压强一定时,N2与H2的体积比为1∶3时,平衡混合物中氨的含量最高;根据在特定条件下,v=kc(N2)·c1.5(H2)·c-1(NH3),提高H2的压强似乎更有利于提高合成氨反应的速率,但是,N2在催化剂上的吸附分解为总反应中最慢的步骤,即这是影响反应速率的关键步骤。实验表明,适当提高N2的比例,当N2与H2的物质的量之比为1∶2.8时更能加快合成氨反应的进行。
1.下列有关合成氨工业的说法正确的是
A.增大H2的浓度,H2的转化率减小
B.由于氨易液化,N2、H2在实际生产中可循环使用,所以总体来说合成氨的
产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方
向移动
D.合成氨厂采用的压强是10~30 MPa,因为该压强下铁触媒的活性最大
导练
√
√
A项,增大H2的浓度,H2的转化率减小;
C项,反应温度控制在400~500 ℃主要是为了兼顾速率与平衡,且500 ℃左右时催化剂活性最大;
D项,压强采用10 MPa~30 MPa主要是考虑对设备材料的要求。
2.合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,K=6.6×
105 mol-2·L2。
(1)从平衡常数来看,反应的限度已经很大了,还需要使用催化剂的原因是____________________________________________。
(2)试分析实际生产中采取700 K左右的温度的原因是______________________
___________________________________________________________________________________________________________________________。
(3)压强越大越有利于合成氨平衡正向移动,提高反应速率,而实际采用的最高压强为8.5×107~1×108 Pa,不采用更高的压强,其原因是_______________
________________________________________________________。
为了加快化学反应速率,提高单位时间内的产量
温度高于700 K,会使平
衡逆向移动,降低反应物的转化率,温度低于700 K,反应速率小,并且在此温度时,催化剂的活性最大,有利于提高单位时间内的产量
实际生产中,从
动力消耗、设备要求、生产成本综合考虑,不是压强越大越好
(4)N2和H2原料气在送入合成塔之前必须先净化的主要原因是______________
______。
(5)在合成氨生产中采取循环利用的原因是_______________________________
__________________________。
防止催化剂
中毒
合成氨的平衡转化率较小,为提高
原料的利用率采取循环操作
1.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
A.加催化剂,v正、v逆都发生变化而且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D.等容条件下加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
1
2
3
自我测试
√
1
2
3
自我测试
加入催化剂,同等程度改变v正和v逆,A正确;
增大压强,v正、v逆都增大,v正(气体分子总数减小的方向)增大程度大,B正确;
降温,v正、v逆都减小,v逆(吸热方向)减小的更多,C正确;
等容条件下加入氩气,各组分浓度均没有发生改变,v正、v逆均不变,D错误。
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以增大反应速率
C.步骤③④⑤均有利于提高原料的平衡转化率
D.液态NH3除可生产化肥外,还可作制冷剂
自我测试
1
2
3
2.下图为工业合成氨的流程图,下列有关说法不正确的是
√
自我测试
1
2
3
步骤①中“净化”可以除去原料气中的杂质气体,防止杂质气体降低催化剂的催化效果,A项正确;
合成氨反应是气体分子数减小的反应,则步骤②中“加压”可使平衡正向移动,即可提高原料转化率,增大压强,可增大反应速率,B项正确;
自我测试
1
2
3
步骤③为“催化反应”,催化剂只能改变反应速率,不能使平衡移动,故不能改变平衡转化率,且升高温度降低了原料的转化率,C项错误;
氨是制备氮肥的原料,液氨汽化时吸收热量,可以作为制冷剂,D项正确。
3.已知一定温度下合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·
mol-1,在相同温度、相同体积的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2达到平衡时放热为Q1;②通入2 mol N2和6 mol H2达到平衡时放热为Q2。则下列关系正确的是
A.Q2=2Q1
B.Q1>
C.2Q1D.Q1=Q2<92.4 kJ
自我测试
1
2
3
√
自我测试
1
2
3
题述热化学方程式表示一定条件下,1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出的热量是92.4 kJ,该反应为可逆反应,物质不能完全反应,恒温、恒容下,物质的量与压强成正比,物质的量与热量成正比,则①中参加反应的氮气小于1 mol,则Q1<92.4 kJ,②中参加反应的氮气小于2 mol,则Q2<184.8 kJ,且②中通入的n(N2)是①中的2倍,相当于增大压强,平衡正向移动,可知2Q1
化学反应条件的优化——工业合成氨
第4节
高中化学 鲁科版选择性必修1
1.了解化学反应速率和化学平衡调控在生活、生产和科学研究领域中的重要作用。
2.通过对工业合成氨生产条件的优化选择,认识化学反应原理在工业生产中的
重要价值。
1.应用化学反应速率和化学平衡原理分析合成氨的适宜条件。
2.应用化学反应原理分析化工生产条件的思路和方法,体验实际生产条件的选
择与理论分析的差异。
[学习目标]
[重点难点]
合成氨反应的限度与速率
导学
1.合成氨反应的特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1。
可逆
减小
<
<
<
能
2.提高合成氨反应速率和平衡转化率的条件比较
条件 提高反应速率 提高平衡转化率 综合结果
压强 高压 高压 高压
温度 高温 低温 兼顾速率和平衡,且考虑催化剂活性
催化剂 使用 无影响 使用
研究发现,在一定的温度、压强下,反应物N2和H2的体积比为1∶3时平衡混合物中氨的含量最高。
浓度 由反应速率方程可知,增大氮气、氢气的浓度,减小氨气的浓度 增大反应物的浓度,降低反应产物的浓度 增大反应物的浓度,且不断减小反应产物的浓度
导思
1.判断正误
(1)工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行
( )
(2)合成氨反应是气体体积减小的反应,故实际生产中采用的压强越大越好
( )
(3)合成氨工业生产中,N2和H2的转化率相等( )
(4)合成氨中在提高反应速率和原料的转化率上对温度的要求是一致的( )
(5)增大反应物的浓度,减少反应产物的浓度,可以提高氨气的产率( )
×
×
×
×
√
2.实验研究表明,在特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为v=kc(N2)·c1.5(H2)·c-1(NH3),请你根据该关系式分析,各物质的浓度对反应速率有哪些影响?可以采取哪些措施来提高反应速率?
提示 由合成氨反应的化学反应速率公式可知,在一定温度、压强下,化学反应速率与反应物浓度[c(N2)或c1.5(H2)]成正比关系,与反应产物浓度[c(NH3)]成反比关系。由此在一定温度、压强下,可采取增大反应物浓度、减小反应产物浓度的措施来提高化学反应速率。另外还可采取升高温度、使用合适的催化剂等措施来加快反应速率。
1.可逆反应:3H2(g)+N2(g) 2NH3(g) ΔH<0,达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是
A.升高温度,减小压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
导练
√
先分析温度的影响,合成氨是放热反应,从理论上分析应采用尽可能低的温度,选项A、C中升高温度是错误的;
合成氨是一个气体体积减小的反应,所以增大压强会使平衡向正反应方向移动。增加反应物(N2)浓度或减小反应产物(NH3)浓度,会使平衡向正反应方向移动,选项D正确;
加入催化剂可提高反应速率,但对平衡移动无影响,选项B错误。
2.在N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1中v=kc(N2)·c1.5(H2)·
c-1(NH3),仅从使反应速率加快的角度来考虑,可采取的措施是
①减压 ②加压 ③升温 ④降温 ⑤补充N2 ⑥加催化剂 ⑦减小N2或H2的量
A.③④⑤⑦ B.②④ C.①②⑥ D.②③⑤⑥
√
加压、升温、使用催化剂均可提高反应速率,由反应速率方程可知,增大氮气、氢气的浓度可提高合成氨的反应速率。
合成氨生产的适宜条件
1.合成氨的适宜条件分析
工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适宜条件,既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间内的产量,同时还要考虑设备的要求和技术条件。
导学
2.工业合成氨的适宜条件
序号 影响因素 选择条件
(1) 温度 反应温度控制在700 K左右
(2) 浓度 N2、H2投料比为1∶2.8。氨及时从混合气中分离出去,剩余气体循环使用
(3) 压强 1×107~1×108 Pa
(4) 催化剂 选择铁做催化剂
3.合成氨的生产流程的三阶段
导思
1.判断正误
(1)充入的N2越多越有利于NH3的合成( )
(2)使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率
( )
(3)在工业生产条件优化时,只考虑经济性就行,不用考虑环保( )
(4)合成氨反应选择在700 K左右进行的重要原因是催化剂在700 K左右时活性最大( )
(5)一个化工生产的过程中只考虑反应的限度问题即可( )
×
√
×
√
×
2.合成氨的反应中,为何将氮气、氢气的投料比定为1∶2.8呢?
提示 温度、压强一定时,N2与H2的体积比为1∶3时,平衡混合物中氨的含量最高;根据在特定条件下,v=kc(N2)·c1.5(H2)·c-1(NH3),提高H2的压强似乎更有利于提高合成氨反应的速率,但是,N2在催化剂上的吸附分解为总反应中最慢的步骤,即这是影响反应速率的关键步骤。实验表明,适当提高N2的比例,当N2与H2的物质的量之比为1∶2.8时更能加快合成氨反应的进行。
1.下列有关合成氨工业的说法正确的是
A.增大H2的浓度,H2的转化率减小
B.由于氨易液化,N2、H2在实际生产中可循环使用,所以总体来说合成氨的
产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方
向移动
D.合成氨厂采用的压强是10~30 MPa,因为该压强下铁触媒的活性最大
导练
√
√
A项,增大H2的浓度,H2的转化率减小;
C项,反应温度控制在400~500 ℃主要是为了兼顾速率与平衡,且500 ℃左右时催化剂活性最大;
D项,压强采用10 MPa~30 MPa主要是考虑对设备材料的要求。
2.合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,K=6.6×
105 mol-2·L2。
(1)从平衡常数来看,反应的限度已经很大了,还需要使用催化剂的原因是____________________________________________。
(2)试分析实际生产中采取700 K左右的温度的原因是______________________
___________________________________________________________________________________________________________________________。
(3)压强越大越有利于合成氨平衡正向移动,提高反应速率,而实际采用的最高压强为8.5×107~1×108 Pa,不采用更高的压强,其原因是_______________
________________________________________________________。
为了加快化学反应速率,提高单位时间内的产量
温度高于700 K,会使平
衡逆向移动,降低反应物的转化率,温度低于700 K,反应速率小,并且在此温度时,催化剂的活性最大,有利于提高单位时间内的产量
实际生产中,从
动力消耗、设备要求、生产成本综合考虑,不是压强越大越好
(4)N2和H2原料气在送入合成塔之前必须先净化的主要原因是______________
______。
(5)在合成氨生产中采取循环利用的原因是_______________________________
__________________________。
防止催化剂
中毒
合成氨的平衡转化率较小,为提高
原料的利用率采取循环操作
1.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
A.加催化剂,v正、v逆都发生变化而且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D.等容条件下加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
1
2
3
自我测试
√
1
2
3
自我测试
加入催化剂,同等程度改变v正和v逆,A正确;
增大压强,v正、v逆都增大,v正(气体分子总数减小的方向)增大程度大,B正确;
降温,v正、v逆都减小,v逆(吸热方向)减小的更多,C正确;
等容条件下加入氩气,各组分浓度均没有发生改变,v正、v逆均不变,D错误。
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以增大反应速率
C.步骤③④⑤均有利于提高原料的平衡转化率
D.液态NH3除可生产化肥外,还可作制冷剂
自我测试
1
2
3
2.下图为工业合成氨的流程图,下列有关说法不正确的是
√
自我测试
1
2
3
步骤①中“净化”可以除去原料气中的杂质气体,防止杂质气体降低催化剂的催化效果,A项正确;
合成氨反应是气体分子数减小的反应,则步骤②中“加压”可使平衡正向移动,即可提高原料转化率,增大压强,可增大反应速率,B项正确;
自我测试
1
2
3
步骤③为“催化反应”,催化剂只能改变反应速率,不能使平衡移动,故不能改变平衡转化率,且升高温度降低了原料的转化率,C项错误;
氨是制备氮肥的原料,液氨汽化时吸收热量,可以作为制冷剂,D项正确。
3.已知一定温度下合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·
mol-1,在相同温度、相同体积的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2达到平衡时放热为Q1;②通入2 mol N2和6 mol H2达到平衡时放热为Q2。则下列关系正确的是
A.Q2=2Q1
B.Q1>
C.2Q1
自我测试
1
2
3
√
自我测试
1
2
3
题述热化学方程式表示一定条件下,1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出的热量是92.4 kJ,该反应为可逆反应,物质不能完全反应,恒温、恒容下,物质的量与压强成正比,物质的量与热量成正比,则①中参加反应的氮气小于1 mol,则Q1<92.4 kJ,②中参加反应的氮气小于2 mol,则Q2<184.8 kJ,且②中通入的n(N2)是①中的2倍,相当于增大压强,平衡正向移动,可知2Q1
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
