江西省九江市湖口县2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 江西省九江市湖口县2022-2023学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-06 12:01:23 | ||
图片预览



文档简介
湖口县2022-2023学年高二下学期期中考试
化学
一.单选题(每小题3分,共30分)
1.刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它
A.是分子晶体 B.是共价化合物
C.可做铝热剂 D.熔融状态下能导电
2.下列有关化学用语正确的是
A.正丁烷的球棍模型,其一氯代物有2种
B.、都是苯的同系物
C.羟基电子式为:
D.乙烯的结构简式
3.硫元素的几种化合物存在下列转化关系。下列说法正确的是
浓H2SO4SO2Na2SO3溶液Na2S2O3溶液S
A.反应①中生成的SO2具有漂白性,可使溴水褪色
B.反应②中若SO2少量,就会生成NaHSO3
C.反应④中生成 S 既是氧化产物,也是还原产物
D.反应④中当消耗 1mol 稀硫酸时,电子转移为2mol
4.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥环己烯;⑦聚丙烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是
A.①③⑤ B.④⑥⑦ C.①④⑦ D.②③⑤
5.无机化学对硫-氮化合物的研究是最为活跃的领域之一。如图所示是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
6.需要使用温度计测定反应物温度的是
A.制备乙酸乙酯 B.银镜反应
C.制备硝基苯 D.制备乙烯
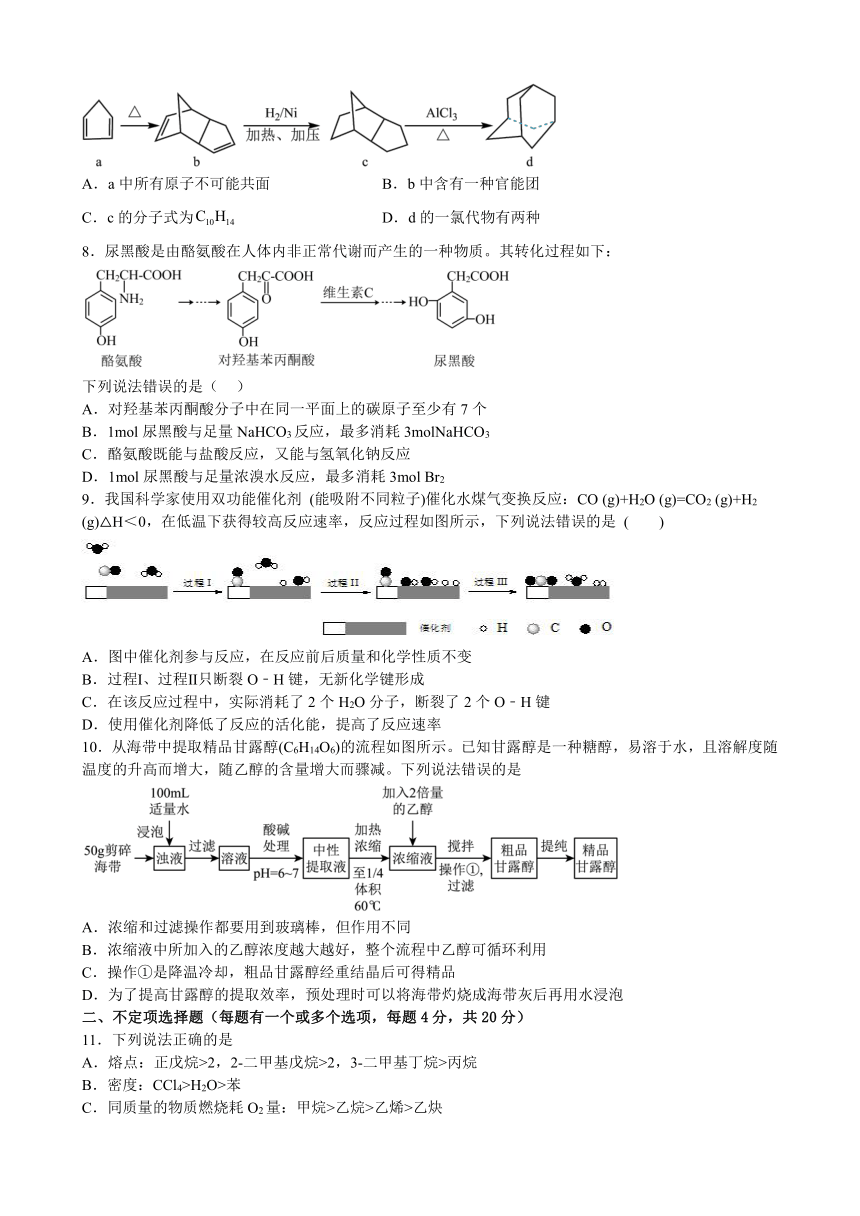
7.根据图示合成路线分析,下列有关说法错误的是
A.a中所有原子不可能共面 B.b中含有一种官能团
C.c的分子式为 D.d的一氯代物有两种
8.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:
下列说法错误的是( )
A.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
B.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3
C.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
D.1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2
9.我国科学家使用双功能催化剂 (能吸附不同粒子)催化水煤气变换反应:CO (g)+H2O (g)=CO2 (g)+H2 (g)△H<0,在低温下获得较高反应速率,反应过程如图所示,下列说法错误的是 ( )
A.图中催化剂参与反应,在反应前后质量和化学性质不变
B.过程Ⅰ、过程Ⅱ只断裂O﹣H键,无新化学键形成
C.在该反应过程中,实际消耗了2个H2O分子,断裂了2个O﹣H键
D.使用催化剂降低了反应的活化能,提高了反应速率
10.从海带中提取精品甘露醇(C6H14O6)的流程如图所示。已知甘露醇是一种糖醇,易溶于水,且溶解度随温度的升高而增大,随乙醇的含量增大而骤减。下列说法错误的是
A.浓缩和过滤操作都要用到玻璃棒,但作用不同
B.浓缩液中所加入的乙醇浓度越大越好,整个流程中乙醇可循环利用
C.操作①是降温冷却,粗品甘露醇经重结晶后可得精品
D.为了提高甘露醇的提取效率,预处理时可以将海带灼烧成海带灰后再用水浸泡
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.下列说法正确的是
A.熔点:正戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>H2O>苯
C.同质量的物质燃烧耗O2量:甲烷>乙烷>乙烯>乙炔
D.同物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸
12.下列有机物的系统命名正确的是
A.间二甲苯
B. 二乙酸乙二酯
C. 2-甲基-4-己烯
D. 2,5-二甲基-3-乙基己烷
13.化合物P是一种非甾体类抗炎药洛索洛芬钠的中间体,结构如图所示。下列有关该化合物P说法正确的是
A.含有四种含氧官能团 B.最多可与发生反应
C.含有2个手性碳原子 D.不能使酸性高锰酸钾稀溶液褪色
14.化合物X是一种医药中间体,其结构简式如下图所示。下列有关化合物X的说法正确的是
A.该物质的分子式为C10H6O4
B.在酸性条件下水解,水解产物只有一种
C.分子中所有原子处于同一平面
D.1mol化合物X最多能与3molNaOH反应
15.工业上可用甲苯合成苯甲醛:
下列说法正确的是
A.甲苯分子中所有原子都在同一平面内
B.一氯甲苯的同分异构体有3种
C.苯甲醇可与金属钠反应
D.反应①②的反应类型相同
三、填空题(共50分)
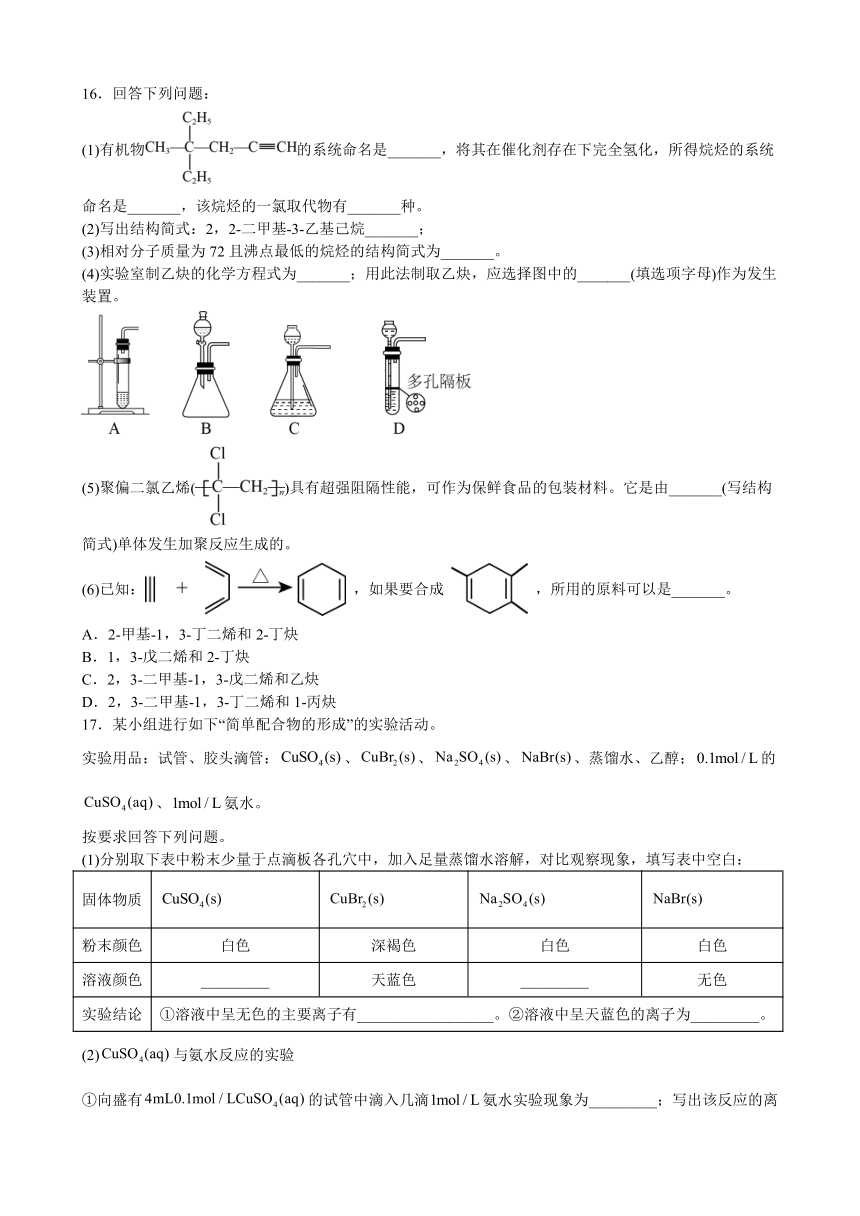
16.回答下列问题:
(1)有机物的系统命名是_______,将其在催化剂存在下完全氢化,所得烷烃的系统命名是_______,该烷烃的一氯取代物有_______种。
(2)写出结构简式:2,2-二甲基-3-乙基己烷_______;
(3)相对分子质量为72且沸点最低的烷烃的结构简式为_______。
(4)实验室制乙炔的化学方程式为_______;用此法制取乙炔,应选择图中的_______(填选项字母)作为发生装置。
(5)聚偏二氯乙烯()具有超强阻隔性能,可作为保鲜食品的包装材料。它是由_______(写结构简式)单体发生加聚反应生成的。
(6)已知: ,如果要合成 ,所用的原料可以是_______。
A.2-甲基-1,3-丁二烯和2-丁炔
B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔
D.2,3-二甲基-1,3-丁二烯和1-丙炔
17.某小组进行如下“简单配合物的形成”的实验活动。
实验用品:试管、胶头滴管:、、、、蒸馏水、乙醇;的、氨水。
按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
固体物质
粉末颜色 白色 深褐色 白色 白色
溶液颜色 _________ 天蓝色 _________ 无色
实验结论 ①溶液中呈无色的主要离子有__________________。②溶液中呈天蓝色的离子为_________。
(2)与氨水反应的实验
①向盛有的试管中滴入几滴氨水实验现象为_________;写出该反应的离子方程式:________________。
②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:__________________。
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:__________________。
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为_________,配位数为_________,配体为_________。
18.金属钴广泛应用于航空航天、电器制造等领域,是一种重要的战略金属,我国钴资源匮乏,绝大多数属于伴生矿。一种以进口水钴矿(主要成分为,杂质中含量较高,还有少量、、、、等)为原料提取钴和铜的工艺流程如图所示。
已知:①、
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子
开始沉淀的pH 2.3 7.5 7.6 3.4 7.6
完全沉淀的pH 2.8 8.3 9.2 5.2 9.8
回答下列问题:
(1)在元素周期表中的位置为_______。
(2)电解溶液提取铜剩余的电解贫液(稀溶液)可返回到_______工序中循环利用。
(3)仅用硫酸很难浸出,加入后发生“还原浸出”,该反应的离子方程式为_______。
(4)沉淀1的主要成分有_______,用调溶液的pH范围是_______。
(5)①的作用是将溶液中的、转化为、沉淀,若过滤后“滤液1”中,当除钙率达到90%时,溶液中_______。
②下图为晶胞和晶胞,两种晶胞中与的配位数之比为_______。
(6)萃取的反应原理为,向有机萃取剂中加入能进行反萃取的原因是_______(结合平衡移动原理解释)。
19.氯霉素(H)是一种抑菌性光谱抗生素,能够阻挠细菌蛋白质的生成,下图是用烃A为原料合成氯霉素的路线图。
回答下列问题:
(1)有机物B的化学名称为_______,G的结构简式为_______。
(2)由选用的无机试剂是_______。
(3)的反应类型是_______。
(4)F中官能团种类有硝基、羟基、_______、_______。
(5)写出的反应方程式:_______。
(6)符合下列条件的B的同分异构体有_______种。
①苯环上有3个取代基;②能发生水解反应。
(7)参照上述流程,设计以A为原料制备有机物的合成路线_______(其他无机试剂任选)。
1.D
A.刚玉(主要成分为)硬度仅次于金刚石,所以不属于分子晶体,事实上氧化铝属于过渡晶体,偏向共价晶体,A不符合题意;
B.氧化铝中铝元素与氧元素之间为离子键,所以属于离子化合物,B不符合题意;
C.铝热剂是铝粉和难熔金属氧化物的混合物,所以氧化铝不能做铝热剂,C不符合题意;
D.氧化铝为离子化合物,熔融状态下可电离成铝离子和氧离子,可导电,D符合题意;
故选D。
2.A
A.正丁烷的结构简式为,其球棍模型为 ,分子结构对称,有2种化学环境不同的氢原子,因此,一氯代物有2种,A正确;
B.同系物具有相同的通式、相同官能团种类和数目,在分子组成上相差若干个“CH2”,苯的同系物应该只有一个苯环,符合通式,且侧链为烷基,因此不是苯的同系物,B错误;
C.羟基为,其电子式为,C错误;
D.乙烯的结构简式为,碳碳双键不能省略,D错误;
故选A。
3.D
A.反应①中生成的二氧化硫与溴水反应生成硫酸和氢溴酸,反应中溴水褪色是二氧化硫表现还原性,故A错误;
B.反应②中少量二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,不能生成亚硫酸氢钠,故B错误;
C.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,硫代硫酸钠转化为硫时,硫元素的化合价降低被还原,硫是反应的还原产物,故C错误;
D.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,反应的化学方程式为Na2S2O3+H2SO4(稀)=Na2SO4+S↓+SO2↑+H2O,由方程式可知,反应消耗 1mol 稀硫酸时,转移2mol电子,故D正确;
故选D。
4.C
既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色物质为烷烃、环烷烃、苯等不含双键、叁键的有机物。
②乙烯、③乙炔、⑥环己烯中均含不饱和键,能使酸性KMnO4溶液褪色,也能与溴水反应使溴水褪色;而①④⑦中均不含双键、三键,则既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色,⑤能使酸性KMnO4溶液褪色,但不能与溴水反应使溴水褪色,故选C。
5.B
A. 该物质的分了式为S4N4,A不正确;
B. 该物质的分子中既含有极性键(S—N)又含有非极性键(N—N),B正确;
C. 该物质形成的晶体是分子晶体,具有较低的熔、沸点,C不正确;
D. 该物质与化合物S2N2不是同素异形体,同素异形体指的是同一元素形成的不同单质,D不正确;
本题选B。
6.D
A.乙酸和乙醇在浓硫酸作用下加热制备乙酸乙酯,由制备原理可知不需温度计测定反应物温度,A不符题意;
B.银镜反应需要热水浴加热即可,不需温度计测定反应物温度,B不符题意;
C.苯和浓硝酸在浓硫酸作用下加热发生取代反应主要有机产物为硝基苯,不需温度计测定反应物温度,C不符题意;
D.乙醇在浓硫酸作用下、140℃时主要发生分子间脱水生成醚,在浓硫酸作用下、170℃时主要发生分子内脱水生成乙烯,温度不同主要产物不同,因此制备乙烯时需要温度计测定反应物温度,D符题意;
答案选D。
7.C
A.a中-CH2-的C为sp3杂化,VSEPR模型为四面体,与之成键的四个原子中有两个不能共面,A正确;
B.b中只含有C=C一种官能团,B正确;
C.c的分子式为C10H16,C错误;
D.d分子中有两种化学环境的H,其一氯代物有两种,D正确;
故选C。
8.B
A. 对羟基苯丙酮酸中苯环为平面结构,与苯环直接相连的碳原子一定在同一平面内,因此分子中在同一平面上的碳原子至少有7个,A项正确,不符合题意;
B. 尿黑酸中只有-COOH能与NaHCO3反应,因此1mol尿黑酸与足量NaHCO3反应,最多消耗1molNaHCO3,B项错误,符合题意;
C. 酪氨酸中含-OH和-NH2,具有酸性和碱性,既能与盐酸反应,又能与氢氧化钠反应,C项正确,不符合题意;
D. 尿黑酸中含酚羟基,酚羟基的邻位和对位能与Br2发生取代反应,因此1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2,D项正确,不符合题意;
答案选B。
9.C
A.根据图示,催化剂表面上看未参加反应,实际上起催化和吸附作用,在反应前后质量和化学性质不变,故A正确;
B.过程Ⅰ只断裂1个O﹣H键,过程Ⅱ又断裂1个O﹣H键;没有新化学键形成,故B正确;
C.根据图示,实际消耗了1个H2O分子,断裂了2个O﹣H键,故C错误;
D.催化剂降低反应所需的活化能,成千上万倍的加快了反应速率,故D正确;
故选:C。
10.D
A.浓缩过程中玻璃棒的作用为搅拌,过滤操作中玻璃棒的作用为引流,两个操作中玻璃棒的作用不同,A正确;
B.甘露醇随乙醇的含量增大而骤减,向浓缩液中加入乙醇可使甘露醇析出,则增大乙醇浓度能够提高甘露醇的析出率,操作①过滤后得到溶剂乙醇和水,所以乙醇可循环利用,B正确;
C.向浓缩液中加入乙醇后,甘露醇溶于水中,甘露醇溶解度随温度的升高而增大,降低温度后甘露醇析出,则操作①是降温冷却;过滤后得到粗品甘露醇,利用甘露醇在水中溶解度随温度变化差异进行重结晶可得到精品甘露醇,C正确;
D.甘露醇为有机醇类物质,灼烧后发生燃烧反应,无法提取精品甘露醇(C6H14O6),所以不能将海带灼烧,D错误;
故答案为:D。
11.BC
A.结合烷烃结构特点,烷烃中,碳原子个数越多其熔沸点越高,同分异构体的烷烃,支链越多其熔沸点越低,所以熔点:2,2一二甲基戊烷>2,3一二甲基丁烷>正戊烷>丙烷,故A错误;
B.三种物质的密度中,CCl4的密度大于1g/mL、水的密度是1g/mL、苯的密度小于1g/mL,所以密度:CCl4>H2O>苯,故B正确;
C.若烃为CxHy,同质量的物质燃烧耗O2量为,显然甲烷消耗氧气最多,大小顺序为甲烷>乙烯>乙炔,故C正确;
D.若有机物为CxHyOz,同物质的量物质燃烧耗O2量为-,消耗氧气为环己烷(C6H12)>苯(C6H6)=苯甲酸(C7H6O2),故D错误;
故选:BC。
12.D
A.属于传统命名法,系统命名法为1,3-二甲苯,故A错误;
B.该有机物为乙二酸二乙酯,故B错误;
C.从离官能团最近的一端开始编号,故该有机物的系统命名法为5-甲基-2-己烯,故C错误;
D.选择含有之恋最多且碳原子数最多的链为主链,该有机物为2,5-二甲基-3-乙基己烷,故D正确;
故选D。
13.C
A.根据化合物P的结构简式可知含有官能团为:羧基、酯基、羰基,三种官能团,A错误;
B.1个羰基1个H2,1个苯环3个H2,1mol化合物P最多可与4mol H2发生反应,B错误;
C.图中红色C为手性碳原子,C正确;
D.与苯环直接相连的碳上有氢结构能使高锰酸钾溶液褪色,如图:,图中红色字氢,属于与苯环直接相连的碳上有氢,能被高锰酸钾氧化,使高锰酸钾溶液褪色,D错误;
故选C
14.BD
A.根据X的结构可以数出其分子式应为C10H8O4, A错误;
B.该分子中只有一个酯基可以发生水解,所以其水解产物只有一种, B正确;
C.分子中存在饱和碳原子,饱和碳原子中原子为立体结构, C错误;
D.分子结构中的酯基氧原子与苯环直接相连,水解之后可生成苯酚,再与氢氧化钠反应,所以该酯基可消耗2mol氢氧化钠,同时分子结构中的羧基还会再消耗1mol氢氧化钠,总计消耗3mol氢氧化钠, D正确;
故选BD。
15.CD
A.甲苯中含有甲基,故甲苯分子中所有原子不可能都在同一平面内,选项A错误;
B.含苯环的同分异构体就有邻、间、对3种结构,含有不含苯环的同分异构体,多于3种,选项B错误;
C.苯甲醇中含有羟基,能够与金属钠反应放出氢气,选项C正确;
D.反应①是甲苯与氯气发生取代反应生成一氯甲苯和氢化氢,反应②是一氯甲苯在氢氧化钠的水溶液中加热发生取代反应生成苯甲醇和氯化钠,反应类型相同,选项D正确;
答案选CD。
16.(1) 4-甲基-4-乙基-1-己炔 3-甲基-3-乙基己烷 6
(2)
(3)
(4)CaC2+2H2OCa(OH)2+CHCH B
(5)CCl2=CH2
(6)AD
17.(1)蓝色 无色 、Na+、Br- Cu2+
(2)出现蓝色沉淀;;;;Cu2+;4;NH3。
18.(1)第四周期Ⅷ族
(2)萃铜
(3)Co2O3+SO+4H+=2Co2++SO+2H2O
(4)Fe(OH)3、Al(OH)3 5.2—7.6
(5)10—3mol/L 3:4
(6)向有机萃取剂中加入H2SO4溶液,溶液中H+浓度增大,平衡左移
19.(1)对硝基乙苯
(2)浓硫酸、浓硝酸
(3)加成反应
(4)羧基 酰胺基
(5)+Br2+HBr
(6)20
(7)
化学
一.单选题(每小题3分,共30分)
1.刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它
A.是分子晶体 B.是共价化合物
C.可做铝热剂 D.熔融状态下能导电
2.下列有关化学用语正确的是
A.正丁烷的球棍模型,其一氯代物有2种
B.、都是苯的同系物
C.羟基电子式为:
D.乙烯的结构简式
3.硫元素的几种化合物存在下列转化关系。下列说法正确的是
浓H2SO4SO2Na2SO3溶液Na2S2O3溶液S
A.反应①中生成的SO2具有漂白性,可使溴水褪色
B.反应②中若SO2少量,就会生成NaHSO3
C.反应④中生成 S 既是氧化产物,也是还原产物
D.反应④中当消耗 1mol 稀硫酸时,电子转移为2mol
4.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥环己烯;⑦聚丙烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是
A.①③⑤ B.④⑥⑦ C.①④⑦ D.②③⑤
5.无机化学对硫-氮化合物的研究是最为活跃的领域之一。如图所示是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
6.需要使用温度计测定反应物温度的是
A.制备乙酸乙酯 B.银镜反应
C.制备硝基苯 D.制备乙烯
7.根据图示合成路线分析,下列有关说法错误的是
A.a中所有原子不可能共面 B.b中含有一种官能团
C.c的分子式为 D.d的一氯代物有两种
8.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:
下列说法错误的是( )
A.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
B.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3
C.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
D.1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2
9.我国科学家使用双功能催化剂 (能吸附不同粒子)催化水煤气变换反应:CO (g)+H2O (g)=CO2 (g)+H2 (g)△H<0,在低温下获得较高反应速率,反应过程如图所示,下列说法错误的是 ( )
A.图中催化剂参与反应,在反应前后质量和化学性质不变
B.过程Ⅰ、过程Ⅱ只断裂O﹣H键,无新化学键形成
C.在该反应过程中,实际消耗了2个H2O分子,断裂了2个O﹣H键
D.使用催化剂降低了反应的活化能,提高了反应速率
10.从海带中提取精品甘露醇(C6H14O6)的流程如图所示。已知甘露醇是一种糖醇,易溶于水,且溶解度随温度的升高而增大,随乙醇的含量增大而骤减。下列说法错误的是
A.浓缩和过滤操作都要用到玻璃棒,但作用不同
B.浓缩液中所加入的乙醇浓度越大越好,整个流程中乙醇可循环利用
C.操作①是降温冷却,粗品甘露醇经重结晶后可得精品
D.为了提高甘露醇的提取效率,预处理时可以将海带灼烧成海带灰后再用水浸泡
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.下列说法正确的是
A.熔点:正戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>H2O>苯
C.同质量的物质燃烧耗O2量:甲烷>乙烷>乙烯>乙炔
D.同物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸
12.下列有机物的系统命名正确的是
A.间二甲苯
B. 二乙酸乙二酯
C. 2-甲基-4-己烯
D. 2,5-二甲基-3-乙基己烷
13.化合物P是一种非甾体类抗炎药洛索洛芬钠的中间体,结构如图所示。下列有关该化合物P说法正确的是
A.含有四种含氧官能团 B.最多可与发生反应
C.含有2个手性碳原子 D.不能使酸性高锰酸钾稀溶液褪色
14.化合物X是一种医药中间体,其结构简式如下图所示。下列有关化合物X的说法正确的是
A.该物质的分子式为C10H6O4
B.在酸性条件下水解,水解产物只有一种
C.分子中所有原子处于同一平面
D.1mol化合物X最多能与3molNaOH反应
15.工业上可用甲苯合成苯甲醛:
下列说法正确的是
A.甲苯分子中所有原子都在同一平面内
B.一氯甲苯的同分异构体有3种
C.苯甲醇可与金属钠反应
D.反应①②的反应类型相同
三、填空题(共50分)
16.回答下列问题:
(1)有机物的系统命名是_______,将其在催化剂存在下完全氢化,所得烷烃的系统命名是_______,该烷烃的一氯取代物有_______种。
(2)写出结构简式:2,2-二甲基-3-乙基己烷_______;
(3)相对分子质量为72且沸点最低的烷烃的结构简式为_______。
(4)实验室制乙炔的化学方程式为_______;用此法制取乙炔,应选择图中的_______(填选项字母)作为发生装置。
(5)聚偏二氯乙烯()具有超强阻隔性能,可作为保鲜食品的包装材料。它是由_______(写结构简式)单体发生加聚反应生成的。
(6)已知: ,如果要合成 ,所用的原料可以是_______。
A.2-甲基-1,3-丁二烯和2-丁炔
B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔
D.2,3-二甲基-1,3-丁二烯和1-丙炔
17.某小组进行如下“简单配合物的形成”的实验活动。
实验用品:试管、胶头滴管:、、、、蒸馏水、乙醇;的、氨水。
按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
固体物质
粉末颜色 白色 深褐色 白色 白色
溶液颜色 _________ 天蓝色 _________ 无色
实验结论 ①溶液中呈无色的主要离子有__________________。②溶液中呈天蓝色的离子为_________。
(2)与氨水反应的实验
①向盛有的试管中滴入几滴氨水实验现象为_________;写出该反应的离子方程式:________________。
②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:__________________。
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:__________________。
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为_________,配位数为_________,配体为_________。
18.金属钴广泛应用于航空航天、电器制造等领域,是一种重要的战略金属,我国钴资源匮乏,绝大多数属于伴生矿。一种以进口水钴矿(主要成分为,杂质中含量较高,还有少量、、、、等)为原料提取钴和铜的工艺流程如图所示。
已知:①、
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子
开始沉淀的pH 2.3 7.5 7.6 3.4 7.6
完全沉淀的pH 2.8 8.3 9.2 5.2 9.8
回答下列问题:
(1)在元素周期表中的位置为_______。
(2)电解溶液提取铜剩余的电解贫液(稀溶液)可返回到_______工序中循环利用。
(3)仅用硫酸很难浸出,加入后发生“还原浸出”,该反应的离子方程式为_______。
(4)沉淀1的主要成分有_______,用调溶液的pH范围是_______。
(5)①的作用是将溶液中的、转化为、沉淀,若过滤后“滤液1”中,当除钙率达到90%时,溶液中_______。
②下图为晶胞和晶胞,两种晶胞中与的配位数之比为_______。
(6)萃取的反应原理为,向有机萃取剂中加入能进行反萃取的原因是_______(结合平衡移动原理解释)。
19.氯霉素(H)是一种抑菌性光谱抗生素,能够阻挠细菌蛋白质的生成,下图是用烃A为原料合成氯霉素的路线图。
回答下列问题:
(1)有机物B的化学名称为_______,G的结构简式为_______。
(2)由选用的无机试剂是_______。
(3)的反应类型是_______。
(4)F中官能团种类有硝基、羟基、_______、_______。
(5)写出的反应方程式:_______。
(6)符合下列条件的B的同分异构体有_______种。
①苯环上有3个取代基;②能发生水解反应。
(7)参照上述流程,设计以A为原料制备有机物的合成路线_______(其他无机试剂任选)。
1.D
A.刚玉(主要成分为)硬度仅次于金刚石,所以不属于分子晶体,事实上氧化铝属于过渡晶体,偏向共价晶体,A不符合题意;
B.氧化铝中铝元素与氧元素之间为离子键,所以属于离子化合物,B不符合题意;
C.铝热剂是铝粉和难熔金属氧化物的混合物,所以氧化铝不能做铝热剂,C不符合题意;
D.氧化铝为离子化合物,熔融状态下可电离成铝离子和氧离子,可导电,D符合题意;
故选D。
2.A
A.正丁烷的结构简式为,其球棍模型为 ,分子结构对称,有2种化学环境不同的氢原子,因此,一氯代物有2种,A正确;
B.同系物具有相同的通式、相同官能团种类和数目,在分子组成上相差若干个“CH2”,苯的同系物应该只有一个苯环,符合通式,且侧链为烷基,因此不是苯的同系物,B错误;
C.羟基为,其电子式为,C错误;
D.乙烯的结构简式为,碳碳双键不能省略,D错误;
故选A。
3.D
A.反应①中生成的二氧化硫与溴水反应生成硫酸和氢溴酸,反应中溴水褪色是二氧化硫表现还原性,故A错误;
B.反应②中少量二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,不能生成亚硫酸氢钠,故B错误;
C.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,硫代硫酸钠转化为硫时,硫元素的化合价降低被还原,硫是反应的还原产物,故C错误;
D.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,反应的化学方程式为Na2S2O3+H2SO4(稀)=Na2SO4+S↓+SO2↑+H2O,由方程式可知,反应消耗 1mol 稀硫酸时,转移2mol电子,故D正确;
故选D。
4.C
既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色物质为烷烃、环烷烃、苯等不含双键、叁键的有机物。
②乙烯、③乙炔、⑥环己烯中均含不饱和键,能使酸性KMnO4溶液褪色,也能与溴水反应使溴水褪色;而①④⑦中均不含双键、三键,则既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色,⑤能使酸性KMnO4溶液褪色,但不能与溴水反应使溴水褪色,故选C。
5.B
A. 该物质的分了式为S4N4,A不正确;
B. 该物质的分子中既含有极性键(S—N)又含有非极性键(N—N),B正确;
C. 该物质形成的晶体是分子晶体,具有较低的熔、沸点,C不正确;
D. 该物质与化合物S2N2不是同素异形体,同素异形体指的是同一元素形成的不同单质,D不正确;
本题选B。
6.D
A.乙酸和乙醇在浓硫酸作用下加热制备乙酸乙酯,由制备原理可知不需温度计测定反应物温度,A不符题意;
B.银镜反应需要热水浴加热即可,不需温度计测定反应物温度,B不符题意;
C.苯和浓硝酸在浓硫酸作用下加热发生取代反应主要有机产物为硝基苯,不需温度计测定反应物温度,C不符题意;
D.乙醇在浓硫酸作用下、140℃时主要发生分子间脱水生成醚,在浓硫酸作用下、170℃时主要发生分子内脱水生成乙烯,温度不同主要产物不同,因此制备乙烯时需要温度计测定反应物温度,D符题意;
答案选D。
7.C
A.a中-CH2-的C为sp3杂化,VSEPR模型为四面体,与之成键的四个原子中有两个不能共面,A正确;
B.b中只含有C=C一种官能团,B正确;
C.c的分子式为C10H16,C错误;
D.d分子中有两种化学环境的H,其一氯代物有两种,D正确;
故选C。
8.B
A. 对羟基苯丙酮酸中苯环为平面结构,与苯环直接相连的碳原子一定在同一平面内,因此分子中在同一平面上的碳原子至少有7个,A项正确,不符合题意;
B. 尿黑酸中只有-COOH能与NaHCO3反应,因此1mol尿黑酸与足量NaHCO3反应,最多消耗1molNaHCO3,B项错误,符合题意;
C. 酪氨酸中含-OH和-NH2,具有酸性和碱性,既能与盐酸反应,又能与氢氧化钠反应,C项正确,不符合题意;
D. 尿黑酸中含酚羟基,酚羟基的邻位和对位能与Br2发生取代反应,因此1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2,D项正确,不符合题意;
答案选B。
9.C
A.根据图示,催化剂表面上看未参加反应,实际上起催化和吸附作用,在反应前后质量和化学性质不变,故A正确;
B.过程Ⅰ只断裂1个O﹣H键,过程Ⅱ又断裂1个O﹣H键;没有新化学键形成,故B正确;
C.根据图示,实际消耗了1个H2O分子,断裂了2个O﹣H键,故C错误;
D.催化剂降低反应所需的活化能,成千上万倍的加快了反应速率,故D正确;
故选:C。
10.D
A.浓缩过程中玻璃棒的作用为搅拌,过滤操作中玻璃棒的作用为引流,两个操作中玻璃棒的作用不同,A正确;
B.甘露醇随乙醇的含量增大而骤减,向浓缩液中加入乙醇可使甘露醇析出,则增大乙醇浓度能够提高甘露醇的析出率,操作①过滤后得到溶剂乙醇和水,所以乙醇可循环利用,B正确;
C.向浓缩液中加入乙醇后,甘露醇溶于水中,甘露醇溶解度随温度的升高而增大,降低温度后甘露醇析出,则操作①是降温冷却;过滤后得到粗品甘露醇,利用甘露醇在水中溶解度随温度变化差异进行重结晶可得到精品甘露醇,C正确;
D.甘露醇为有机醇类物质,灼烧后发生燃烧反应,无法提取精品甘露醇(C6H14O6),所以不能将海带灼烧,D错误;
故答案为:D。
11.BC
A.结合烷烃结构特点,烷烃中,碳原子个数越多其熔沸点越高,同分异构体的烷烃,支链越多其熔沸点越低,所以熔点:2,2一二甲基戊烷>2,3一二甲基丁烷>正戊烷>丙烷,故A错误;
B.三种物质的密度中,CCl4的密度大于1g/mL、水的密度是1g/mL、苯的密度小于1g/mL,所以密度:CCl4>H2O>苯,故B正确;
C.若烃为CxHy,同质量的物质燃烧耗O2量为,显然甲烷消耗氧气最多,大小顺序为甲烷>乙烯>乙炔,故C正确;
D.若有机物为CxHyOz,同物质的量物质燃烧耗O2量为-,消耗氧气为环己烷(C6H12)>苯(C6H6)=苯甲酸(C7H6O2),故D错误;
故选:BC。
12.D
A.属于传统命名法,系统命名法为1,3-二甲苯,故A错误;
B.该有机物为乙二酸二乙酯,故B错误;
C.从离官能团最近的一端开始编号,故该有机物的系统命名法为5-甲基-2-己烯,故C错误;
D.选择含有之恋最多且碳原子数最多的链为主链,该有机物为2,5-二甲基-3-乙基己烷,故D正确;
故选D。
13.C
A.根据化合物P的结构简式可知含有官能团为:羧基、酯基、羰基,三种官能团,A错误;
B.1个羰基1个H2,1个苯环3个H2,1mol化合物P最多可与4mol H2发生反应,B错误;
C.图中红色C为手性碳原子,C正确;
D.与苯环直接相连的碳上有氢结构能使高锰酸钾溶液褪色,如图:,图中红色字氢,属于与苯环直接相连的碳上有氢,能被高锰酸钾氧化,使高锰酸钾溶液褪色,D错误;
故选C
14.BD
A.根据X的结构可以数出其分子式应为C10H8O4, A错误;
B.该分子中只有一个酯基可以发生水解,所以其水解产物只有一种, B正确;
C.分子中存在饱和碳原子,饱和碳原子中原子为立体结构, C错误;
D.分子结构中的酯基氧原子与苯环直接相连,水解之后可生成苯酚,再与氢氧化钠反应,所以该酯基可消耗2mol氢氧化钠,同时分子结构中的羧基还会再消耗1mol氢氧化钠,总计消耗3mol氢氧化钠, D正确;
故选BD。
15.CD
A.甲苯中含有甲基,故甲苯分子中所有原子不可能都在同一平面内,选项A错误;
B.含苯环的同分异构体就有邻、间、对3种结构,含有不含苯环的同分异构体,多于3种,选项B错误;
C.苯甲醇中含有羟基,能够与金属钠反应放出氢气,选项C正确;
D.反应①是甲苯与氯气发生取代反应生成一氯甲苯和氢化氢,反应②是一氯甲苯在氢氧化钠的水溶液中加热发生取代反应生成苯甲醇和氯化钠,反应类型相同,选项D正确;
答案选CD。
16.(1) 4-甲基-4-乙基-1-己炔 3-甲基-3-乙基己烷 6
(2)
(3)
(4)CaC2+2H2OCa(OH)2+CHCH B
(5)CCl2=CH2
(6)AD
17.(1)蓝色 无色 、Na+、Br- Cu2+
(2)出现蓝色沉淀;;;;Cu2+;4;NH3。
18.(1)第四周期Ⅷ族
(2)萃铜
(3)Co2O3+SO+4H+=2Co2++SO+2H2O
(4)Fe(OH)3、Al(OH)3 5.2—7.6
(5)10—3mol/L 3:4
(6)向有机萃取剂中加入H2SO4溶液,溶液中H+浓度增大,平衡左移
19.(1)对硝基乙苯
(2)浓硫酸、浓硝酸
(3)加成反应
(4)羧基 酰胺基
(5)+Br2+HBr
(6)20
(7)
同课章节目录
