化学人教版(2019)选择性必修3 1.2.1研究有机化合物的一般方法 课件(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.2.1研究有机化合物的一般方法 课件(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 63.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-06 14:15:49 | ||
图片预览




文档简介
(共19张PPT)
选择性必修3 第四章 第一节
研究有机化合物的
一般方法
萃取
蒸馏
重结晶
03
第一部分 蒸馏
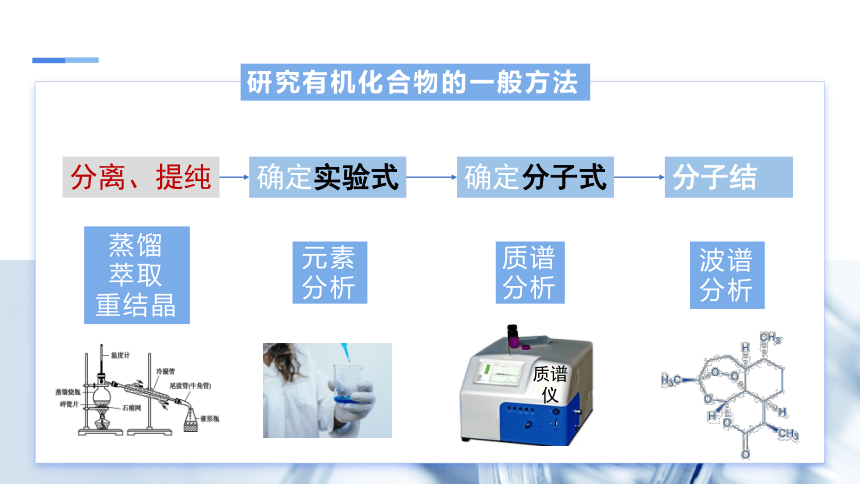
研究有机化合物的一般方法
分离、提纯
确定实验式
确定分子式
分子结构
蒸馏
萃取
重结晶
元素
分析
质谱
分析
波谱
分析
质谱
仪
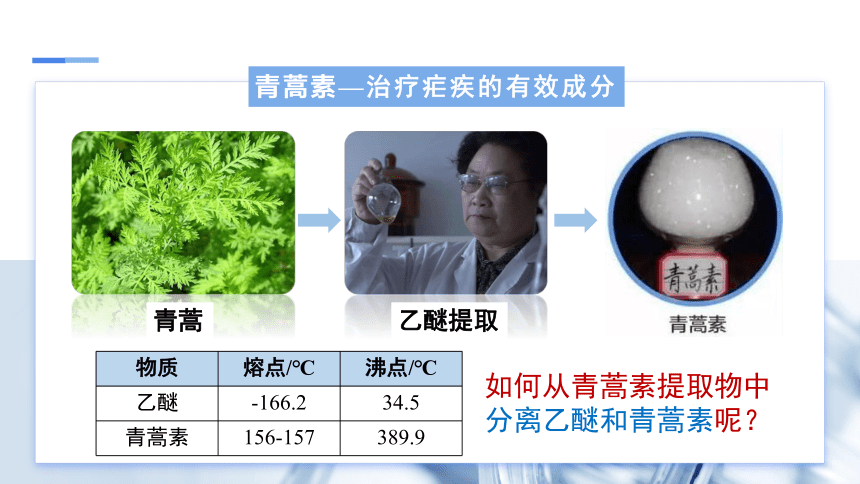
青蒿
青蒿素—治疗疟疾的有效成分
乙醚提取
如何从青蒿素提取物中分离乙醚和青蒿素呢?
物质 熔点/℃ 沸点/℃
乙醚 -166.2 34.5
青蒿素 156-157 389.9
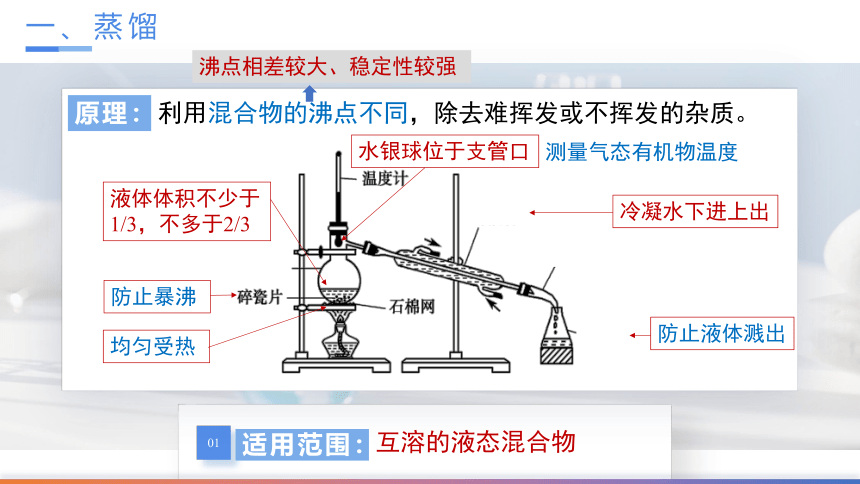
一、蒸馏
适用范围:
互溶的液态混合物
原理:
利用混合物的沸点不同,除去难挥发或不挥发的杂质。
液体体积不少于1/3,不多于2/3
沸点相差较大、稳定性较强
防止暴沸
均匀受热
防止液体溅出
冷凝水下进上出
水银球位于支管口
测量气态有机物温度
第二部分 萃取
二、萃取
液-液萃取
固-液萃取
利用物质在__________的溶剂里__________不同,将有机物______________
_______________的过程。
互不相溶
溶解度
从一种溶剂转移
到另一种溶剂
分液漏斗
恒压分液漏斗
二、萃取
主要仪器
分液漏斗、
烧杯、
铁架台
二、萃取
用CCl4从碘水中提取I2
二、萃取
加水验漏
装液+萃取剂
振荡,放气
静置分层
分液
上层液体:
从分液漏斗
上口倒出
将分液漏斗上口
玻璃塞打开
振荡前 振荡后 结论
上层:棕黄色
下层:无色
上层:接近无色
下层:紫红色
碘:从溶解度小的水溶液转移到了溶解度大的四氯化碳溶液中
【现象记录】
二、萃取
条件:
①萃取剂与原溶剂互不相溶;
②萃取剂溶解溶质能力远大于原溶剂;
③萃取剂和溶质不反应
适用:
分离互不相溶液态有机混合物
常见的萃取剂有:
乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷等。
【思考与讨论】
能否用乙醇作为萃取剂提取碘水中的单质碘?
不能,乙醇与水互溶
第三部分 重结晶
三、重结晶
将晶体用合适的溶剂加热溶解,经趁热过滤、冷却结晶等步骤,再次析出晶体,得到更加纯净的晶体。
1、适用:
固态有机混合物
2、溶剂要求:
1).杂质在此溶剂中溶解度很小或者很大,易于除去。
2).被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
溶解
粗产品
溶液
较纯晶体
冷却结晶
合适溶剂
杂质在热过滤时被滤去
杂质留在母液中,不析出
三、重结晶
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【思考与讨论】
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
1)如何检验提纯后的苯甲酸中氯化钠已被除净?
【思考与讨论】
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
2)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来不便。
【小结】
分离提纯方法 适用对象 性质 实例
萃取
分液
蒸馏
重结晶
互溶的液态混合物
互不相溶的液态混合物
固态混合物
\
沸点差异大
不同溶剂中溶解度不同
不互溶
温度对溶解度影响不同
分离乙酸和乙醇
CCl4提取碘水中的碘
分离汽油和水
提纯苯甲酸
选择性必修3 第四章 第一节
研究有机化合物的
一般方法
萃取
蒸馏
重结晶
03
第一部分 蒸馏
研究有机化合物的一般方法
分离、提纯
确定实验式
确定分子式
分子结构
蒸馏
萃取
重结晶
元素
分析
质谱
分析
波谱
分析
质谱
仪
青蒿
青蒿素—治疗疟疾的有效成分
乙醚提取
如何从青蒿素提取物中分离乙醚和青蒿素呢?
物质 熔点/℃ 沸点/℃
乙醚 -166.2 34.5
青蒿素 156-157 389.9
一、蒸馏
适用范围:
互溶的液态混合物
原理:
利用混合物的沸点不同,除去难挥发或不挥发的杂质。
液体体积不少于1/3,不多于2/3
沸点相差较大、稳定性较强
防止暴沸
均匀受热
防止液体溅出
冷凝水下进上出
水银球位于支管口
测量气态有机物温度
第二部分 萃取
二、萃取
液-液萃取
固-液萃取
利用物质在__________的溶剂里__________不同,将有机物______________
_______________的过程。
互不相溶
溶解度
从一种溶剂转移
到另一种溶剂
分液漏斗
恒压分液漏斗
二、萃取
主要仪器
分液漏斗、
烧杯、
铁架台
二、萃取
用CCl4从碘水中提取I2
二、萃取
加水验漏
装液+萃取剂
振荡,放气
静置分层
分液
上层液体:
从分液漏斗
上口倒出
将分液漏斗上口
玻璃塞打开
振荡前 振荡后 结论
上层:棕黄色
下层:无色
上层:接近无色
下层:紫红色
碘:从溶解度小的水溶液转移到了溶解度大的四氯化碳溶液中
【现象记录】
二、萃取
条件:
①萃取剂与原溶剂互不相溶;
②萃取剂溶解溶质能力远大于原溶剂;
③萃取剂和溶质不反应
适用:
分离互不相溶液态有机混合物
常见的萃取剂有:
乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷等。
【思考与讨论】
能否用乙醇作为萃取剂提取碘水中的单质碘?
不能,乙醇与水互溶
第三部分 重结晶
三、重结晶
将晶体用合适的溶剂加热溶解,经趁热过滤、冷却结晶等步骤,再次析出晶体,得到更加纯净的晶体。
1、适用:
固态有机混合物
2、溶剂要求:
1).杂质在此溶剂中溶解度很小或者很大,易于除去。
2).被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
溶解
粗产品
溶液
较纯晶体
冷却结晶
合适溶剂
杂质在热过滤时被滤去
杂质留在母液中,不析出
三、重结晶
称量
加热溶解
趁热过滤
冷却结晶
过滤洗涤、
干燥、称量
为了减少趁热过滤过程中损失的苯甲酸
实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【思考与讨论】
加热溶解——搅拌,加速苯甲酸溶解;
趁热过滤——引流;
冷却结晶后过滤——引流
1)如何检验提纯后的苯甲酸中氯化钠已被除净?
【思考与讨论】
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
2)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。若温度过低,杂质的溶解度也会降低而析出杂质;另外温度低于0℃,水结冰,给实验带来不便。
【小结】
分离提纯方法 适用对象 性质 实例
萃取
分液
蒸馏
重结晶
互溶的液态混合物
互不相溶的液态混合物
固态混合物
\
沸点差异大
不同溶剂中溶解度不同
不互溶
温度对溶解度影响不同
分离乙酸和乙醇
CCl4提取碘水中的碘
分离汽油和水
提纯苯甲酸
