2023年中考化学复习专题 化学方程式的计算课件(共31张PPT)
文档属性
| 名称 | 2023年中考化学复习专题 化学方程式的计算课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-06 17:57:41 | ||
图片预览










文档简介
(共31张PPT)
第三部分 特色题型集中练
化学方程式的计算
类型一 文字叙述类
1. 铁红的主要成分是Fe2O3,含少量固体杂质,常用作红色涂料,也可用于生产某种工业催化剂,其反应原理为2Fe2O3+3C ====== 4Fe+3CO2↑。现将木炭粉和铁红的固体混合物53.2 kg高温加热,木炭粉与铁红中的Fe2O3恰好完全反应,冷却,称量,剩余固体混合物的质量为40 kg(铁红中的杂质不参加反应且全部留在剩余固体混合物中)。
高温
(1)Fe2O3中铁元素的质量分数是__________。
(2)生成CO2的质量是__________kg。
(3)反应后固体混合物中Fe的质量分数是多少?
70%
13.2
高温
2.国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与NaOH反应的方法。某同学称取15 g(NH4)2SO4样品(杂质不含氮元素),与足量的NaOH混合后,放入试管中加热,发生如下反应:(NH4)2SO4+2NaOH=======Na2SO4+2H2O+2NH3↑。充分反应后共收集到3.4 g NH3。
(1)(NH4)2SO4中氮元素的质量分数是__________。(精确到0.1%)
加热
21.2%
(2)样品中(NH4)2SO4的质量。(写出计算过程)
加热
(3)合格的(NH4)2SO4化肥中(NH4)2SO4的质量分数需达到94.3%~99%,通过计算判断上述样品是否合格?(写出计算过程)
类型二 表格类
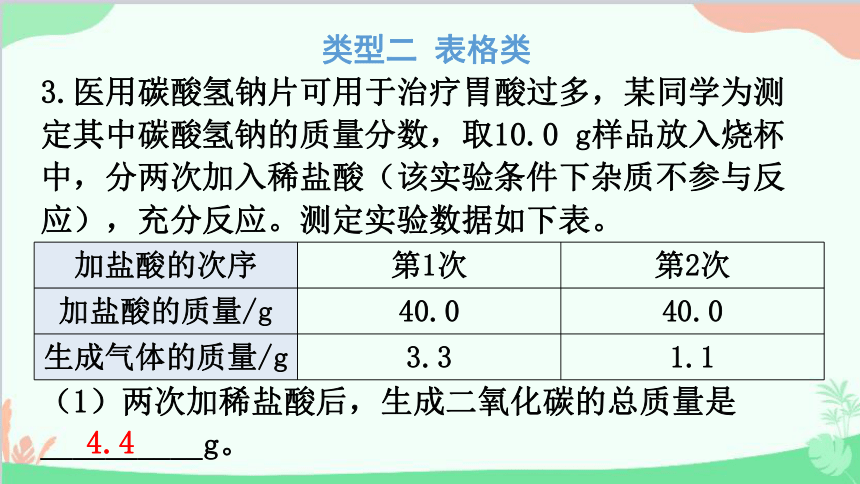
3.医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0 g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如下表。
(1)两次加稀盐酸后,生成二氧化碳的总质量是__________g。
加盐酸的次序 第1次 第2次
加盐酸的质量/g 40.0 40.0
生成气体的质量/g 3.3 1.1
4.4
(2)求该样品中碳酸氢钠的质量分数。(写出计算过程)
加入次序 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 40 40 40 40
充分反应后剩余固体的质量/g 18.5 12 10 m
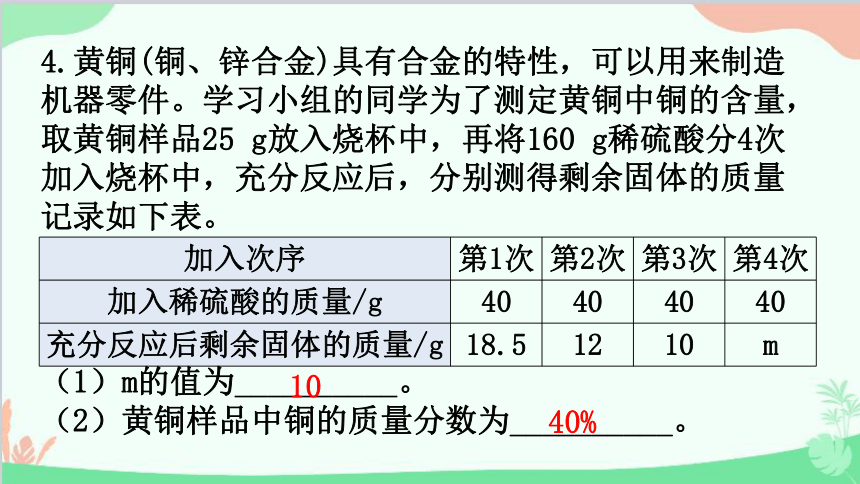
4.黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25 g放入烧杯中,再将160 g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下表。
(1)m的值为__________。
(2)黄铜样品中铜的质量分数为__________。
10
40%
(3)求所用稀硫酸的溶质质量分数。 (写出计算过程,结果精确到0.1%)
类型三 图像类
5.化学小组参与“铅蓄废电池中硫酸回
收”的研学项目,回收时需要测定电池
废液中硫酸的质量分数。向装有50 g废
液的锥形瓶中加入质量分数为20%的氢氧
化钠溶液并充分搅拌,利用温度传感器等电子设备采集信息并绘制成图T10-1。(杂质可溶但不参加反应)
(1)该反应是________(填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为__________℃。
放热
t3
(3)求废液中硫酸的质量分数。(写出计算过程)
(4)配制上述实验所用的氢氧化钠溶液。
①氢氧化钠固体放在玻璃器皿中称量的原因是___________________________________;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果__________(填“偏大”“偏小”或“不变”)。
氢氧化钠固体易潮解,且腐蚀性较强
偏小
6.往盛有4.0 g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图T10-2所示。
(1)充分反应后,产生氢气的
质量是__________。
(2)刚开始滴加稀盐酸时,没有
氢气放出的原因是_______________________________
____________________________。
0.4 g
铝片表面的氧化铝先与稀盐酸反应,没有氢气产生
(3)求该铝片中铝的质量分数。(写出计算过程)
7. 建筑工地上有一堆放置时间较长的石灰乳,想知道该石灰乳是否变质,某同学设计了下列实验探究。取17.4 g样品,逐渐加入一定浓度的稀盐酸,加入稀盐酸与生成CO2的质量关系如图T10-3甲所示。
(1)生成4.4 g CO2消耗的稀盐酸质量是_______。
50 g
(2)计算石灰石样品中CaCO3的质量分数。(写出计算过程,计算结果保留到0.1%)
(3)若向完全反应后的溶液中加入10.6%的Na2CO3溶液,请画出加入Na2CO3溶液的质量与产生沉淀质量的关系图。(在图T10-3乙的坐标中作图,并标出曲线拐点的坐标)
如答图T10-1所示。
类型四 综合类
8. MnO2因应用广泛而备受关注。某研究小组采用图T10-4甲装置通过焙烧MnCO3制取MnO2,发生反应的化学
方程式为2MnCO3+O2 ======= 2CO2+2MnO2。
△
(1)实验过程中,石英管内剩余固体的质量和成分随温度的变化如图T10-4乙所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于__________℃。
(2)若加热到300~900 ℃时,锰的氧化物会分解产生一种常见气体,该气体为__________(填化学式)。
300
O2
(3)试根据化学方程式求46.0 g MnCO3通过熔烧最多制得的MnO2的质量是多少?(写出计算过程)
(4)若把反应温度控制在900 ℃,充分反应后管内剩余固体的质量为__________g。
28.4
△
9.金属铍(Be)是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的宝贵材料,有着“超级金属”之称,制备金属Be的原料是绿柱石,其主要成分有BeO、Al2O3、SiO2、Fe2O3和FeO,制备工艺流程如图T10-5所示。已知:①“氧化”时发生反应:2FeSO4+H2SO4+H2O2 == 7Fe2(SO4)3+2H2O;②(NH4)2BeF4易溶于水,且在水中的溶解度随温度升高显著增大。
(1)“酸浸”后的滤液中含有_____种阳离子。
(2)滤渣2的主要成分是Fe(OH)3和__________(填化学式)。
(3)(NH4)2BeF4溶液经蒸发浓缩、________________________、过滤、洗涤、干燥等操作后可得到(NH4)2BeF4晶体。
5
Al(OH)3
冷却结晶(或降温结晶)
(4)金属的表面易形成致密氧化膜。由此预测铍的金属活动性比铜_____(填“强”或“弱”)。将未经打磨的铍丝放入装有少量稀盐酸的试管中,若观察到____________________________________________(填实验现象),说明预测正确。
强
开始没有气泡产生,一段时间后有气泡产生
(5)用绿柱石生产出90 kg金属Be,需要消耗多少质量的金属Mg?
高温
真空
10.每年排放的二氧化碳近一半存留在大气层,其他被陆地和海洋吸收。人类大量使用煤、石油和天然气等化石燃料,砍伐森林,导致过量的二氧化碳进入海洋,使海洋酸化,表层海水平均pH从8.1下降到7.9。人类给海洋的二氧化碳越多,海水pH越小,吸收二氧化碳的能力就会相对减弱,这样的循环会导致海洋生物链发生变化。垃圾焚烧发电是生活垃圾处理的有效方式之一,但垃圾焚烧会产生烟尘和有害气体,还会增加
二氧化碳的排放,加剧海洋酸化;同时垃圾焚烧需要购买辅助燃料,成本较高。我国烟气处理协同P2G技术很好地解决了这些问题,其主要流程如图T10-6所示。
(1)下列有关海洋酸化的说法不正确的是____(填字母)。
A.海洋酸化是指表层海水呈酸性
B.海洋酸化会导致气候变暖加剧
C.海洋酸化不会影响海洋生物及其生态系统
D.海洋酸化会改变海水中某些离子的浓度
C
除去烟尘和有害气体
O2和N2
二氧化碳被利用转化为甲烷,循环利用或节约资源(合理即可)
(2)流程中“净化装置”的作用是_________________________,“其他气体”的主要成分有__________(填化学式)等气体。
(3)使用P2G技术的优点是______________________________________________________________(写一条)。
(4)“甲烷化装置”中发生的化学反应是CO2+4H2 ======= CH4+2X,其中X是__________(填化学式)。
催化剂
H2O
(5)若用P2G技术处理550 kg二氧化碳,使其完全反应。请根据化学方程式计算生成甲烷的质量。(写出计算过程)
催化剂
谢 谢!
第三部分 特色题型集中练
化学方程式的计算
类型一 文字叙述类
1. 铁红的主要成分是Fe2O3,含少量固体杂质,常用作红色涂料,也可用于生产某种工业催化剂,其反应原理为2Fe2O3+3C ====== 4Fe+3CO2↑。现将木炭粉和铁红的固体混合物53.2 kg高温加热,木炭粉与铁红中的Fe2O3恰好完全反应,冷却,称量,剩余固体混合物的质量为40 kg(铁红中的杂质不参加反应且全部留在剩余固体混合物中)。
高温
(1)Fe2O3中铁元素的质量分数是__________。
(2)生成CO2的质量是__________kg。
(3)反应后固体混合物中Fe的质量分数是多少?
70%
13.2
高温
2.国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与NaOH反应的方法。某同学称取15 g(NH4)2SO4样品(杂质不含氮元素),与足量的NaOH混合后,放入试管中加热,发生如下反应:(NH4)2SO4+2NaOH=======Na2SO4+2H2O+2NH3↑。充分反应后共收集到3.4 g NH3。
(1)(NH4)2SO4中氮元素的质量分数是__________。(精确到0.1%)
加热
21.2%
(2)样品中(NH4)2SO4的质量。(写出计算过程)
加热
(3)合格的(NH4)2SO4化肥中(NH4)2SO4的质量分数需达到94.3%~99%,通过计算判断上述样品是否合格?(写出计算过程)
类型二 表格类
3.医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0 g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如下表。
(1)两次加稀盐酸后,生成二氧化碳的总质量是__________g。
加盐酸的次序 第1次 第2次
加盐酸的质量/g 40.0 40.0
生成气体的质量/g 3.3 1.1
4.4
(2)求该样品中碳酸氢钠的质量分数。(写出计算过程)
加入次序 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 40 40 40 40
充分反应后剩余固体的质量/g 18.5 12 10 m
4.黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25 g放入烧杯中,再将160 g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下表。
(1)m的值为__________。
(2)黄铜样品中铜的质量分数为__________。
10
40%
(3)求所用稀硫酸的溶质质量分数。 (写出计算过程,结果精确到0.1%)
类型三 图像类
5.化学小组参与“铅蓄废电池中硫酸回
收”的研学项目,回收时需要测定电池
废液中硫酸的质量分数。向装有50 g废
液的锥形瓶中加入质量分数为20%的氢氧
化钠溶液并充分搅拌,利用温度传感器等电子设备采集信息并绘制成图T10-1。(杂质可溶但不参加反应)
(1)该反应是________(填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为__________℃。
放热
t3
(3)求废液中硫酸的质量分数。(写出计算过程)
(4)配制上述实验所用的氢氧化钠溶液。
①氢氧化钠固体放在玻璃器皿中称量的原因是___________________________________;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果__________(填“偏大”“偏小”或“不变”)。
氢氧化钠固体易潮解,且腐蚀性较强
偏小
6.往盛有4.0 g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图T10-2所示。
(1)充分反应后,产生氢气的
质量是__________。
(2)刚开始滴加稀盐酸时,没有
氢气放出的原因是_______________________________
____________________________。
0.4 g
铝片表面的氧化铝先与稀盐酸反应,没有氢气产生
(3)求该铝片中铝的质量分数。(写出计算过程)
7. 建筑工地上有一堆放置时间较长的石灰乳,想知道该石灰乳是否变质,某同学设计了下列实验探究。取17.4 g样品,逐渐加入一定浓度的稀盐酸,加入稀盐酸与生成CO2的质量关系如图T10-3甲所示。
(1)生成4.4 g CO2消耗的稀盐酸质量是_______。
50 g
(2)计算石灰石样品中CaCO3的质量分数。(写出计算过程,计算结果保留到0.1%)
(3)若向完全反应后的溶液中加入10.6%的Na2CO3溶液,请画出加入Na2CO3溶液的质量与产生沉淀质量的关系图。(在图T10-3乙的坐标中作图,并标出曲线拐点的坐标)
如答图T10-1所示。
类型四 综合类
8. MnO2因应用广泛而备受关注。某研究小组采用图T10-4甲装置通过焙烧MnCO3制取MnO2,发生反应的化学
方程式为2MnCO3+O2 ======= 2CO2+2MnO2。
△
(1)实验过程中,石英管内剩余固体的质量和成分随温度的变化如图T10-4乙所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于__________℃。
(2)若加热到300~900 ℃时,锰的氧化物会分解产生一种常见气体,该气体为__________(填化学式)。
300
O2
(3)试根据化学方程式求46.0 g MnCO3通过熔烧最多制得的MnO2的质量是多少?(写出计算过程)
(4)若把反应温度控制在900 ℃,充分反应后管内剩余固体的质量为__________g。
28.4
△
9.金属铍(Be)是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的宝贵材料,有着“超级金属”之称,制备金属Be的原料是绿柱石,其主要成分有BeO、Al2O3、SiO2、Fe2O3和FeO,制备工艺流程如图T10-5所示。已知:①“氧化”时发生反应:2FeSO4+H2SO4+H2O2 == 7Fe2(SO4)3+2H2O;②(NH4)2BeF4易溶于水,且在水中的溶解度随温度升高显著增大。
(1)“酸浸”后的滤液中含有_____种阳离子。
(2)滤渣2的主要成分是Fe(OH)3和__________(填化学式)。
(3)(NH4)2BeF4溶液经蒸发浓缩、________________________、过滤、洗涤、干燥等操作后可得到(NH4)2BeF4晶体。
5
Al(OH)3
冷却结晶(或降温结晶)
(4)金属的表面易形成致密氧化膜。由此预测铍的金属活动性比铜_____(填“强”或“弱”)。将未经打磨的铍丝放入装有少量稀盐酸的试管中,若观察到____________________________________________(填实验现象),说明预测正确。
强
开始没有气泡产生,一段时间后有气泡产生
(5)用绿柱石生产出90 kg金属Be,需要消耗多少质量的金属Mg?
高温
真空
10.每年排放的二氧化碳近一半存留在大气层,其他被陆地和海洋吸收。人类大量使用煤、石油和天然气等化石燃料,砍伐森林,导致过量的二氧化碳进入海洋,使海洋酸化,表层海水平均pH从8.1下降到7.9。人类给海洋的二氧化碳越多,海水pH越小,吸收二氧化碳的能力就会相对减弱,这样的循环会导致海洋生物链发生变化。垃圾焚烧发电是生活垃圾处理的有效方式之一,但垃圾焚烧会产生烟尘和有害气体,还会增加
二氧化碳的排放,加剧海洋酸化;同时垃圾焚烧需要购买辅助燃料,成本较高。我国烟气处理协同P2G技术很好地解决了这些问题,其主要流程如图T10-6所示。
(1)下列有关海洋酸化的说法不正确的是____(填字母)。
A.海洋酸化是指表层海水呈酸性
B.海洋酸化会导致气候变暖加剧
C.海洋酸化不会影响海洋生物及其生态系统
D.海洋酸化会改变海水中某些离子的浓度
C
除去烟尘和有害气体
O2和N2
二氧化碳被利用转化为甲烷,循环利用或节约资源(合理即可)
(2)流程中“净化装置”的作用是_________________________,“其他气体”的主要成分有__________(填化学式)等气体。
(3)使用P2G技术的优点是______________________________________________________________(写一条)。
(4)“甲烷化装置”中发生的化学反应是CO2+4H2 ======= CH4+2X,其中X是__________(填化学式)。
催化剂
H2O
(5)若用P2G技术处理550 kg二氧化碳,使其完全反应。请根据化学方程式计算生成甲烷的质量。(写出计算过程)
催化剂
谢 谢!
同课章节目录
