人教版选修3专题2第2节第二课时动物细胞融合与单克隆抗体(共47张PPT)
文档属性
| 名称 | 人教版选修3专题2第2节第二课时动物细胞融合与单克隆抗体(共47张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2014-09-11 14:06:59 | ||
图片预览











文档简介
课件47张PPT。第九章
细胞融合 与 单克隆抗体
Cell Fusion and Monoclonal Antibodies 第一节 动物细胞融合概述细胞融合研究进展
动物细胞融合常用方法
杂交细胞的筛选
Muller于1838年观察到脊椎动物肿瘤细胞能在体内自发地融合产生多核的肿瘤细胞。
Virchow于1858年描述了正常组织、发炎组织以及肿瘤组织中的多核细胞现象。
Luginbuhl于1873年观察到天花病人的血液中也有多核的血细胞存在。
Lange于1875年第一个观察到脊椎动物(蛙类)的血液细胞发生融合的过程。
Cienkawski(1876)、Buck(1877)、Geddes(1880)在无脊椎动物中发现细胞融合现象。
1958年日本学者冈田(Okada)发现仙台病毒具有触发动物细胞融合的效应。
1974年华裔加拿大学者高国楠创立了聚乙二醇(PEG)化学融合法。
1975年Kohler和Milstein成功地融合了小鼠B-淋巴细胞和骨髓瘤细胞而产生可以分泌
预定单克隆抗体的杂交瘤细胞。
20世纪80年代出现了电融合技术。一、细胞融合研究进展二、动物细胞融合常用方法病毒诱导细胞融合
PEG诱导细胞融合
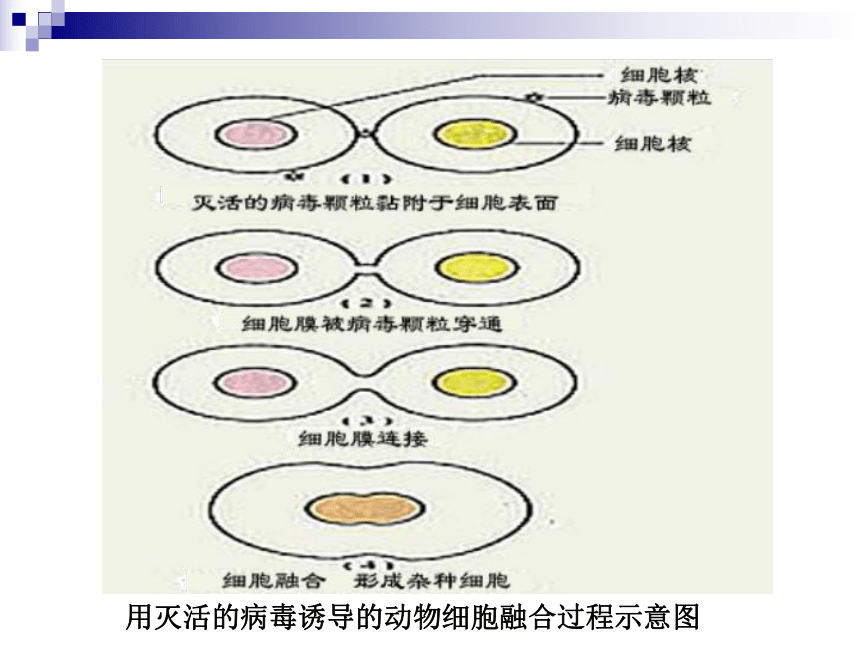
电诱导细胞融合法用灭活的病毒诱导的动物细胞融合过程示意图 抗体的结构与功能
单克隆抗体的制备和生产
单克隆抗体的改造和应用
第二节 单克隆抗体 一、抗体的结构与功能抗体是由B细胞受抗原刺激后分泌的蛋白质。
抗体分子:四条肽链组成,两条重链(H链)两条轻链(L链)。
结合区:抗体分子上有两个抗原结合区
可变区(V区)
稳定区(C区) 人体内的五种抗体 二、单克隆抗体的制备单克隆抗体技术(monclonal antibody technology)
通常称B淋巴细胞杂交瘤技术,它是1975年英国学者George Kohler与阿根廷学者Cesar Milstein成功将经过绵羊红细胞免疫的小鼠脾脏细胞与体外培养的小鼠骨髓瘤细胞融合在一起,并获得了能产生特异性抗羊红血球单抗的杂交瘤细胞株,杂交瘤细胞既能在体外快速生长,又能持续分泌成分单一的特异性抗体,这种单一类型的、只针对某一特定抗原决定簇的抗体分子,就是单克隆抗体。为此他们荣获1984年度的诺贝尔医学及生理学奖。
The Nobel Prize in Physiology or Medicine 1984
"for the discovery of the principle for production of
monoclonal antibodies"Georges J.F. Koehler
Federal Republic of Germany
Basel Institute for Immunology Basel, Switzerland
b. 1946 d. 1995 Car Milstein
Argentina and United Kingdom
MRC Laboratory of Molecular Biology Cambridge, United Kingdom
b. 1927(in Bahia Blanca, Argentina) d. 2002 单抗的制备过程1.动物免疫与亲本细胞选择
2.细胞融合:淋巴细胞杂交瘤的制备
3.杂交瘤细胞的筛选
4.抗体阳性杂交瘤细胞的筛选
5.抗体阳性杂交瘤细胞株的克隆化培养
6.单克隆抗体的制备和冻存
7.单克隆抗体的纯化 1.动物免疫与亲本细胞的选择免疫方法:体内免疫法或体外免疫法。
体内免疫法:
颗粒性抗原可直接注射入小鼠体内,可溶性抗原则与等量的弗氏完全佐剂混合后注入体内进行初次免疫;
追加免疫1~2次后,在无菌条件下取出脾或淋巴结并制成细胞悬液,细胞存活率在95%以上的用于融合。
体外免疫法:
直接分离大/小鼠淋巴细胞,调整密度为107个/ml,加入适当浓度抗原,CO2箱中培养;
4~5天后,收集被刺激的淋巴细胞,进行细胞融合。淋巴细胞:经过免疫处理的淋巴细胞,多用大/小鼠骨髓瘤细胞:一般不分泌抗体,能在体外无限繁殖和连续继代培养,且为HPRT-或TK-。多用BALB/C 小鼠的骨髓瘤细胞。 2.细胞融合:淋巴细胞杂交瘤的制备将免疫脾细胞和骨髓瘤细胞以2:1~10:1的比例混匀于50ml锥形离心管内,1200rpm离心7~10分钟,尽量吸净上清液,手指轻击管壁使管底沉淀的细胞铺展成薄层;
室温条件下,边轻轻振摇离心管边在60秒钟内逐滴加入PEG融合液,随后静置90秒;
再于5分钟内,边振摇边逐滴加入培养液或盐水缓冲液以终止PEG的作用,再静置10分钟。 3.杂交瘤细胞的筛选加HAT培养基,稀释至细胞不超过2×105/ml;
将细胞悬液加入含有饲养细胞的96孔培养板内,每孔0.1ml,若为24孔板,每孔0.5ml;
每隔2~3天半量换液,7天后可选择出杂交瘤细胞
细胞融合的选择示意图HAT选择系统HAT是含一定浓度次黄嘌呤(H)、氨基喋呤(A)、胸腺嘧啶核苷(T)的一种选择性培养基,其中三种成分与细胞DNA合成有关。
DNA合成途径有两种:杂交瘤技术中,常选用次黄嘌呤鸟嘌呤磷酸核糖转移酶缺陷(HPRT-)骨髓瘤细胞或者是胸腺嘧啶核苷激酶缺陷型(TK-)骨髓瘤细胞为亲本之一;HPRT-细胞的嘌呤核苷酸与TK-细胞的嘧啶核苷酸只能由全合成途径产生。
含氨基喋呤培养基抑制了细胞内嘌呤和嘧啶的全合成途径。
嘌呤核苷酸合成通路的阻断淋巴细胞具有合成DNA的两条途径。
杂种细胞通过互补作用获得HRPT或TK基因,可应用培养基中次黄嘌呤及胸腺嘧啶核苷,通过补救合成途径合成DNA。
在HAT培养基中,HPRT-或TK- 亲本细胞死亡,淋巴细胞亦逐渐死亡,只有杂种细胞存活。
4.抗体阳性杂交瘤细胞的筛选通过选择性培养后生长的杂交瘤细胞,仅有部分是分泌预定特异性抗体的杂交瘤细胞。从融合后8~9天后即可取培养上清进行抗体检测,根据抗原的性质、抗体类型及所需灵敏度等具体情况来加以选择。
颗粒性抗原可采用免疫荧光、51Cr释放试验、溶血空斑测定、补体依赖的细胞毒等方法来直接测定针对这些抗原的抗体。
可溶性抗原可以采用放射免疫、免疫酶标测定、间接血凝等方法测定。
5.抗体阳性杂交瘤细胞株的克隆化培养利用单个细胞培养技术选育出遗传稳定的分泌特异抗体的细胞系。
克隆化培养过程中,一般要加能释放某些生长因子、促进杂交瘤生长的饲养细胞,例如小鼠的腹腔巨噬细胞、脾细胞或胸腺细胞等。
克隆化培养方法有有限稀释法、软琼脂培养法、显微操作法、应用流式等。有限稀释法通过适当的稀释达到分离单个细胞进行培养的目的
1)取出阳性孔内的细胞进行计数;
2)用培养液将其稀释到如10个细胞/ml;
3)于96孔板内每孔加0.1ml,其机率将为每孔落入
一个细胞;
4)加入一定数量的饲养细胞,经过8~12天后,可以
观察到有集落生长的孔;
5)根据检测的阳性结果再次进行克隆化培养。软琼脂培养法在无菌平皿内铺上一层0.5%的琼脂,待凝固后再铺上一层混有杂交瘤细胞和饲养层细胞的0.25%的软琼脂。待细胞长成集落后,可用毛细管吸出小球样团块,移种于含有饲养细胞的96孔板内,继续培养。
6.单克隆抗体的大量制备和冻存1)动物体内诱生法
将降脂烷或石蜡油注入Balb/c小鼠腹腔,0.5ml/只;1~2周后腹腔接种1×106个杂交瘤细胞;7~12天后可抽取腹水,离心去细胞沉淀,取上清夜或纯化单抗或冻存。每毫升腹水中约含5~20mg单抗。
2)利用微载体、微囊、旋转瓶、中空纤维培养系统等进行大规模培养。动物体内诱生法制备单克隆抗体纯化具体方法及过程
1、澄清和沉淀处理
小鼠腹水中含有红细胞、细胞碎块、纤维蛋白凝块及脂质等,首先用离心力1000g离心5min,去除残留的小颗粒物质;再用0.2?m的微孔滤膜过滤除掉污染的细菌、支原体和脂质;最后用饱和硫酸铵沉淀抗体,50%饱和硫酸铵能回收90%以上的单抗。
2、分离
主要分离方法包括凝胶过滤、阴离子交换层析、亲和层析等。 7.单克隆抗体的纯化 (1)凝胶过滤
用于IgG和IgM类单克隆抗体的分离纯化。
常用Sephadex G200作分离介质,可收集到三个峰最高峰为IgM,另两个峰为IgG,
抗体回收率50%~80%,能去除污染的微量杂蛋白,抗体纯度可达95%以上。
(2)阴离子交换层析
用于IgG类单克隆抗体的分离纯化。
在pH7.4条件下,IgG1和IgG2能结合在DEAE填料上,其中IgG2a可在较低离子强度条件下洗脱下来,纯度较高。IgG2b、IgG3在低离子强度下易发生沉淀,可增加离子强度以提高产量,但纯度相对较低。在pH5.5条件下,把杂交瘤细胞培养上清液加到琼脂糖柱上时,所有抗体都能结合到柱上,而55%的杂蛋白可以被洗脱掉,再用不同离子强度的洗脱剂洗下。
在最适离子强度及pH条件下,以离子交换层析来分离单克隆抗体可以纯化25~100倍。高容量、高流速、化学稳定的新型离子交换剂适宜单克隆抗体的大规模纯化。
(3)亲和层析
多用蛋白A亲和层析,适用于IgG类单克隆抗体的纯化
IgG与蛋白A的结合与pH有密切关系,鼠源性单抗在pH8.0时,IgG2b、IgG3几乎全部结合于蛋白A柱上,IgG1稍差,用pH3.5缓冲液可洗脱IgG2b,pH4.0缓冲液可洗脱IgG3,pH4.5缓冲液可洗脱IgG2a,pH6.0可洗脱IgG1。
用蛋白A亲和层析收获的抗体纯度很高,但也有极微量的杂蛋白。 三、单克隆抗体的改造和应用单抗作为体内体外诊断试剂在临床生化诊断、病理组织定位、体内肿瘤的定位等
单克隆抗体靶向制剂,治疗癌症等疾病
单抗作为体内体外诊断试剂现已有各种不同类型的单抗试剂盒在市场出售,例如乙型肝炎表面抗原、铁蛋白、促绒毛膜性激素、促甲状腺激素、癌症、艾滋病等体外单抗诊断试剂。
利用同位素标记单抗在特定组织中成象的技术可用于肿瘤、心血管畸形的体内诊断单克隆抗体靶向制剂1)药物与单抗直接偶联
通过化学反应使药物分子的氨基与抗体分子的羧基之间直接形成稳定的酰胺键。
利用氧化剂把药物分子上的糖基氧化成羰基,羰基与抗体分子的氨基反应形成西佛氏碱,最后还原。
这样的靶向制剂保留一定的药物活性,并具有一定的选择性。例如1,4-溴柔红霉素与肿瘤细胞单抗形成的偶合物,对肿瘤有明显的选择性毒性。2)药物通过小分子与单抗连接
通过一些小分子交联剂,把药物分子上的某些基团和单抗连接起来。
小分子交联剂如同型双功能试剂:戊二醛、顺乌头酸酐、马来酸酐、戊二酐;异型双功能试剂:N-琥珀酰胺基-3-丙酸、寡肽等。
顺乌头酸酐制成的靶向制剂最常用。该靶向制剂在中性条件下较稳定,在酸性条件下容易发生水解。与肿瘤的表面抗原结合后,会进入溶酶体,在酸性环境下释放药物,而杀死肿瘤细胞。3)药物通过大分子与抗体相连
大分子聚合物如葡聚糖、多聚赖氨酸、多聚谷氨酸、聚合多肽和血清蛋白等。
人源单克隆抗体缺乏合适的人骨髓瘤细胞株作为融合亲本。
获得抗原特异的人B淋巴细胞十分困难,对人来说,高度免疫获得抗原特异的B淋巴细胞的方法显然是不可行的。
大量繁殖杂交瘤细胞以获得所需量的抗体较困难,鼠类杂交瘤可以通过小鼠腹腔接种杂交瘤细胞诱生腹水达到目的,人杂交瘤细胞在鼠类中诱生腹水是很十分困难的。 迄今构建人淋巴细胞杂交瘤产生人源单克隆抗体的技术远没有鼠类淋巴杂交瘤技术成熟。有三个主要困难:方法1:分离人B淋巴细胞,使之与荧光标记的抗原相结合,通过荧光标记选择能够产生特异抗体的B淋巴细胞,并用Epstein-Barr病毒转化,最后得到少量的单抗。
方法2:将人源免疫干细胞导入缺失大部分免疫细胞的小鼠体内,遇到抗原时,产生人源的抗体。
方法3:将改造过的人的抗体基因导入鼠胚胎中,能在免疫后得到产生人抗体的转基因鼠。基因工程抗体改造鼠源性单克隆抗体的目的:一是降低免疫原性;二是降低相对分子量,增加组织通透性。
如将鼠源性单克隆抗体的C区用人的Ig分子的C区置换则对人的免疫原性消失。对鼠源性抗体的改造有很多成果报道,包括:
--人-鼠嵌合抗体(人IgC-小鼠IgV,150000)
--改形抗体(将小鼠CDRs替换为人CDRs,150000)
--Fab(完整L链和Fd,50000)
--FV(VH和VL,25000)
--单链抗体(SCFV,VH-多肽-VL,27000)
--单域抗体(VH或VL,12500)及最小识别单位(MRU)
(一个CDR,<2000)杂交人-鼠单克隆抗体抗体同抗原结合的功能决定于抗体分子的V区,同种型免疫原性决定于抗体分子的C区。
在基因水平上把鼠源性单抗的VH和VL分离出来分别与人IgCH和CL连接成人-鼠嵌合体H和L链基因,再共转染骨髓瘤细胞,就能表达出完整的人-鼠嵌合抗体。单链抗体在大肠杆菌的系统中,可以表达VL-衔接物-VH的序列,产生单链抗体。
单链FV片段:抗体分子量小、免疫原性较低,渗透性好,用于实体肿瘤的诊断和治疗。
生物导弹:利用单链抗体序列接上一段药物蛋白的编码序列,表达后的蛋白可根据抗原抗体反应而达到专一性治疗疾病的目的。
双功能抗体片段:两个抗原结合特异性不同的Fab或Fv片段通过二硫键连接起来,如一个结合肿瘤特异性抗原,一个结合杀伤性T细胞,识别和消灭肿瘤细胞的功能可统一在一个单链抗体分子上。抗体融合蛋白将抗体的可变区与一非抗体蛋白融合起来,使融合蛋白继承有抗体分子的结合特异性。可以保留不同程度的抗体结合特异性以及激发其他免疫反应的能力。
抗体酶一种对酶促反应过渡态特异的抗体。结合酶与抗体的优点,既可以起酶促催化作用,又可以起抗体的选择性和专一性结合抗原的作用。
制备抗体酶的方法:
1)利用与过渡态结构相类似的半抗原通过杂交瘤技术生产抗体酶。
2)利用定向催化,即利用抗体的特异性和亲和性使催化反应的两种底物按一定的构象结合并定向,从而降低底物分子的自由度,反应速度加快。
3)对抗体进行化学修饰,使抗体与催化基团相连。本章结束谢谢!
Cell Fusion and Monoclonal Antibodies 第一节 动物细胞融合概述细胞融合研究进展
动物细胞融合常用方法
杂交细胞的筛选
Muller于1838年观察到脊椎动物肿瘤细胞能在体内自发地融合产生多核的肿瘤细胞。
Virchow于1858年描述了正常组织、发炎组织以及肿瘤组织中的多核细胞现象。
Luginbuhl于1873年观察到天花病人的血液中也有多核的血细胞存在。
Lange于1875年第一个观察到脊椎动物(蛙类)的血液细胞发生融合的过程。
Cienkawski(1876)、Buck(1877)、Geddes(1880)在无脊椎动物中发现细胞融合现象。
1958年日本学者冈田(Okada)发现仙台病毒具有触发动物细胞融合的效应。
1974年华裔加拿大学者高国楠创立了聚乙二醇(PEG)化学融合法。
1975年Kohler和Milstein成功地融合了小鼠B-淋巴细胞和骨髓瘤细胞而产生可以分泌
预定单克隆抗体的杂交瘤细胞。
20世纪80年代出现了电融合技术。一、细胞融合研究进展二、动物细胞融合常用方法病毒诱导细胞融合
PEG诱导细胞融合
电诱导细胞融合法用灭活的病毒诱导的动物细胞融合过程示意图 抗体的结构与功能
单克隆抗体的制备和生产
单克隆抗体的改造和应用
第二节 单克隆抗体 一、抗体的结构与功能抗体是由B细胞受抗原刺激后分泌的蛋白质。
抗体分子:四条肽链组成,两条重链(H链)两条轻链(L链)。
结合区:抗体分子上有两个抗原结合区
可变区(V区)
稳定区(C区) 人体内的五种抗体 二、单克隆抗体的制备单克隆抗体技术(monclonal antibody technology)
通常称B淋巴细胞杂交瘤技术,它是1975年英国学者George Kohler与阿根廷学者Cesar Milstein成功将经过绵羊红细胞免疫的小鼠脾脏细胞与体外培养的小鼠骨髓瘤细胞融合在一起,并获得了能产生特异性抗羊红血球单抗的杂交瘤细胞株,杂交瘤细胞既能在体外快速生长,又能持续分泌成分单一的特异性抗体,这种单一类型的、只针对某一特定抗原决定簇的抗体分子,就是单克隆抗体。为此他们荣获1984年度的诺贝尔医学及生理学奖。
The Nobel Prize in Physiology or Medicine 1984
"for the discovery of the principle for production of
monoclonal antibodies"Georges J.F. Koehler
Federal Republic of Germany
Basel Institute for Immunology Basel, Switzerland
b. 1946 d. 1995 Car Milstein
Argentina and United Kingdom
MRC Laboratory of Molecular Biology Cambridge, United Kingdom
b. 1927(in Bahia Blanca, Argentina) d. 2002 单抗的制备过程1.动物免疫与亲本细胞选择
2.细胞融合:淋巴细胞杂交瘤的制备
3.杂交瘤细胞的筛选
4.抗体阳性杂交瘤细胞的筛选
5.抗体阳性杂交瘤细胞株的克隆化培养
6.单克隆抗体的制备和冻存
7.单克隆抗体的纯化 1.动物免疫与亲本细胞的选择免疫方法:体内免疫法或体外免疫法。
体内免疫法:
颗粒性抗原可直接注射入小鼠体内,可溶性抗原则与等量的弗氏完全佐剂混合后注入体内进行初次免疫;
追加免疫1~2次后,在无菌条件下取出脾或淋巴结并制成细胞悬液,细胞存活率在95%以上的用于融合。
体外免疫法:
直接分离大/小鼠淋巴细胞,调整密度为107个/ml,加入适当浓度抗原,CO2箱中培养;
4~5天后,收集被刺激的淋巴细胞,进行细胞融合。淋巴细胞:经过免疫处理的淋巴细胞,多用大/小鼠骨髓瘤细胞:一般不分泌抗体,能在体外无限繁殖和连续继代培养,且为HPRT-或TK-。多用BALB/C 小鼠的骨髓瘤细胞。 2.细胞融合:淋巴细胞杂交瘤的制备将免疫脾细胞和骨髓瘤细胞以2:1~10:1的比例混匀于50ml锥形离心管内,1200rpm离心7~10分钟,尽量吸净上清液,手指轻击管壁使管底沉淀的细胞铺展成薄层;
室温条件下,边轻轻振摇离心管边在60秒钟内逐滴加入PEG融合液,随后静置90秒;
再于5分钟内,边振摇边逐滴加入培养液或盐水缓冲液以终止PEG的作用,再静置10分钟。 3.杂交瘤细胞的筛选加HAT培养基,稀释至细胞不超过2×105/ml;
将细胞悬液加入含有饲养细胞的96孔培养板内,每孔0.1ml,若为24孔板,每孔0.5ml;
每隔2~3天半量换液,7天后可选择出杂交瘤细胞
细胞融合的选择示意图HAT选择系统HAT是含一定浓度次黄嘌呤(H)、氨基喋呤(A)、胸腺嘧啶核苷(T)的一种选择性培养基,其中三种成分与细胞DNA合成有关。
DNA合成途径有两种:杂交瘤技术中,常选用次黄嘌呤鸟嘌呤磷酸核糖转移酶缺陷(HPRT-)骨髓瘤细胞或者是胸腺嘧啶核苷激酶缺陷型(TK-)骨髓瘤细胞为亲本之一;HPRT-细胞的嘌呤核苷酸与TK-细胞的嘧啶核苷酸只能由全合成途径产生。
含氨基喋呤培养基抑制了细胞内嘌呤和嘧啶的全合成途径。
嘌呤核苷酸合成通路的阻断淋巴细胞具有合成DNA的两条途径。
杂种细胞通过互补作用获得HRPT或TK基因,可应用培养基中次黄嘌呤及胸腺嘧啶核苷,通过补救合成途径合成DNA。
在HAT培养基中,HPRT-或TK- 亲本细胞死亡,淋巴细胞亦逐渐死亡,只有杂种细胞存活。
4.抗体阳性杂交瘤细胞的筛选通过选择性培养后生长的杂交瘤细胞,仅有部分是分泌预定特异性抗体的杂交瘤细胞。从融合后8~9天后即可取培养上清进行抗体检测,根据抗原的性质、抗体类型及所需灵敏度等具体情况来加以选择。
颗粒性抗原可采用免疫荧光、51Cr释放试验、溶血空斑测定、补体依赖的细胞毒等方法来直接测定针对这些抗原的抗体。
可溶性抗原可以采用放射免疫、免疫酶标测定、间接血凝等方法测定。
5.抗体阳性杂交瘤细胞株的克隆化培养利用单个细胞培养技术选育出遗传稳定的分泌特异抗体的细胞系。
克隆化培养过程中,一般要加能释放某些生长因子、促进杂交瘤生长的饲养细胞,例如小鼠的腹腔巨噬细胞、脾细胞或胸腺细胞等。
克隆化培养方法有有限稀释法、软琼脂培养法、显微操作法、应用流式等。有限稀释法通过适当的稀释达到分离单个细胞进行培养的目的
1)取出阳性孔内的细胞进行计数;
2)用培养液将其稀释到如10个细胞/ml;
3)于96孔板内每孔加0.1ml,其机率将为每孔落入
一个细胞;
4)加入一定数量的饲养细胞,经过8~12天后,可以
观察到有集落生长的孔;
5)根据检测的阳性结果再次进行克隆化培养。软琼脂培养法在无菌平皿内铺上一层0.5%的琼脂,待凝固后再铺上一层混有杂交瘤细胞和饲养层细胞的0.25%的软琼脂。待细胞长成集落后,可用毛细管吸出小球样团块,移种于含有饲养细胞的96孔板内,继续培养。
6.单克隆抗体的大量制备和冻存1)动物体内诱生法
将降脂烷或石蜡油注入Balb/c小鼠腹腔,0.5ml/只;1~2周后腹腔接种1×106个杂交瘤细胞;7~12天后可抽取腹水,离心去细胞沉淀,取上清夜或纯化单抗或冻存。每毫升腹水中约含5~20mg单抗。
2)利用微载体、微囊、旋转瓶、中空纤维培养系统等进行大规模培养。动物体内诱生法制备单克隆抗体纯化具体方法及过程
1、澄清和沉淀处理
小鼠腹水中含有红细胞、细胞碎块、纤维蛋白凝块及脂质等,首先用离心力1000g离心5min,去除残留的小颗粒物质;再用0.2?m的微孔滤膜过滤除掉污染的细菌、支原体和脂质;最后用饱和硫酸铵沉淀抗体,50%饱和硫酸铵能回收90%以上的单抗。
2、分离
主要分离方法包括凝胶过滤、阴离子交换层析、亲和层析等。 7.单克隆抗体的纯化 (1)凝胶过滤
用于IgG和IgM类单克隆抗体的分离纯化。
常用Sephadex G200作分离介质,可收集到三个峰最高峰为IgM,另两个峰为IgG,
抗体回收率50%~80%,能去除污染的微量杂蛋白,抗体纯度可达95%以上。
(2)阴离子交换层析
用于IgG类单克隆抗体的分离纯化。
在pH7.4条件下,IgG1和IgG2能结合在DEAE填料上,其中IgG2a可在较低离子强度条件下洗脱下来,纯度较高。IgG2b、IgG3在低离子强度下易发生沉淀,可增加离子强度以提高产量,但纯度相对较低。在pH5.5条件下,把杂交瘤细胞培养上清液加到琼脂糖柱上时,所有抗体都能结合到柱上,而55%的杂蛋白可以被洗脱掉,再用不同离子强度的洗脱剂洗下。
在最适离子强度及pH条件下,以离子交换层析来分离单克隆抗体可以纯化25~100倍。高容量、高流速、化学稳定的新型离子交换剂适宜单克隆抗体的大规模纯化。
(3)亲和层析
多用蛋白A亲和层析,适用于IgG类单克隆抗体的纯化
IgG与蛋白A的结合与pH有密切关系,鼠源性单抗在pH8.0时,IgG2b、IgG3几乎全部结合于蛋白A柱上,IgG1稍差,用pH3.5缓冲液可洗脱IgG2b,pH4.0缓冲液可洗脱IgG3,pH4.5缓冲液可洗脱IgG2a,pH6.0可洗脱IgG1。
用蛋白A亲和层析收获的抗体纯度很高,但也有极微量的杂蛋白。 三、单克隆抗体的改造和应用单抗作为体内体外诊断试剂在临床生化诊断、病理组织定位、体内肿瘤的定位等
单克隆抗体靶向制剂,治疗癌症等疾病
单抗作为体内体外诊断试剂现已有各种不同类型的单抗试剂盒在市场出售,例如乙型肝炎表面抗原、铁蛋白、促绒毛膜性激素、促甲状腺激素、癌症、艾滋病等体外单抗诊断试剂。
利用同位素标记单抗在特定组织中成象的技术可用于肿瘤、心血管畸形的体内诊断单克隆抗体靶向制剂1)药物与单抗直接偶联
通过化学反应使药物分子的氨基与抗体分子的羧基之间直接形成稳定的酰胺键。
利用氧化剂把药物分子上的糖基氧化成羰基,羰基与抗体分子的氨基反应形成西佛氏碱,最后还原。
这样的靶向制剂保留一定的药物活性,并具有一定的选择性。例如1,4-溴柔红霉素与肿瘤细胞单抗形成的偶合物,对肿瘤有明显的选择性毒性。2)药物通过小分子与单抗连接
通过一些小分子交联剂,把药物分子上的某些基团和单抗连接起来。
小分子交联剂如同型双功能试剂:戊二醛、顺乌头酸酐、马来酸酐、戊二酐;异型双功能试剂:N-琥珀酰胺基-3-丙酸、寡肽等。
顺乌头酸酐制成的靶向制剂最常用。该靶向制剂在中性条件下较稳定,在酸性条件下容易发生水解。与肿瘤的表面抗原结合后,会进入溶酶体,在酸性环境下释放药物,而杀死肿瘤细胞。3)药物通过大分子与抗体相连
大分子聚合物如葡聚糖、多聚赖氨酸、多聚谷氨酸、聚合多肽和血清蛋白等。
人源单克隆抗体缺乏合适的人骨髓瘤细胞株作为融合亲本。
获得抗原特异的人B淋巴细胞十分困难,对人来说,高度免疫获得抗原特异的B淋巴细胞的方法显然是不可行的。
大量繁殖杂交瘤细胞以获得所需量的抗体较困难,鼠类杂交瘤可以通过小鼠腹腔接种杂交瘤细胞诱生腹水达到目的,人杂交瘤细胞在鼠类中诱生腹水是很十分困难的。 迄今构建人淋巴细胞杂交瘤产生人源单克隆抗体的技术远没有鼠类淋巴杂交瘤技术成熟。有三个主要困难:方法1:分离人B淋巴细胞,使之与荧光标记的抗原相结合,通过荧光标记选择能够产生特异抗体的B淋巴细胞,并用Epstein-Barr病毒转化,最后得到少量的单抗。
方法2:将人源免疫干细胞导入缺失大部分免疫细胞的小鼠体内,遇到抗原时,产生人源的抗体。
方法3:将改造过的人的抗体基因导入鼠胚胎中,能在免疫后得到产生人抗体的转基因鼠。基因工程抗体改造鼠源性单克隆抗体的目的:一是降低免疫原性;二是降低相对分子量,增加组织通透性。
如将鼠源性单克隆抗体的C区用人的Ig分子的C区置换则对人的免疫原性消失。对鼠源性抗体的改造有很多成果报道,包括:
--人-鼠嵌合抗体(人IgC-小鼠IgV,150000)
--改形抗体(将小鼠CDRs替换为人CDRs,150000)
--Fab(完整L链和Fd,50000)
--FV(VH和VL,25000)
--单链抗体(SCFV,VH-多肽-VL,27000)
--单域抗体(VH或VL,12500)及最小识别单位(MRU)
(一个CDR,<2000)杂交人-鼠单克隆抗体抗体同抗原结合的功能决定于抗体分子的V区,同种型免疫原性决定于抗体分子的C区。
在基因水平上把鼠源性单抗的VH和VL分离出来分别与人IgCH和CL连接成人-鼠嵌合体H和L链基因,再共转染骨髓瘤细胞,就能表达出完整的人-鼠嵌合抗体。单链抗体在大肠杆菌的系统中,可以表达VL-衔接物-VH的序列,产生单链抗体。
单链FV片段:抗体分子量小、免疫原性较低,渗透性好,用于实体肿瘤的诊断和治疗。
生物导弹:利用单链抗体序列接上一段药物蛋白的编码序列,表达后的蛋白可根据抗原抗体反应而达到专一性治疗疾病的目的。
双功能抗体片段:两个抗原结合特异性不同的Fab或Fv片段通过二硫键连接起来,如一个结合肿瘤特异性抗原,一个结合杀伤性T细胞,识别和消灭肿瘤细胞的功能可统一在一个单链抗体分子上。抗体融合蛋白将抗体的可变区与一非抗体蛋白融合起来,使融合蛋白继承有抗体分子的结合特异性。可以保留不同程度的抗体结合特异性以及激发其他免疫反应的能力。
抗体酶一种对酶促反应过渡态特异的抗体。结合酶与抗体的优点,既可以起酶促催化作用,又可以起抗体的选择性和专一性结合抗原的作用。
制备抗体酶的方法:
1)利用与过渡态结构相类似的半抗原通过杂交瘤技术生产抗体酶。
2)利用定向催化,即利用抗体的特异性和亲和性使催化反应的两种底物按一定的构象结合并定向,从而降低底物分子的自由度,反应速度加快。
3)对抗体进行化学修饰,使抗体与催化基团相连。本章结束谢谢!
