化学人教版(2019)必修第一册2.1.1钠 课件(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1钠 课件(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 07:02:06 | ||
图片预览








文档简介
(共22张PPT)
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第1 课时 钠
1. 结合真实情境中的应用实例,通过实验探究,了解钠的主要性质。
2. 能描述单质钠的物理性质和化学性质。
3. 认识钠与氧气、水的反应,并能书写有关的化学方程式。
4. 了解钠的制取和用途。
教学引入:神奇的金属钠
金属钠的物理性质
1
1.1
钠的物理性质
颜色
密度 硬度 传导性 熔点 银白色、有金属光泽
0.971g/cm3
ρ(水)>ρ(钠)>ρ(煤油)
质地软
可用小刀切割
可导热、可导电
熔点低于100℃
钠保存在煤油中
金属钠的化学性质
2
2.1
钠与氧气的反应
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
实验2-1
新切开的钠的光亮的表面很快变暗了。
现象
4Na+O2══2Na2O
在实验室中,要把钠保存在石蜡油或煤油中。
2.1
钠与氧气的反应
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验2-2
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰生成一种淡黄色固体。
现象
2Na+O2 Na2O2
Δ
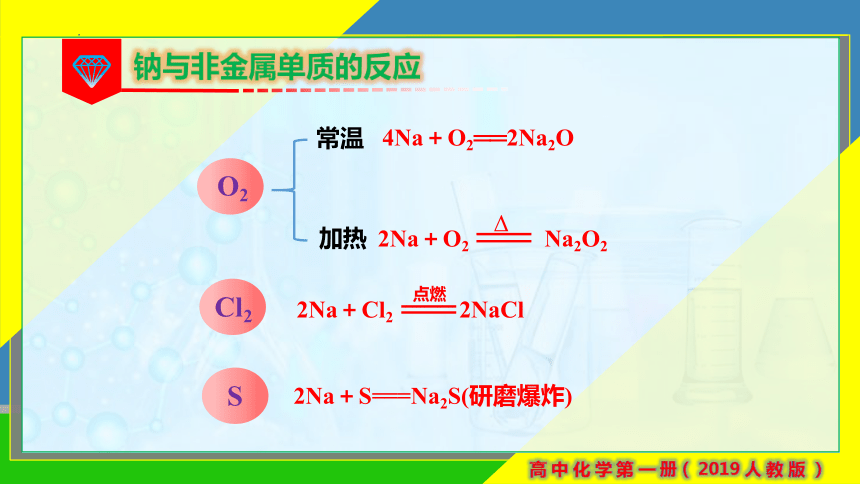
钠与非金属单质的反应
O2
S
Cl2
常温
加热
4Na+O2══2Na2O
2Na+S===Na2S(研磨爆炸)
2Na+O2 Na2O2
Δ
2Na+Cl2 2NaCl
点燃
2.1
钠与水的反应
2.1
钠与水的反应
2Na+2H2O ══ 2Na++2OH-+H2↑
现象 结论
1.钠 在水面上。 1.钠的密度比水 。
2.钠熔化成 。 2.钠熔点较 ,且反应 。
3.小球在水面上迅速 , 逐渐变小,最后 。 3.反应产生的气体推动小球运动。
4.与水反应发出 响声。 4.钠与水反应生成气体。
5.反应后溶液的颜色逐渐变 。 5.有 生成。
浮
小
明亮的小球
嘶嘶
放热
游动
消失
红
NaOH
浮
响
熔
游
红
低
钠着火不能用水
而需要用干燥的沙土来灭火
2.2
钠与酸的反应
2Na+2HCl ══ 2NaCl+H2↑
2Na+2H+ ══ 2Na+ + H2↑
“先酸后水”
反应比与水反应更剧烈。
先水后盐
①钠与硫酸铜溶液反应
熔融盐可置换
2Na+2H2O+Cu2+══2Na++Cu(OH)2↓+H2↑
②钠与熔融氯化钛
2Na + 2H2O == 2NaOH + H2↑
2Na+2H2O+CuSO4 ===Cu(OH)2↓+Na2SO4+H2↑
4Na+TiCl4 ══ 4NaCl+Ti
熔融
2.2
钠与盐的反应
课堂检测
C
1.在钠的下列用途中,利用的是钠的物理性质的是:( )①制取过氧化钠等化合物 ②制钠钾合金,作快中子反应堆的热交换剂 ③还原钛等金属 ④制高压钠灯A.①② B.①③ C.②④ D.③④
【解析】①制过氧化钠,钠与氧气加热反应生成过氧化钠,体现钠的还原性,故①错误;②与钾混合作原子反应堆的导热剂,是因为钠的良好的导电性,属于物理性质,故②正确;③还原钛等金属,体现钠的还原性,属于钠的化学性质,故③错误;④做高压钠灯,是因为钠的焰色为黄色,透雾性强,焰色反应属于物理性质,故④正确;
2.将金属钠放入盛有某溶液的烧杯中,既有气泡产生又有白色固体析出。该溶液可能是:( )A.FeCl3溶液 B.饱和NaCl溶液
C.K2SO4稀溶液 D.CuCl2稀溶液
课堂检测
B
3.将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是: ( )
A.钠浮在煤油层上,不反应
B.钠沉在煤油层下,不反应
C.钠沉在水层下剧烈反应
D.钠在煤油与水的界面处剧烈反应,并不断上浮、下沉
D
课堂检测
钠的制取与用途
3
3.1
钠的制取
是熔融NaCl
不是NaCl溶液
3.2
钠的用途
导热剂
1.钠钾合金(液态)可用于原子反应堆__________
2.用作电光源,制作高压钠灯
3.制取过氧化钠
4.作强还原剂,将某些稀有金属从他们的卤化物中还原出来
4.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。同学们对此有下列一些理解,其中错误的是
A.金刚石属于非金属单质
B.该反应可能在空气中进行
C.另一种化合物为NaCl,是氧化产物
D.这个反应是置换反应
B
课堂检测
化合态
存在形态
熔点低
密度小
硬度小
物理性质
与O2反应
与H2O反应与酸反应
与盐反应
化学性质
保存在煤油或石蜡油
制取保存用途
钠
课堂总结
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第1课时 钠
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第1 课时 钠
1. 结合真实情境中的应用实例,通过实验探究,了解钠的主要性质。
2. 能描述单质钠的物理性质和化学性质。
3. 认识钠与氧气、水的反应,并能书写有关的化学方程式。
4. 了解钠的制取和用途。
教学引入:神奇的金属钠
金属钠的物理性质
1
1.1
钠的物理性质
颜色
密度 硬度 传导性 熔点 银白色、有金属光泽
0.971g/cm3
ρ(水)>ρ(钠)>ρ(煤油)
质地软
可用小刀切割
可导热、可导电
熔点低于100℃
钠保存在煤油中
金属钠的化学性质
2
2.1
钠与氧气的反应
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
实验2-1
新切开的钠的光亮的表面很快变暗了。
现象
4Na+O2══2Na2O
在实验室中,要把钠保存在石蜡油或煤油中。
2.1
钠与氧气的反应
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
实验2-2
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰生成一种淡黄色固体。
现象
2Na+O2 Na2O2
Δ
钠与非金属单质的反应
O2
S
Cl2
常温
加热
4Na+O2══2Na2O
2Na+S===Na2S(研磨爆炸)
2Na+O2 Na2O2
Δ
2Na+Cl2 2NaCl
点燃
2.1
钠与水的反应
2.1
钠与水的反应
2Na+2H2O ══ 2Na++2OH-+H2↑
现象 结论
1.钠 在水面上。 1.钠的密度比水 。
2.钠熔化成 。 2.钠熔点较 ,且反应 。
3.小球在水面上迅速 , 逐渐变小,最后 。 3.反应产生的气体推动小球运动。
4.与水反应发出 响声。 4.钠与水反应生成气体。
5.反应后溶液的颜色逐渐变 。 5.有 生成。
浮
小
明亮的小球
嘶嘶
放热
游动
消失
红
NaOH
浮
响
熔
游
红
低
钠着火不能用水
而需要用干燥的沙土来灭火
2.2
钠与酸的反应
2Na+2HCl ══ 2NaCl+H2↑
2Na+2H+ ══ 2Na+ + H2↑
“先酸后水”
反应比与水反应更剧烈。
先水后盐
①钠与硫酸铜溶液反应
熔融盐可置换
2Na+2H2O+Cu2+══2Na++Cu(OH)2↓+H2↑
②钠与熔融氯化钛
2Na + 2H2O == 2NaOH + H2↑
2Na+2H2O+CuSO4 ===Cu(OH)2↓+Na2SO4+H2↑
4Na+TiCl4 ══ 4NaCl+Ti
熔融
2.2
钠与盐的反应
课堂检测
C
1.在钠的下列用途中,利用的是钠的物理性质的是:( )①制取过氧化钠等化合物 ②制钠钾合金,作快中子反应堆的热交换剂 ③还原钛等金属 ④制高压钠灯A.①② B.①③ C.②④ D.③④
【解析】①制过氧化钠,钠与氧气加热反应生成过氧化钠,体现钠的还原性,故①错误;②与钾混合作原子反应堆的导热剂,是因为钠的良好的导电性,属于物理性质,故②正确;③还原钛等金属,体现钠的还原性,属于钠的化学性质,故③错误;④做高压钠灯,是因为钠的焰色为黄色,透雾性强,焰色反应属于物理性质,故④正确;
2.将金属钠放入盛有某溶液的烧杯中,既有气泡产生又有白色固体析出。该溶液可能是:( )A.FeCl3溶液 B.饱和NaCl溶液
C.K2SO4稀溶液 D.CuCl2稀溶液
课堂检测
B
3.将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是: ( )
A.钠浮在煤油层上,不反应
B.钠沉在煤油层下,不反应
C.钠沉在水层下剧烈反应
D.钠在煤油与水的界面处剧烈反应,并不断上浮、下沉
D
课堂检测
钠的制取与用途
3
3.1
钠的制取
是熔融NaCl
不是NaCl溶液
3.2
钠的用途
导热剂
1.钠钾合金(液态)可用于原子反应堆__________
2.用作电光源,制作高压钠灯
3.制取过氧化钠
4.作强还原剂,将某些稀有金属从他们的卤化物中还原出来
4.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。同学们对此有下列一些理解,其中错误的是
A.金刚石属于非金属单质
B.该反应可能在空气中进行
C.另一种化合物为NaCl,是氧化产物
D.这个反应是置换反应
B
课堂检测
化合态
存在形态
熔点低
密度小
硬度小
物理性质
与O2反应
与H2O反应与酸反应
与盐反应
化学性质
保存在煤油或石蜡油
制取保存用途
钠
课堂总结
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第1课时 钠
